Введение. За последние 20 лет в связи с внедрением в урологическую практику высокотехнологичных вмешательств характер инфекционно-воспалительных осложнений после оперативных вмешательств изменился радикально. Повторные дробления камней в почках, мочеточнике перкутанным, трансуретральным, дистанционным доступами опасны возникновением системного воспалительного ответа с последующим развитием септических осложнений, вплоть до эндотоксического шока.
Известно, что уреазопродуцирующие бактерии, к которым относятся Ureaplasma urealyticum, Proteuss spp., Staphylococcus aureus, Klebsiella spp., Pseudomona spp., являются наиболее значимыми этиологиче- скими факторами, провоцирующими образование «инфекционных» конкрементов. Находясь в чашечках и лоханках, они вызывают нарушение коллоидного равновесия мочи (суперсатурацию) и становятся центром кристаллизации струвитных (MgNH4PO4 6H2O) или карбонатапатитных (Ca10(PO4)6CO3) камней. В ускорении процесса кристаллизации определенную роль играют и входящие в состав клеточной стенки бактерий полисахариды, которые связывают ионы Ca2+ и Mg2+ – компоненты вышеназванных камней [1–3]. Более того, бактерии способны длительно находиться в почечных камнях в составе биопленки. Бактериальные биопленки и механическая травма тканей лоханки камнем являются причиной развития воспалительного процесса в области расположения камня с формированием соединительнотканных спаек, выполняющих функцию отграничения камня от тканей почечной лоханки и одновременно функцию прочной фиксации камня к стенке лоханки.
Разрушение камней во время операции или литотрипсии может являться пусковым механизмом активации роста микроорганизмов, интегрированных в биопленку, а миграция бактерий в сосудистое русло вызывать септические осложнения [4].
Лечение инфекционно-воспалительных осложнений после дробления таких инфекционных камней затруднено тем, что сведения о возбудителях внутри камня до его дробления отсутствуют, а при назначении антимикробной профилактики руководствуются данными бактериологического исследования мочи, проведенного до оперативного вмешательства. В проведенном нами ранее исследовании [5] показана значительная разница в высеваемости возбудителей из мочи до операции и из камней, удаленных во время дробления, у одного и того же пациента. Частота выделения микроорганизмов из камня значительно выше, чем из мочи: 59,4 против 33,3% соответственно (р<0,001). Отсутствие бактериурии у пациентов с камнями в мочевых путях не отражает наличия микроорганизмов в камне. Кроме того, микроорганизмы в моче и камне могут быть различными.
 Остатки биопленок и осколки камней после перкутанных и контактных вмешательств служат основой для быстрого рецидива камней в почках после дробления. Частое развитие инфекционно-воспалительных осложнений после перкутанных операций по поводу камней почек, выявленное различие уропатогенов в моче и камнях почки требуют поиска новых режимов антимикробной профилактики подобного рода осложнений.
Остатки биопленок и осколки камней после перкутанных и контактных вмешательств служат основой для быстрого рецидива камней в почках после дробления. Частое развитие инфекционно-воспалительных осложнений после перкутанных операций по поводу камней почек, выявленное различие уропатогенов в моче и камнях почки требуют поиска новых режимов антимикробной профилактики подобного рода осложнений.
Цель: оценить эффективность различных способов введения антибиотика ципрофлоксацин (ципринол, КРКА) – внутривенно болюсно или в виде длительной внутривенной капельной инфузии, используемых в качестве средства профилактики инфекционно-воспалительных осложнений при перкутанных операциях на почках.
Материалы и методы. Исследование проведено в клинических отделениях НИИ урологии. Микробиологические исследования проведены в лаборатории ООО «Национальное агент- ство по клинической фармакологии и фармации». Фармакокинетические исследования (№ 150) выпол- нены в 2013 г. на кафедре клинической фармакологии РНИМУ им. Н. И. Пирогова. После подписания информированного согласия в исследование были включены 30 пациентов, которым предстояла перкутанная нефролитолапаксия по поводу коралловидных и крупных (>20 мм) камней почек. Больных рандомизировали в две группы. В основной группе антимикробную профилактику проводили путем внутривенной капельной инфузии 1000 мг ципрофлоксацина в течение всей операции (45–60 мин). В группе сравнения пациенты получали тот же препарат в той же дозировке путем внутривенного болюсного введения в течение 5 мин сразу после пункции почки. Пробы крови (5 мл) забирали через 10, 20, 40, 60 мин после начала операции (последний отбор совпадал со временем окончания оперативного вмешательства). Перед введением антибиотика забирали 5 мл крови — «0» (нулевая) проба крови. Определение концентрации ципрофлоксацина в сыворотке крови производили методом высокоэффективной жидкостной хромато- графии с флуориметрическим детектором RF-551 («Shimatzu», Япония).
При перкутанной нефролитотрипсии применяли пневматические, ультразвуковые литотрипторы LithoclastMaster, при лазерной литотрипсии – гольмиевый лазер Auriga XL (волокно 600 нм, мощность 1800–2500 мДж, частота 12 Гц). Интраоперационно мочу и фрагмент удаленного камня отправляли на бактериологическое исследование. Кроме того, изучали химический состав удаленных камней. В ближайшем послеоперационном периоде после перкутанной нефролитотрипсии оценивали общее состояние пациентов, самочувствие, температуру тела, клинический анализ крови и мочи, наличие инфекционно-воспалительных осложнений, макрогематурии. Проводили ультразвуковой контроль состояния почек, фрагментов камней почек, чашечно-лоханочной системы, мочеточников. По показаниям проводили антеградную пиелоуретерографию.
Результаты. Возраст пациентов, 65% из которых были женщины, колебался от 20 до 75 лет (средний возраст – 49,1 года). Длительность операции в среднем составила 67,5 (15–110) мин.
Из сопутствующих заболеваний у пациентов обеих групп чаще всего встречались гипертоническая болезнь (53,3%), сахарный диабет (30%). Большинство (56,6%) пациентов в анамнезе имели неоднократные операции и вмешательства по поводу камней почек и мочеточников, в 50% наблюдений длительность заболевания превышала 10 лет. Пациенты обеих групп были сопоставимыми по характеру сопутствующих заболеваний. При исследовании химического состава камней чаще определяли смешанные камни, такие как carbonate apatite (phosphate), magnesium ammonium phosphate, calcium oxalate monohydrate, uric acid dihydrate, ammonium urate, calcium-oxalate-dihydrate.
При сравнительном анализе также не выявлено достоверных различий в химическом составе камней у пациентов двух групп.
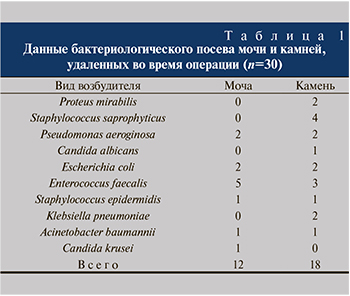
Результаты бактериологических исследований представлены в табл. 1.
Таким образом, уропатогены имели место и в моче, и в камнях, причем в камнях микроорганизмы обнаруживали чаще (60 против 40%).
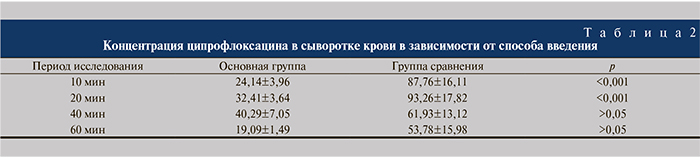
Как показали результаты фармакокинетических исследований (табл. 2), достоверные различия в создаваемых концентрациях препарата в крови отмечаются только через 10 и 20 мин после введения (выше при болюсном способе введения); начиная с 40-й минуты статистически значимых различий в сывороточных концентрациях ципрофлоксацина не выявлено, при этом, однако, сохраняется тенденция к более высоким значениям при использовании болюсного способа введения. В то же время при болюсном методе введения отмечена бόльшая вариабельность кинетики антибиотика. С учетом известных данных о периоде полувыведения ципрофлоксацина, равном 5,5–6 ч, становится очевидным, что эффективные концентрации ципрофлоксацина (выше МПК90 для большинства микроорганизмов) сохранятся в течение как минимум 12 ч после введения.
При сравнении клинической эффективности антибактериальной профилактики инфекционно-воспалительных осложнений двух режимов дозирования ципрофлоксацина в исследуемой дозировке отмечен несколько более выраженный эффект продленной внутривенной инфузии ципрофлоксацина в течение всей операции. Так, в основной группе пациентов в раннем послеоперационном периоде у двоих констатирована кратковременная гипертермия до 37–38°С без озноба, температура тела нормализовалась уже ко 2-м суткам. Признаков системной воспалительной реакции не отмечено. В то же время в группе сравнения в первые сутки гипертермия до 37,7–38°С отмечена также у 2 пациентов, однако она сопровождалась лейкоцитозом от 10 до 15,8∙109/л и повышением СОЭ до 25–30 мм/ч. Температура тела оставалась повышенной в течение 4 сут, нормализуясь к 5-м суткам после операции. Также нормализовались и показатели лейкоцитов крови. В послеоперационном периоде этим пациентам в зависимости от чувствительности выделенных микроорганизмов назначали различные антибактериальные пре- параты.
Развития септических осложнений, острого пиелонефрита не было отмечено ни у одного пациента.
Все пациенты были выписаны в удовлетворительном состоянии на 6–9-е сутки после операции.
Обсуждение. Полученные данные свидетельствуют о том, что оба способа введения – болюсное и продленное внутривенное – обеспечивают создание высокой концентрации ципрофлоксацина в крови в течение всего оперативного вмешательства, позволяющей рассчитывать на подавление роста большинства микроорганизмов, включая «проблемные» возбудители (P. aeruginosa, Acinetobacter spp.). Большая вариабельность кинетики ципрофлоксацина констатирована при его болюсном введении. Клиническую эффективность антимикробной профилактики двух изученных режимов внутривенного введения 1000 мг ципрофлоксацина можно оценить как хорошую, позволяющую избегать развития септических осложнений после перкутанных нефролитотрипсий, вне зависимости от возраста пациентов, химического состава камней, типа используемого литотриптера, наличия исходной бактериурии и сопутствующих заболеваний. Несколько лучший клинический эффект в раннем послеоперационном периоде отмечен после продленного внутривенного введения ципрофлоксацина на протяжении всей операции – перкутанной нефролитотрипсии, что, однако, требует дальнейшего изучения.
Заключение. Ципрофлоксацин – антибактериальный препарат, эффективность которого зависит от величины создаваемой им максимальной концентрации в крови и тканях и биодоступности. При двух способах введения препарата (болюсное и продленное внутривенное) достигается максимальная концентрация (Cmax), превышающая минимально подавляющую концентрацию для большинства возбудителей мочевой инфекции, включая «проблемные» микроорганизмы. Более стабильные значения сывороточной концентрации ципрофлоксацина в группе пациентов, получавших внутривенную капельную инфузию препарата на протяжении всей операции, позволяют предположить, что эффективность данного способа может быть несколько выше, чем его болюсное введение. Доза 1000 мг ципрофлоксацина в качестве антибактериальной профилактики инфекционно-воспалительных осложнений при перкутанных операциях на почке по поводу камней не вызывает токсических концентраций в сыворотке крови и нежелательных побочных реакций.


