Введение. Бесплодие – медицинская проблема, с которой сталкиваются около 15% пар в развитых странах и до 30% в странах Центральной Африки и Азии [1, 2]: в 2/3 случаев оно первичное, в 1/3 – вторичное [3]. Этиология бесплодия многофакторная – в четверти случаев бесплодие вызвано только мужским фактором и в половине случаев имеют место сочетанные нарушения одновременно у мужа и жены [4–6].
 Инфекции мужских половых органов считают одной из потенциально исправимых причин снижения мужской фертильности [4, 7, 8]. От 2 до 20% случаев мужского бесплодия (до 35–70% в отдельных возрастных и этнических группах) связывают с инфекциями мужских половых путей, включая простатит [4, 9, 10]. Распространена точка зрения, согласно которой увеличение концентрации лейкоцитов в генитальном тракте и сперме сопровождается снижением концентрации доли подвижных и морфологически нормальных форм сперматозоидов [11–14]. Опубликованные данные объясняют снижение качества эякулята при хроническом простатите (ХП) следствием нарушения физико-химических свойств семенной жидкости [7, 15–17], воздействия активных форм кислорода (АФК) [18–21], прямого и опосредованного токсического действия патогенных микроорганизмов [22–24].
Инфекции мужских половых органов считают одной из потенциально исправимых причин снижения мужской фертильности [4, 7, 8]. От 2 до 20% случаев мужского бесплодия (до 35–70% в отдельных возрастных и этнических группах) связывают с инфекциями мужских половых путей, включая простатит [4, 9, 10]. Распространена точка зрения, согласно которой увеличение концентрации лейкоцитов в генитальном тракте и сперме сопровождается снижением концентрации доли подвижных и морфологически нормальных форм сперматозоидов [11–14]. Опубликованные данные объясняют снижение качества эякулята при хроническом простатите (ХП) следствием нарушения физико-химических свойств семенной жидкости [7, 15–17], воздействия активных форм кислорода (АФК) [18–21], прямого и опосредованного токсического действия патогенных микроорганизмов [22–24].
В то же время имеются работы, в которых оспаривается взаимосвязь ХП и лейкоцитоспермии, с одной стороны, и параметрами спермограммы, с другой [10, 25–28]. По мнению экспертов Европейской ассоциации урологов [5], убедительных данных за то, что ХП оказывает влияние на качество спермы и служит причиной мужского бесплодия, на сегодняшний день нет. Очевидно, снижение фертильности при ХП имеет место не всегда и зависит от массы дополнительных факторов, которые приводят к дисбалансу компенсаторно-приспособительных и дезадаптивных реакций, возникающих в процессе течения хронического заболевания.
Нами проведено исследование с целью изучения комплекса факторов, приводящих к снижению фертильности у мужчин с ХП. Настоящая статья представляет фрагмент данного исследования и посвящена роли клинико-анамнестических и микробных факторов в развитии бесплодия при ХП.
Материал и методы. Исследование носило многоцентровый комплексный клинико-лабораторный одномоментный ретроспективный характер. Проведен анализ медицинских карт и компьютерных историй болезни 3174 мужчин в возрасте от 20 до 45 лет, состоявших в гетеросексуальных брачных отношениях и живших регулярной половой жизнью.
Обследование пары и исследование спермы выполнены в соответствии с требованиями ВОЗ [4, 29]. Концентрация лейкоцитов определена путем окраски нативного эякулята на пероксидазу с помощью набора LeucoScrin® (FertiPro N.V., Бельгия) и с вычислением доли лейкоцитов среди круглых клеток, подсчитанных в счетных камерах (Маклера, Горяева), после краски азур-эозином по Романовскому (ЭКОлаб-Гем-Романовский, Россия).
Ультразвуковое исследование мошонки, простаты и семенных пузырьков проведено с применением конвексного абдоминального и ректального мультипланового датчиков по стандартным методикам на аппаратах LOGIQ-5 и -9 «GE» (США), Flex Focus-1202 «B-K Medical» (Дания). Для оценки эвакуаторной способности семенных пузырьков их УЗИ выполнено до и после эякуляции: недостаточностью опорожнения считали уменьшение размеров семенного пузырька после эякуляции менее чем на 65% от исходного.
На первом этапе исследования по данным спермограммы 3023 мужчин из бесплодных пар выделена группа пациентов (n=572) с лабораторными признаками воспалительного процесса в репродуктивном тракте в виде лейкоцитоспермии (>1 млн/мл). На втором – группа пациентов (n=164), у которых продолжительность ХП превышала таковую вынужденного бесплодия (ПВБ) и не было других установленных причин снижения фертильности (нарушения кариотипа, микроделеции AZF, крипторхизм, варикоцеле, гидроцеле, эректильная дисфункция, перенесенные операции на органах мошонки, а также снижение концентрации сперматозоидов менее 5 млн/мл независимо от этиологии), а супруги не имели очевидных причин бесплодия (нарушения овуляции, трубный фактор, инфекционно-воспалительные процессы). На третьем этапе из анализа были исключены 64 мужчины с первичным бесплодием, у которых возможной причиной снижения репродуктивной функции могли быть невыявленные генетические факторы (процесс сперматогенеза регулируют более 2000 генов). Оставшихся пациентов (n=100) мы считали вторично бесплодными вследствие ХП (БХП), что соответствовало диагнозу «инфекции придаточных половых желез» (по ВОЗ, 2000). Группу сравнения – фертильных мужчин с ХП (ФХП) составили пациенты (n=105) с диагнозом ХП более года, имевшие детей моложе года (или факт беременности у жены), с симптомами нижних мочевыводящих путей (СНМП) или с бессимптомными формами воспаления, обнаруженного при диспансеризации, не предъявлявшие жалоб на бесплодие. Восемьдесят четыре урологически здоровых фертильных волонтеров и мужчин, обследованных при плановой диспансеризации, имевших нормозооспермию и нормальное содержание лейкоцитов в сперме, составили контрольную группу здоровых фертильных мужчин. Такое деление на группы позволило, с одной стороны, оценить изменения, характерные для всех больных ХП, с другой – определить факторы, имеющие патогенетическое значение в развитии бесплодия при ХП.

Этиологический фактор воспаления выявлен молекулярно-биологическими и культуральными методами. Инфекцию, вызванную Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis, Trichomonas vaginalis, Neisseria gonorrhoeae, диагностировали по наличию в мазке из уретры специфической ДНК с использованием коммерческих систем ЗАО «Вектор-Бест» (Россия), амплификаторов iCycler iQTM («BIORAD», США), Маsterсус1ег 5330 (Ерреendorf) по стандартной методике, присутствие в сперме условно-патогенных микроорганизмов – посевом на плотные питательные среды. Бактериологическое исследование секретов половых желез включило идентификацию микроорганизмов, вычисление числа колониеобразующих единиц (КОЕ), оценку антибиотикочувствительности дискодиффузионным методом [30]. Параллельно с идентификацией микроорганизмов с помощью планшетного фотометра Multiskan-Ascent («Termo-Labsystems», Финляндия) выполнена оценка интегрального показателя антиинфекционной резистентности (ПАИР) эякулята. Тестирование осуществлено по трем штаммам: E. coli, Ps. aeruginosa и S. epidermidis. После проведения кинетических измерений роста интактных микроорганизмов в жидкой питательной среде и в среде с добавлением спермальной плазмы больного рассчитан процент подавления роста микроорганизмов спермальной плазмой больного по сравнению с контролем.
 Для статистической обработки результатов использован пакет прикладных программ STATISTICA (StatSoft Inc., США). Вычислена медиана (Me), 25–75% квартилей (Q25–Q75%). О достоверности различий судили при помощи критериев Манна–Уитни и Фишера. Для выявления корреляционных зависимостей вычислен коэффициент R Спирмена, проведен однофакторный дисперсионный анализ (метод Краскелла–Уоллиса для независимых выборок).
Для статистической обработки результатов использован пакет прикладных программ STATISTICA (StatSoft Inc., США). Вычислена медиана (Me), 25–75% квартилей (Q25–Q75%). О достоверности различий судили при помощи критериев Манна–Уитни и Фишера. Для выявления корреляционных зависимостей вычислен коэффициент R Спирмена, проведен однофакторный дисперсионный анализ (метод Краскелла–Уоллиса для независимых выборок).
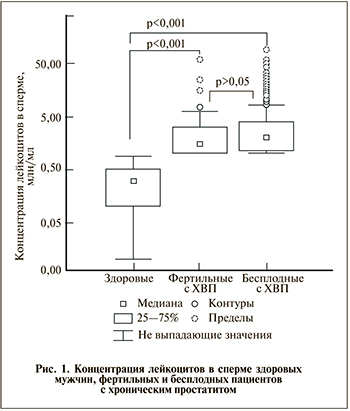
Результаты. Диагноз ХП упоминался в анамнезе 30,9% мужчин (934 из 3023), обследованных по поводу бесплодного брака. Лабораторно подтвержденные случаи воспалительного ХП в виде лейкоцитоспермии на момент обследования имели место в 18,9% случаев (571 из 3023). При этом концентрация спермальных лейкоцитов в группе БХП была существенно больше, чем у здоровых мужчин (p<0,001), но значимо не отличалась от ФХП (p>0,05): 2,0 (1,1–3,9); 0,3 (0,1–0,5) и 1,55 (1,0–3,1) млн/мл соответственно (рис. 1).
Следовательно, снижение фертильности при ХВП зависело не от концентрации лейкоцитов в сперме, а от неких дополнительных кофакторов, которые мы для удобства анализа разделили на анамнестические, клинические и лабораторные.
Возраст пациентов группы БХП составил 35 (29–40) лет, что не отличалось от такового в группах здоровых мужчин и ФХП (p>0,05). Выявлены положительные корреляционные связи между возрастом больных, с одной стороны, и ПВБ (R=0,19; p<0,048), продолжительностью анамнеза ХП (R=0,48; p<0,001), с другой, а также между продолжительностью анамнеза ХП и фактом констатации бесплодного брака (R=0,14; p=0,04), продолжительностью ХП и ПВБ (R=0,90; p<0,001). Продолжительность анамнеза ХП у фертильных больных была меньше, чем у бесплодных: 3 (2–4) и 4 (2,5–4) года соответственно (p=0,041); медиана ПВБ в группе бесплодных больных ХП составила 24 (18–36) мес. Расчеты показали, что относительный риск нарушения фертильности при продолжительности анамнеза ХБП больше 2 лет увеличивается в 2,72 раза, больше 5 лет – в 4,02.
У мужчин с БХП чаще, чем с ФХП, происходят обострения заболевания: 2 (2–3) и 2 (1–2) раза в год соответственно (p=0,018). Корреляция между частотой обострений и ПВБ статистически значима (R=0,22; p=0,004). Относительный риск развития бесплодия при частоте обострения ХБП больше 2 раз в год составляет 2,6.
Жалобы, предъявляемые больными, в большинстве случаев соответствовали классической картине ХП и представлены болью (в промежности, мошонке, половом члене, над лобком) и дизурией. Фертильные мужчины с ХП по сравнению с БХП несколько чаще отмечали боли/парестезии в промежности (66,2 и 59,3% соответственно; p=0,043), прерывистое мочеиспускание (29,5 и 17%; p=0,036) и ощущения неполного опорожнения мочевого пузыря (21,9 и 10,7%; p=0,028) при меньшей частоте выявления простатореи (27,6 и 40,2%; р=0,35) и жалоб на появление или усиление болей/дискомфорта после эякуляции (12,4 и 24,1%; р=0,035). Бессимптомная форма ХП у бесплодных больных имела место в 32% случаев. Однако корреляционный анализ не выявил значимых связей между отдельными клиническими проявлениями ХП и наличием бесплодия, продолжительностью анамнеза и частотой обострений (p>0,05).
Проведенные инструментальные исследования показали (табл. 1), что у БХП на фоне типичных для этого заболевания особенностей эхоструктуры простаты достоверно чаще выявлялись фиброз и простатолитиаз: 29,7 (19/64) против 16,2% (11/68) у ФХП (p=0,029) и 0% (0/41) у здоровых мужчин (p<0,001). Это подтвердили данные корреляционного анализа: обнаружена положительная взаимосвязь наличия простатолитов с фактом констатации бесплодного брака (R=0,24; p<0,001), продолжительностью ХП (R=0,24; p=0,013) и частотой обострения заболевания (R=0,18; p<0,001). Выявлена положительная корреляция факта простатолитиаза и недостаточности опорожнения правого и левого семенных пузырьков (R=0,36 и 0,33 соответственно; p<0,001). Отмечено, что нарушение опорожнения семенных пузырьков характерно для всех больных ХП, но наиболее выраженные изменения имели место в группе бесплодных пациентов: такие нарушения диагностировали у 91,1% БХП против 11,8% у здоровых мужчин (p<0,001) и 66,7% у ФХП (p=0,001). Выраженность нарушения опорожнения семенных пузырьков коррелировала с частотой констатации бесплодия в браке (R=0,47 для правого и R=0,55 для левого пузырьков; p<0,001 в обоих случаях). Таким образом, простатолитиаз и нарушения опорожнения семенных пузырьков можно считать фактором риска развития бесплодия при ХП (ОШ=1,8 и 1,4 соответственно).
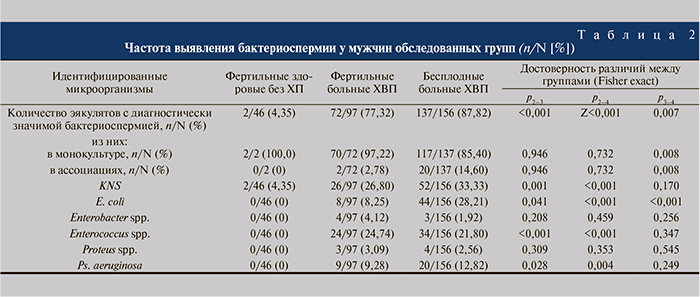
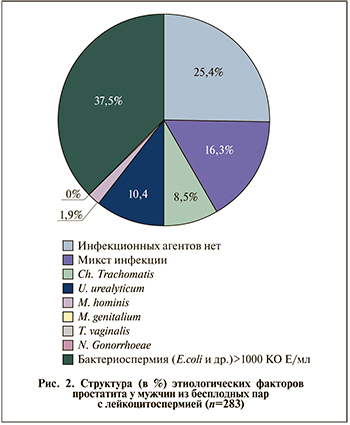
Данные микробиологического и молекулярно-биологического исследований показали, что чаще всего этиологическим фактором воспалительного процесса выступали аэробные грамотрицательные микроорганизмы (E. coli и др.; 37,5% случаев) или микст-инфекции – 16,3%; C. trachomatis как единственная диагностированная бактериальная инфекция была обнаружена в 8,5% случаев, U. urealyticum – в 10,4%, M. hominis – в 1,9%. T. vaginalis и N. gonorrhoeae в данной группе обнаружены не были. В 25,4% случаев этиологический фактор воспаления установить не удалось (рис. 2). В группе БХП количество эякулятов с диагностически значимой бактериоспермией достигло 88%, несколько реже (77%) это наблюдалось у ФХП, но в обоих случаях существенно чаще, чем у здоровых мужчин (табл. 2; p<0,01–0,001). Причем микробный профиль пациентов БХП отличался от такового в группе ФХП за счет увеличения частоты встречаемости E. coli (p<0,041–0,001) и появления бактериальных ассоциаций (p=0,008). Определено, что относительный риск бесплодия при выявлении в эякуляте E. coli повышен в 4,1 раза. Выявлена отрицательная корреляция между наличием более одного диагностически значимого штамма в эякуляте и фактом констатации фертильного брака (R=-0,22; p<0,001); относительный риск бесплодия при наличии микробных ассоциаций достигает 6,9.
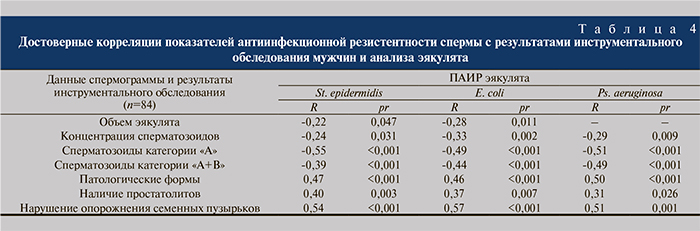
Результаты исследования антиинфекционной резистентности спермальной плазмы показали (табл. 3), что для БХП было характерно достоверное увеличение ПАИР (увеличение % колоний микроорганизмов, выросших в бульоне с добавлением спермальной плазмы исследуемого человека, по сравнению с бульоном без спермальной плазмы) по всем тестируемым штаммам (p<0,001 во всех случаях по сравнению с итоговыми показателями здоровых мужчин и ФХП).
В группе БХП число мужчин, имевших ПАИР эякулята более 100% (т.е. состояние полного отсутствия антибактериальной резистентности in vitro: добавление спермальной плазмы ускоряло рост тестируемого штамма) достоверно превышало аналогичный показатель групп здоровых мужчин и ФХП во всех случаях. Превышение ПАИР 100%-ного рубежа при исследовании резистентности к St. epidermidis было отмечено в 60% протестированных эякулятов в группе бесплодных больных ХБП в отсутствие таких случаев в группах ФХП и здоровых мужчин; по штамму E. coli: в 82,5, 8,3 и 0% соответственно; по штамму Ps. aeruginosa: 25, 4,2 и 0% соответственно (p<0,05 во всех случаях). У ФХП, напротив, имели место обратные тенденции: повышение антибактериальной резистентности эякулята ко всем тестируемым штаммам микроорганизмов, выразившееся в снижении медианы ПАИР по сравнению с аналогичными параметрами группы здоровых мужчин.

Выявлены достоверные корреляции между величиной ПАИР и параметрами спермограммы, а также некоторыми результатами инструментального обследования (табл. 4). В частности, между величиной ПАИР для E. coli, с одной стороны, и наличием простатолитов, нарушением опорожнения семенных пузырьков, процентом патологических форм – положительная (p<0,007–0,001), объемом эякулята, концентрацией сперматозоидов, прогрессивной подвижностью и общим содержанием прогрессивно подвижных и морфологически нормальных сперматозоидов в эякуляте (индекс качества) – отрицательная (p<0,011–0,001), с другой. В связи с этим нарушение антиинфекционной резистентности эякулята следует признать фактором риска снижения фертильности при ХБП: при повышении ПАИР эякулята более 100% риск бесплодия составляет 92%.
Обсуждение. Несмотря на кажущуюся очевидность точки зрения, согласно которой воспаление простаты сопровождается увеличением лейкоцитов, а они неизбежно повреждают сперматозоиды, истинное положение вещей до сих пор не известно. Лейкоциты простатического происхождения встречаются со сперматозоидами лишь на очень короткое время в момент эякуляции и в этот момент защищены мощными антиоксидантными системами спермы [28, 31]. Некоторые работы указывают на то, что повышение концентрации лейкоцитов в генитальном тракте и сперме связано с бесплодием: снижением концентрации, доли подвижных и морфологически нормальных форм, повреждением ДНК [11–14]. Другие авторы утверждают, будто убедительных данных за то, что ХП служит причиной мужского бесплодия, пока нет [10, 25–27].
В настоящем исследовании воспалительный ХП был диагностирован у 18,9% мужчин из бесплодных пар, что в целом соответствует общемировым данным [9, 10], хотя в публикациях имеются весьма существенные различия: от 3 [25] до 72% [32] случаев, если брать за основу достаточно представительные (более 200 обследованных мужчин) выборки. По данным R. Henkel и соавт. [10, 33], полученным при обследовании более 4000 пациентов, наблюдавшихся по поводу бесплодия, в неселективной выборке инфекции полового тракта имели место в 10–20% случаев, в отдельных группах – до 35%.
В недавнем крупном исследовании, выполненном T. Domes и соавт. [14], более чем у 4900 пациентов с нарушением репродуктивной функции без азооспермии показано, что изолированное повышение содержания лейкоцитов спермы связано со значимым снижением концентрации сперматозоидов, ухудшением их подвижности, морфологии, индекса фрагментации ДНК. Однако данное исследование было ограничено использованием модифицированного определения повышения лейкоцитов спермы (≥1 ПМЛ/100 сперматозоидов) и не было использовано стандартное определение ВОЗ (>1∙106 лейкоцитов/мл). Ухудшение качества спермы, пропорциональное степени лейкоцитоспермии, даже в отсутствие диагностированной микрофлоры (ХП категории III) демонстрировали и некоторые другие авторы [34, 35].
Наши данные не подтверждают определяющую роль концентрации спермальных лейкоцитов в развитии бесплодия: уровень лейкоцитов у пациентов с ХП был повышен по сравнению со здоровыми мужчинами, но статистически не различался в группах ФХП и БХП. Корреляционный анализ также не выявил значимых взаимосвязей между отдельными клиническими проявлениями ХП и наличием бесплодия. Это согласуется с результатами недавно опубликованных исследований [36]. По нашим данным, различия между бесплодными и фертильными мужчинами с ХП касаются других факторов: длительности анамнеза ХП, частоты рецидивов, особенностей УЗИ-структуры и дренажной функции простатовезикулярного комплекса, характера диагностированной микрофлоры, антиинфекционной способности семенной плазмы.
Присутствие в сперме определенной бактериальной флоры, по некоторым данным, является независимым фактором ухудшения качества спермы [37]. Имеются сведения, согласно которым бактерии могут повреждать сперматозоиды независимо от контаминации лейкоцитами, так как липополисахариды (ЛПС) стенки бактериальных клеток могут непосредственно вызывать апоптоз сперматозоидов человека [38] посредством Toll-like-рецепторов 2 и 4, влияя как на целостность плазматической мембраны сперматозоидов, так и на функционирование митохондрий сперматозоидов [39, 40]. Кроме того, сопутствующее присутствие бактерий может усиливать повреждающий эффект лейкоцитов за счет усиления образования АФК [41]. При ХП были изучены различные возбудители, но большинство исследований проводилось в отношении E. coli. Было показано, что указанный микроорганизм нарушает подвижность сперматозоидов и их жизнеспособность как непосредственно, так и через факторы растворения [22, 24]. Исследование спермы, инфицированной E. coli, с помощью электронного микроскопа обнаружило сперматозоиды со структурными повреждениями в области средней части и хвоста, отвечающих за подвижность сперматозоидов [22]. Выявлено также вызванное E. coli повреждение акросомы, что потенциально может нарушать ее функцию и снижать общую фертильность. Недавно M. Fraczek и соавт. [40] обнаружили изменения в митохондриях и деформацию мембран сперматозоидов при непосредственном контакте сперматозоидов и E. coli, что приводило к снижению жизнеспособности сперматозоидов и потенциала фертильности. По нашим данным, у пациентов с воспалительным ХП доля случаев такой бактериальной флоры, включая смешанные формы, составляет 54%. Причем в группе БХП количество эякулятов с диагностически значимой бактериоспермией достигло 88%, несколько реже это наблюдалось у ФХП – 77%, но в обоих случаях существенно чаще, чем у здоровых мужчин.
Ch. trachomatis, которая, по нашим данным, служит вероятной причиной ХВП в 9% случаев, также может существенно ухудшать качество спермы. Принято считать, что у мужчин Ch. trachomatis отвечает за развитие уретрита, эпидидимита, эпидидимоорхита, но в последнее время все чаще признается ее роль как возбудителя простатита [42–44]. Недиагностированная хламидийная инфекция может оказаться этиологическим фактором «небактериального» ХП и даже ХНП/СХТБ – одна гипотеза теоретически допускает микробную этиологию, связанную со скрытым не выявленным микробным возбудителем [46]. Это позволяет предположить, что такие пациенты должны быть классифицированы как в действительности страдающие бактериальным простатитом [43, 45, 46]. Распространенность хламидийной инфекции среди пациентов с ХНП/СХТБ находилась в диапазоне от 8,3 до 27,0% [42, 43, 47]. Пока последствия хламидийной инфекции для мужской фертильности по-прежнему находятся в стадии обсуждения. В одних работах показано, что Ch. trachomatis непосредственно связана с уменьшением объема спермы, подвижности сперматозоидов, аномальной концентрацией и морфологией сперматозоидов, нарушением оплодотворяющей способности и целостности ДНК [15, 38, 42, 48, 49]. В других сообщениях говорится об отсутствии ее влияния на мужскую фертильность [45, 50–53]. Гибель сперматозоидов in vitro, вызванная Ch. trachomatis, хорошо описана и вызывается ЛПС, которые в 5000 раз более активны, чем изолированные ЛПС E. coli [38, 54]. Таким образом, хроническая хламидийная инфекция, сопровождающаяся секрецией небольших количеств ЛПС, может оказывать значительное влияние на сперматозоиды и вызывать нарушение репродуктивной функции у мужчин.
Другие возбудители, включая мико- и уреаплазму, могут играть роль в возникновении ХП и мужского бесплодия [9, 37]. По нашим данным, они изолированно служат причиной ХП в 2 и 10% случаев соответственно, в виде смешанных инфекций – до 15%. О патогенетической роли этих инфекций в развитии ХП, в частности, сообщают A. Radonic и соавт. [55]: при обследовании 3029 мужчин с воспалительным ХП и ХНП/СХТБ U. urealyticum была диагностирована в 8% наблюдений, M. hominis – в 1%. Требуются дальнейшие исследования, направленные на определение клинической значимости данных инфекционных агентов и возможного участия их в формировании мужского бесплодия.
Независимыми факторами риска развития бесплодия оказались длительность заболевания (больше двух лет – ОШ=2,72; больше 5 лет – ОШ=4,02), а также частота рецидивов (при частоте обострения ХП чаще 2 раз в год ОШ=2,6); оба показателя были достоверно связаны с ПВБ. Следствием более длительно протекающего и сопровождающегося более частыми рецидивами ХВП оказались фиброз и образование конкрементов в простате, обнаруженные нами при ТрУЗИ у бесплодных пациентов. Аналогичные особенности ультразвуковой картины простаты и везикул у бесплодных мужчин с ХП отмечают и другие исследователи [36]. На фоне типичных для этого заболевания особенностей эхоструктуры простаты у БХП простатолитиаз выявлялся в 30% наблюдений при 16% у ФХП и 0% у здоровых. Известно, что конкременты, образующиеся в простатических ацинусах при длительном воспалении, могут стать очагом длительной персистенции патогенных микроорганизмов благодаря наличию экстрацеллюлярных полисахаридных оболочек и посредством образования так называемой микробной биопленки [56]. Возможно, что именно наличие простатических камней служит причиной повышения частоты обострения простатита у БХП, также отнесенной нами к факторам риска бесплодия при ХП. Показана положительная взаимосвязь наличия простатолитов с фактом констатации бесплодного брака, продолжительностью ХП и частотой обострений заболевания. Имеется положительная корреляция факта простатолитиаза и недостаточности опорожнения семенных пузырьков. Ранее было показано, что вязкость семенной жидкости у пациентов с инфекцией вспомогательных мужских желез, страдающих бесплодием, может повышаться [57]. В свою очередь повышение вязкости семенной жидкости может неблагоприятно сказываться на характеристиках спермы, особенно на подвижности сперматозоидов [58]. Нормальная работа данных желез необходима для разжижения спермы, сохранения подвижности сперматозоидов и подавления антиспермального иммунного ответа в женском репродуктивном тракте [59, 60]. Установление факта нарушения дренажной функции семенных пузырьков считаем важным. Это согласуется с описанным ранее уменьшением объема спермы и продукции биохимических маркеров простаты и семенных пузырьков [7, 16, 17, 57]. По нашим данным, нарушение опорожнения семенных пузырьков было характерным для всех больных ХП, но наиболее выраженные нарушения отмечены в группе БХП: 91% при 12% у здоровых мужчин и 67% у ФХП. В основе снижения фертильности при этом, вероятно, лежит застой секрета и как следствие – задержка сперматозоидов в везикулах, что может приводить к их старению и апоптозу [61].
Из наших данных следует, что важнейшим фактором риска развития бесплодия при ХП является снижение бактерицидных свойств семенной плазмы (для E. coli ОШ=9,9; для Ps. aeruginosa ОШ=6,0). По сравнению с группой ФХП у БХП практически отсутствовала способность семенной плазмы к подавлению роста патогенных бактерий. Приближение показателя ПАИР к 100% свидетельствовало о практически полной потере эякулятом своих естественных антибактериальных свойств, а превышение 100%-ного рубежа говорило о том, что эякулят становился дополнительным питательным субстратом и даже стимулировал размножение патогенов. Нарушение местной антиинфекционной защиты следует также признать фактором риска снижения фертильности при ХП.
Заключение. Воспалительный процесс у мужчин со сниженной фертильностью в 54% случаев ассоциирован с аэробной бактериальной инфекцией, в 9% – с хламидийной, в 12% – с уреа- и микоплазменной. Для бесплодных характерно увеличение частоты встречаемости E. coli и появление бактериальных ассоциаций на фоне снижения антибактериальной резистентности спермальной плазмы. К факторам риска снижения фертильности при ХВП относятся продолжительность анамнеза и частота обострений, наличие простатолитов, функциональная обструкция простатовизикулярного комплекса. Необходимы дальнейшие исследования для понимания патогенеза простатита и объяснения негативного его влияния на мужскую фертильность, совершенствования диагностических критериев и изучения эффективности различных методов лечения.



