Введение. Возрастной андрогенный дефицит является проявлением общего процесса старения организма мужчины. Этот период у мужчин является закономерным этапом онтогенеза, но не всегда протекает физиологично [1, 2].
Снижение продукции общего тестостерона у мужчин после 40 лет происходит в среднем на 0,4–2,8% в год. В большей степени наблюдается снижение уровня свободного тестостерона на 1,2–2,5% в год. В возрасте 80 лет средний уровень общего тестостерона уменьшается на 40% от соответствующего показателя в 25 лет, а свободного – на 60% [3].
Некоторые авторы считают, что этиопатогенез возрастного андрогенного дефицита и доброкачественной гиперплазии предстательной железы во многом одинаков, так как эти состояния широко распространены среди мужчин старшего и пожилого возраста [4, 5].
В настоящее время эффективность в качестве средства заместительной гормональной терапии (ЗГТ), при подтвержденном гипогонадизме, доказана лишь для тестостерона [6–9].
Цель ЗГТ состоит в улучшении физического состояния, повышения либидо, общей сексуальной удовлетворенности, уменьшения выраженности или исчезновения вегетососудистых и психических расстройств, в увеличении мышечной силы и качества жизни, что в свою очередь способствует сокращению заболеваемости и смертности [10–12].
Абсолютными противопоказаниями для лечения препаратами тестостерона являются рак предстательной железы и рак молочной железы у мужчин. Ряд авторов выделяют дополнительные противопоказания – выраженная обструкция нижних мочевых путей, пролактинома и полицитемия. К относительным противопоказаниям относят апноэ, обструктивные заболевания легких и гематокрит 52% [13–16].
Не нашел однозначного решения вопрос: могут ли андрогены ускорить прогрессирование доброкачественной гиперплазии предстательной железы (ДГПЖ) [17]?
Поскольку единого мнения о патогенезе ДГПЖ до сих пор нет, то и ранее бытовавшее утверждение о негативном влиянии тестостерона на предстательную железу в настоящее время подвергается большому сомнению. Целью настоящего исследования стало изучение влияния ЗГТ на течение ДГПЖ.
Материал и методы. В соответствии с целью данного исследования была сформирована группа из 44 пациентов в возрасте от 61 года до 65 лет с сочетанием ДГПЖ и возрастного андрогенного дефицита, сопоставимых по возрасту, характеру течения ДГПЖ и общему соматическому состоянию. Лечение пациентов было направлено в первую очередь на устранение ирритативной и обструктивной симптоматики. Симптоматическое лечение проводили препаратами группы α-адреноблокаторов. Мы отдавали предпочтение тамсулозину в дозе 0,4 мкг 1 раз утром, учитывая удобство его применения, отсутствие необходимости титрования дозы и его хорошую переносимость.
Все пациенты были разделены на две группы по 22 человека. Основную группу составили пациенты, которым дополнительно назначали ЗГТ. Обязательным условием включения пациентов в основную подгруппу было добровольное информированное согласие пациента на участие в исследовании. В контрольной группе ЗГТ не проводилась.
Гормональную заместительную терапию пациентам основной группы назначали после тщательного обследования и исключения рака предстательной железы, рака грудной железы и заболеваний печени.
Для коррекции уровня общего тестостерона крови использовали современный лекарственный препарат тестостерона Небидо (тестостерона ундеканоат), который вводили внутримышечно 1 раз в 8 нед. Продолжительность исследования составила 9 мес.
Сравнение проводили по следующим показателям: объем предстательной железы, размер аденоматозных узлов, объем остаточной мочи; уровни простатспецифического антигена (ПСА) и половых гормонов. Половые гормоны и ПСА в основной группе определяли на сроках 3, 6 и 9 мес, а в контрольной группе – только на сроке 9 мес и сравнивали с исходными показателями, полученными до начала исследования.
Кроме этого выявляли побочные эффекты у пациентов, принимавших ЗГТ.
Результаты. Все пациенты основной группы хорошо перенесли назначенное гормональное лечение. Среди нежелательных и побочных эффектов 3 (13,6%) пациента отметили перебои в работе сердца, 2 (9%) – усиленный рост волос на лице, 3 (13,6%) – болезненность в месте инъекции.
При контроле биохимических показателей крови патологических изменений не отмечено ни в одной из подгрупп больных.
Уровень ПСА в основной группе исходно составил 1,9±1,0 нг/мл, через 3 мес ГЗТ – 1,5±0,8 нг/мл, через 6 мес – 1,2±0,5 нг/мл, через 9 мес – 1,3±0,4 нг/мл.
В контрольной группе содержание данного маркера в течение всего периода наблюдения практически не изменилось, исходно составив 1,2±0,7 нг/мл, а через 9 мес – 1,5±0,6 нг/мл.
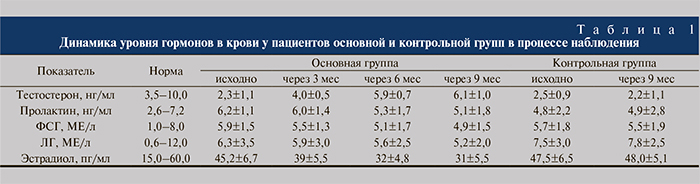
Исследование показателей гормонального статуса выявило положительную динамику в основной группе и отсутствие значимых изменений – в контрольной (табл. 1).
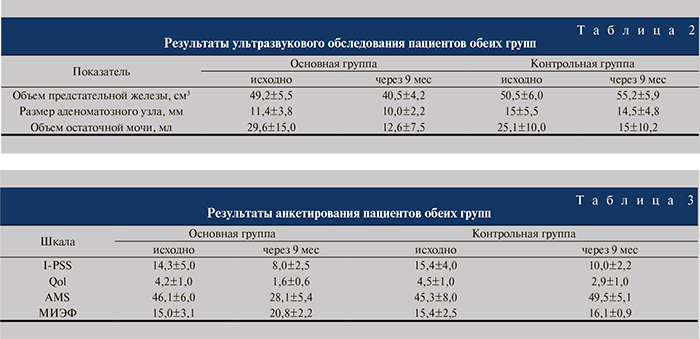
Как видно из табл. 2, в основной группе имело место улучшение клинической картины ДГПЖ по всем показателям, тогда как в контрольной группе отмечено увеличение объема предстательной железы, что можно расценивать как отрицательную динамику.
Результаты анкетирования пациентов показали (табл. 3), что качество жизни пациентов основной группы улучшилось, при том что в контрольной группе осталось неизменным или ухудшилось.
Заключение. Использование тестостерона в комплексе с α-адреноблокаторами у пациентов с ДГПЖ приводит к уменьшению объема предстательной железы на 17,7%, уменьшению размера аденоматозных узлов на 12,3%, уменьшению объема остаточной мочи на 57,4%, снижению выраженности симптомов ДГПЖ на 44,1% по шкале I-PSS, снижению выраженности клинических проявлений по шкале AMS на 39% и повышению индекса качества жизни по шкале QoL в 2 раза по сравнению с исходными данными. В контрольной группе гормональный профиль, клиническая картина и субъективное самочувствие пациентов остались практически неизменными.
Таким образом, больным ДГПЖ в сочетании с возрастным андрогенным дефицитом может назначаться терапия препаратами тестостерона. Несомненно, применение ЗГТ должно проводиться у пациентов только после исключения онкопроцессов и с учетом отсутствия иных заболеваний, при которых назначение препаратов тестостерона противопоказано.



