Введение. Локально развивающееся хроническое инфекционное воспаление в предстательной железе по влиянию на качество жизни сопоставимо с инфарктом миокарда, стенокардией, болезнью Крона, что обусловливает значительные психологические и социальные проблемы у мужчин репродуктивного и трудоспособного возраста [1].
В соответствии с классификацией, разработанной Национальным институтом здоровья США (NIH) [2], в отдельную категорию II выделен хронический бактериальный (инфекционный) простатит. Центральное место в его лечении занимает антибактериальная терапия, к сожалению, часто малоэффективная. Препаратами выбора служат фторхинолоны, современные макролиды и тетрациклины [3–7]. Эффективность антибактериальной терапии зависит от ее длительности, которая составляет 6–12 нед [4, 8], а по рекомендациям Европейской ассоциации урологов должна проводиться не менее 6–8 нед.
Хронический простатит течет годами, часто обостряется, каждый рецидив требует нового курса лечения.
Среди причин низкой эффективности лекарственной терапии хронического инфекционного простатита выделяют дисфункцию иммунной системы.
В качестве одного из механизмов поддержания хронического воспалительного процесса в предстательной железе рассматривают развитие локальной провоспалительной гиперцитокинемии, формирующейся при активации транскрипционного фактора NF-кB [9–11]. Длительно персистирующее воспаление способствует развитию отека предстательной железы и может приводить к нарушению ее функции.
Следующей важнейшей проблемой лечения инфекционного простатита являются побочные эффекты и осложнения антимикробной терапии. Так, антибиотики нарушают нормальную микрофлору толстого кишечника, способствуя развитию дисбактериоза (дисбиоза), частым проявлением которого является диарея. Это побудило ввести в Международную классификацию болезней термин «антибиотикассоциированная диарея», или «антибиотикассоциированный дисбиоз» [12]. Общеизвестно, что нормальная микрофлора кишечника, масса которой в организме здорового человека составляет более 3,5 кг, играет важную роль в пищеварении, обезвреживании токсинов, синтезе витаминов, формировании иммунологической толерантности, выработке неспецифических факторов защиты и в поддержке реакций клеточного иммунитета [13].
В связи с вышеперечисленными факторами актуально использование продуктов, модулирующих активность транскрипционного фактора NF-κB, а также препятствующих развитию дисбиоза кишечника в ходе комбинированного лечения хронического простатита. Данному требованию отвечают натуральные продукты функционального питания, содержащие ферментированные пищевые волокна (ФПВ), а также продукты их ферментации нормофлорой – короткоцепочечные жирные кислоты (КЦЖК) (БАД рекицен-РД® производства ООО «Ягодное Плюс», Киров).

Цель работы: оценить эффективность и безопасность комплексной терапии хронического инфекционного простатита, включающей антибактериальные средства и натуральный комплекс ферментированных пищевых волокон и короткоцепочечных жирных кислот.
Материал и методы. В урологической клинике ПГМА им. ак. Е. А. Вагнера и прикрепленных поликлиниках в 2010–2014 гг. проведено проспективное открытое сравнительное рандомизированное исследование. В исследование были включены 64 пациента в возрасте от 20 до 66 лет (средний возраст – 39,8±5,0 лет) с диагностированным хроническим инфекционным простатитом категории II в соответствии с классификацией NIH. Длительность заболевания варьировалась от 6 мес до 18 лет (в среднем 4,5±2,2 года).
Методом случайных чисел пациенты были рандомизированы на основную и контрольную группы по 32 человека. Группы были однородными по всем основным показателям (возраст, длительность заболевания, микробное число и др.).
Большинство пациентов находились на амбулаторном лечении. Все они дали письменное информированное согласие на участие в исследовании. Больным назначали антибактериальную терапию согласно рекомендациям Европейской ассоциации урологов непрерывно в течение 8 нед с учетом чувствительности обнаруженного возбудителя к антибиотикам и с чередованием препаратов. Использовали препараты групп фторхинолонов (левофлоксацин), тетрациклинов (доксициклин) и макролидов (вильпрафен).
 Больные контрольной группы получали только антибактериальную терапию. Пациенты основной группы в дополнение к антибактериальной терапии в течение 8 нед получали натуральный комплекс ФПВ и КЦЖК по 1–2 столовые ложки (до 10 г) 3 раза в сутки во время еды.
Больные контрольной группы получали только антибактериальную терапию. Пациенты основной группы в дополнение к антибактериальной терапии в течение 8 нед получали натуральный комплекс ФПВ и КЦЖК по 1–2 столовые ложки (до 10 г) 3 раза в сутки во время еды.
Использовали нижеследующий комплекс методов исследования. Сбор анамнеза, включающий анкетирование с применением шкалы симптомов хронического простатита Национального института здоровья США (NIH–CPSI), объединяющей вопросы по двум ведущим группам симптомов – боль и дизурия, которое позволяло оценивать качество жизни пациента. Далее проводили ректальное пальцевое исследование предстательной железы.
Выполняли УЗИ почек и мочевого пузыря, а также исследование предстательной железы трансректальным датчиком (ТРУЗИ). Бактериологическое исследование проведено по методу Gould. Материал собирали по методике Meares–Stamey [14]. Микроскопию секрета предстательной железы и 3-й (постмассажной) порции мочи осуществляли при увеличении в 400 раз. Обнаружение микроорганизмов в титре свыше 103 КОЕ/мл доказывало наличие хронического бактериального простатита. Методом полимеразной цепной реакции (ПЦР) в секрете предстательной железы и 3-й порции мочи определяли хламидии, микоплазмы, уреаплазмы, гонококки, гарднереллы.
Простатический специфический антиген (ПСА) в крови определяли радиоиммунным методом. У всех больных проводили клинические и биохимические исследования крови и мочи, по показаниям, преимущественно с целью дифференциальной диагностики, выполняли обзорную и экскреторную урографию, цистоуретрографию, урофлоуметрию и другие необходимые методы. Все исследования проведены в динамике.
Критерии включения в исследование: больные с установленным диагнозом хронического инфекционного простатита с давностью заболевания не менее 6 мес; наличие микроорганизмов в секрете предстательной железы или в 3-й порции мочи в концентрации 103 и более КОЕ/мл; выделение методом ПЦР в секрете предстательной железы или 3-й порции мочи хламидий, микоплазм, уреаплазм, гонококков, гарднерелл (в отсутствие их в мазке из уретры); количество лейкоцитов 10 и более в поле зрения (при 400-кратном увеличении) при микроскопии секрета предстательной железы или 3-й порции мочи.
Критерии исключения: наличие других заболеваний мочеполовой системы (мочекаменная болезнь, цистит и др.), которые могли быть причиной болевого синдрома и симптомов воспаления, характерных для хронического простатита; наличие камней в предстательной железе; повышение уровня ПСА свыше 4 нг/мл; острый простатит; больные, нуждавшиеся в оперативном лечении; больные хроническим простатитом, нуждавшиеся в расширенной комплексной терапии заболевания (физиотерапия, массаж простаты и т.д.); прием других препаратов для лечения основного и сопутствующих заболеваний.
С целью обеспечения объективности исследования из лечения на период всего исследования с согласия больного были исключены современные средства патогенетического лечения (α-адреноблокаторы, витапрост и др.).
С 3-го по 6-й месяц больные обеих групп не получали лечения, за ними проводили только динамическое наблюдение. Оценку результатов осуществляли через 8 нед (т.е. сразу после окончания антибактериальной терапии) и через 6 мес (после 4-месячного перерыва в лечении).
Достоверность различий в группах вычисляли с использованием парного t-теста Стьюдента и теста Вилкоксона.
Результаты. Об изменении состояния больных судили по результатам анкетирования по шкале NIH–CPSI. В обеих группах через 8 нед антибактериальной терапии снизилась выраженность боли: в основной группе – с 13,0±1,8 до 6,3±1,6 балла (p<0,01), в контрольной – с 12,9±1,9 до 6,6±1,6 балла (p<0,01), разницы между группами не выявлено (p>0,05). Через 4 мес после прекращения лечения в контрольной группе стала нарастать боль, выраженность которой составила 10,6±1,1 балла.
В основной группе возобновившиеся боли были менее интенсивными (7,5±1,1 балла, p<0,05).
Динамика расстройств мочеиспускания была следующей. В основной группе показатель дизурии по шкале NIH–CPSI исходно составил 3,9±1,5 балла, через 8 нед – 2,0±1,3, через 6 мес – 2,8±1,4, в контрольной группе – 4,0±1,6, 2,6±1,4 и 3,5±1,5 балла соответственно. В динамике и при сравнении двух групп статистически значимой разницы не обнаружено (p>0,05).
Вопросы 7–9 анкеты NIH–CPSI отражают оценку пациентом своего качества жизни. Исходно в обеих группах качество жизни обследуемых было низким и соответствовало 9,8±2,0 и 9,5±1,7 балла в основной и в контрольной группах соответственно. После антибактериального лечения качество жизни улучшилось в обеих группах, но более заметно – в основной группе, составив 4,5±1,3 против 6,0±1,2 балла в контрольной группе. Через 6 мес оценка пациентами своего качества жизни оставалась достаточно высокой, составив 5,3±1,2 балла, в то время как в контрольной группе пациенты отмечали ухудшение качества жизни – 8,7±1,2 балла (p<0,05).
В обеих группах 8-недельный курс лечения способствовал уменьшению выраженности симптомов хронического простатита (рис. 1). Динамика в основной группе оказалась более показательной, хотя статистически значимой разницы в параметрах не было (p>0,05). В контрольной группе через 4 мес после окончания лечения симптомы хронического простатита возвратились, а число баллов почти достигло первоначального уровня, в основной же группе выраженность этого показателя изменилась незначительно. Разница между показателями на данном сроке исследования статистически значима (p<0,05).
Важнейшим показателем интенсивности воспалительного процесса и лабораторным критерием оценки эффективности проводимой терапии служит число лейкоцитов в секрете предстательной железы. В обеих группах на фоне 8-недельной антибактериальной терапии было достигнуто значительное снижение выраженности воспалительного процесса (рис. 2). Число лейкоцитов в поле зрения снизилось до 8,9±2,5 и 8,8±2,4 (при норме до 10 лейкоцитов в поле зрения) в основной и контрольной группах соответственно. После окончания лечения в течение последующего срока наблюдения в основной группе число лейкоцитов практически не изменялось, составив 12,9±2,5 (p>0,05 по сравнению с показателем сразу после отмены антибиотиков). В контрольной группе число лейкоцитов после отмены антибиотиков вновь стало нарастать, составив 22,5±3,1 в поле зрения. Сравнение лейкоцитарной реакции секрета, зафиксированной через 6 мес от начала исследования, показало, что число лейкоцитов в основной группе оказалось статистически значимо (p<0,05) меньше, чем в контрольной.
В начале исследования в секрете предстательной железы и/или 3-й (постмассажной) порции мочи у всех 64 больных выявлены микроорганизмы. Преобладали различные штаммы стафилококка и кишечная палочка, реже встречались хламидии, гемолитический стрептококк и прочие микроорганизмы. У 18,8% обнаружены микробные ассоциации. В основной группе после окончания 8-недельной терапии эрадикация возбудителя констатирована у 28 (87,5%) больных, персистенция – у 3 (9,4%), суперинфекция с выделением нового микроорганизма – у 1 (3,1%). В контрольной группе через 8 нед лечения эрадикация возбудителя наступила у аналогичного числа больных – 28 (87,5%), перси-стенция отмечена у 4 (12,5%) пациентов.
Через 6 мес от начала исследования в основной группе эрадикация отмечена у 26 (81,25%), персистенция – у 4 (12,5%), суперинфекция – у 2 (6,25%) пациентов, в контрольной – у 19 (59,4%), 7 (21,9%) и 6 (18,7%) соответственно.
Таким образом, после 8-недельной антибактериальной терапии эрадикацию возбудителя фиксировали у одинаково высокого числа пациентов обеих групп (p>0,05). После 4-месячного перерыва в лечении в основной группе сохранялся высокий (81,25±6,9%) показатель эрадикации, а в группе сравнения уровень эрадикации снизился до 59,4±8,6%, что статистически значимо ниже, чем в основной группе (p<0,05). Причем в секрете предстательной железы вновь выявлен прежний возбудитель или высевался новый микроорганизм.
Приведенные материалы свидетельствуют: добавление к стандартному антибактериальному лечению пациентов с хроническим простатитом натурального комплекса ФПВ и КЦЖК позволяет добиваться более стойкого и длительного бактериологического эффекта.
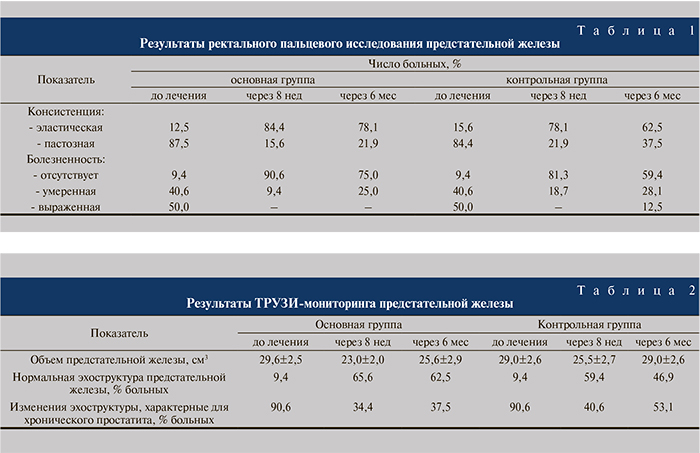
Объективным показателем выраженности воспалительного процесса в предстательной железе являются данные пальцевого ректального исследования (табл. 1). В обеих группах терапия приводила к купированию боли и исчезновению пастозности предстательной железы у большинства пациентов, что обусловлено ликвидацией или уменьшением воспалительного процесса и отека в ткани железы. Через 4 мес после окончания антибактериального лечения в контрольной группе по сравнению с основной статистически значимо (p<0,05) увеличилось число больных с пастозной железой, испытывающих боль при ее пальпации. Таким образом, в контрольной группе быстрее и чаще наступал рецидив воспалительного процесса в железе.
Аналогичные данные получены при УЗИ (табл. 2).
На фоне лечения у пациентов основной группы отмечено достоверное снижение (на 6,6 см3) объема предстательной железы (p<0,05). Через 6 мес объем предстательной железы у пациентов данной группы оставался ниже исходного уровня. В контрольной группе спустя 8 нед лечения не отмечено статистически значимого уменьшения объема предстательной железы (p>0,05). До лечения у пациентов обеих групп выявлялись изменения, характерные для хронического простатита. Чаще всего это были участки чередования мелких зон повышенной эхогенности (участки фиброза, клеточной инфильтрации) и пониженной плотности (зоны воспалительного отека, инфильтрации, ретенционных кист, псевдомикроабсцессов).
Через 8 нед терапии отмечены уменьшение размеров гипоэхогенных участков, исчезновение последних, инволюция воспалительной инфильтрации, дренирование ретенционных кист и псевдомикроабсцессов. Это свидетельствовало о купировании острых воспалительных явлений в предстательной железе. В основной группе эти процессы шли более интенсивно и были констатированы для большего числа больных: так, у 65,6% через 8 нед и у 62,5% через 6 мес при ТРУЗИ эхоструктура предстательной железы была без патологических изменений. У пациентов контрольной группы отмена антибактериальных препаратов значительно чаще сопровождалась рецидивом изменений воспалительного характера в структуре железы.
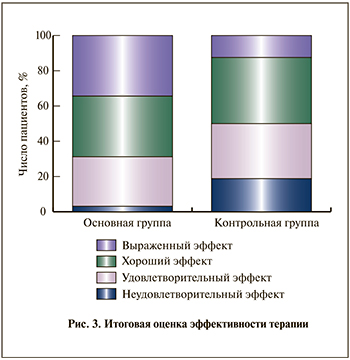
Общая эффективность терапии определена на основании суммирования оценок клинической, лабораторной и бактериологической эффективности по окончании 6 мес исследования (рис. 3). В основной группе выраженный эффект наблюдали у 11 (34,4%) больных, хороший – у 11 (34,4%), удовлетворительный – у 9 (28,1%), неудовлетворительный – лишь у 1 (3,1%). Таким образом, у 96,9% больных основной группы достигнуты положительные результаты лечения. В контрольной группе выраженный эффект наблюдали только у 4 (12,5%) больных, хороший – у 12 (37,5%), удовлетворительный – у 10 (31,2%), неудовлетворительный – у 6 (18,8%). В целом положительные результаты лечения хронического бактериального простатита при стандартной 8-недельной антибактериальной терапии достигнуты у 26 (81,2%) больных.
Побочные эффекты антибактериальной терапии в контрольной группе регистрировали значительно чаще, чем в основной. У 9 больных были зафиксированы тошнота, рвота, выраженная анорексия, боли в животе, метеоризм, диарея, дисбактериоз. Псевдомембранозный колит диагностирован у 1 больного, антибиотикассоциированная диарея – у 3, дисбактериоз с развитием кандидоза – у 3. Последние 7 больных были выделены нами в отдельную группу с антибиотикассоциированным дисбиозом, частота которого составила 21,9%. В основной группе побочные эффекты были выявлены у 2 (6,3%) пациентов и проявлялись в виде аллергического дерматита и крапивницы. Со стороны желудочно-кишечного тракта в основной группе побочных эффектов выявлено не было.
Обсуждение. Позитивные эффекты натурального комплекса ФПВ и КЦЖК в комплексной терапии хронического простатита, вероятно, обусловлены его противовоспалительным, иммуномодулирующим, пребиотическим и детоксикационным действиями. Так, в проведенных нами ранее исследованиях пациентов с воспалительной патологией различной локализации было установлено, что применение натурального комплекса ФПВ и КЦЖК приводило к нормализации показателей иммунограммы, отражавших состояние врожденного иммунитета, а также уровня провоспалительного цитокина IL-1β. Важно отметить, что концентрация противовоспалительного цитокина IL-4 оставалась неизменной [15]. У пациентов с язвенным колитом масляная кислота, являющаяся КЦЖК, ингибировала чрезмерно активированный NF-kB в эпителиальных клетках толстого кишечника. NF-kB – транскрипционный фактор, который контролирует экспрессию генов, кодирующих выработку провоспалительных цитокинов, хемокинов, провоспалительных энзимов, некоторых белков острой фазы [16–19].
Полученные ранее данные, а также результаты настоящего исследования подчеркивают целесообразность дальнейшего изучения иммуномодулирующих эффектов БАДа рекицен-РД® у пациентов с урологической патологией.
Как известно, такие компоненты БАДа рекицен-РД®, как пищевые волокна и КЦЖК, обладают пребиотическим свойством и способствуют восстановлению нормофлоры, а также выработке и утилизации КЦЖК при дисбиозах [17, 20]. Последнее оптимизирует процессы апопотоза эпителия толстого кишечника, что препятствует развитию бактериальной транслокации и эндотоксинемии [20]. Показано, что кормление старых крыс с наличием гипотрофии печеночной ткани натуральным комплексом ФПВ и КЦЖК способствовало активации регенераторного потенциала гепатоцитов [21]. В исследовании, проведенном Пермским краевым научно-исследовательским клиническим институтом детской экопатологии, было установлено, что добавление БАДа рекицен-РД® в диету детей из экологически неблагоприятных районов снижало у них содержание ароматических углеводородов и токсических металлов [22], что указывает на детоксицирующее действие натурального комплекса ФПВ и КЦЖК.
Заключение. Компоненты БАДа рекицен-РД®, такие как ферментированные ПВ и КЦЖК, обладают иммуномодулирующим, противовоспалительным, пребиотическим, детоксикационным действиями. Вероятно, это и определило большую эффективность лекарственной терапии на фоне использования функционального питания, включающего БАД рекицен-РД®.



