Введение. Среди огромного числа врожденных заболеваний мочевой системы у детей особое место занимают обструктивные уропатии, распространенность которых в детской популяции, по данным разных авторов, варьируется от 1 до 6% [1].
До настоящего времени остаются дискутабельными вопросы патогенеза гидронефроза. По мнению одних авторов [2–7], обструкция лоханочно-мочеточникового сегмента (JIMC) и развитие гидронефроза могут быть обусловлены механическим препятствием в JIMC (сужение сегмента, добавочный сосуд, сегментарная нейромышечная дисплазия ЛMC, высокое отхождение мочеточника, клапан в области JIMC, периуретеральные эмбриональные спайки и др.), а по мнению других [8], формирование гидронефротической трансформации, вероятно, связано с первичной эвакуаторной несостоятельностью почечной лоханки в отсутствие структурных изменений прилоханочного отдела мочеточника.
Ранняя диагностика гидронефроза стала возможной в связи с широким внедрением антенатальной ультразвуковой диагностики. Пренатально дилатацию верхних мочевых путей регистрируют у 1–5% обследованных плодов [9, 10]. Ультразвуковое исследование, выполненное в постнатальном периоде, подтверждает гидронефроз в 60% случаев антенатально диагностированного заболевания [11, 12]. Следовательно, приблизительно 3 из 1000 новорожденных нуждаются в углубленном обследовании и пристальном наблюдении.
В 18–25% случаев гидронефроза нарушения уродинамики обусловлены вариантными почечными сосудами, которые перекрещиваются с мочевыми путями в пельвиоуретеральной области [13–15]. По данным зарубежных авторов [16], нижнеполярные добавочные сосуды как причину гидронефротической трансформации констатируют с частотой от 14 до 52%.

Клиническим проявлением обструкции мочевых путей являются, как правило, транзиторные боли в животе и инфекция мочевых путей с развитием хронического уретерита и пиелонефрита, приобретающая в условиях нарушенной уродинамики тяжелое течение.
Наиболее распространенными методами лечения гидронефроза до последнего времени остаются резекция ЛМС (операция Anderson–Hynes) при стенозе мочеточника и антевазальный пиелопиело- или уретеропиелоанастомоз при пересекающих сосудах. Однако все более широкое распространение стали получать малоинвазивные технологии, которые чаще используют в лечении взрослого контингента больных.
К эндохирургическим вмешательствам, направленным на восстановление проходимости зоны обструкции, относятся ретроградная баллонная дилатация, ретроградная дилатация рассекающим баллоном (Acusise эндопиелотомия) и эндопие-лотомия ретроградным или антеградным доступом.
Эндоскопические операции рассматривают как метод лечения первой линии, при этом четких показаний к выбору той или иной технологии нет. Эффективность эндоскопических вмешательств при гидронефрозе II стадии у детей колеблется от 32 [17] до 76% [18]. При этом эндотомия мочеточника и лоханки может сопровождаться серьезными осложнениями, в частности кровотечением, требующим переливания крови, эмболизацию почечной артерии или нефрэктомию [19, 20].
Во многих публикациях разные авторы [21] считают, что основной причиной нарушения уродинамики остаются структурные изменения ЛМС, а не сам добавочный сосуд. С другой стороны, имеются данные, указывающие на низкую результативность эндоскопических технологий при наличии пересекающего ЛМС сосуда [22].
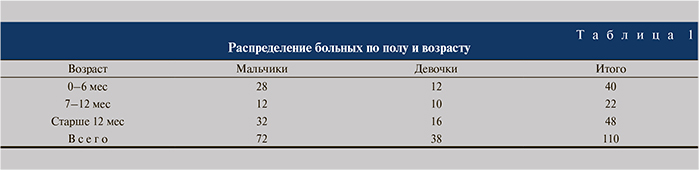
До настоящего времени продолжают обсуждаться различные способы пластических методик, что свидетельствует об отсутствии единого подхода к выбору метода оперативной коррекции гидронефроза. Многие исследователи отдают предпочтение резекции ЛМС с формированием анастомоза по Anderson–Hynes [23] в модификации Kucera [24] (или без). В ряде клиник используют методики операции с сохранением мочевой дорожки без резекции ЛМС и выполняют лоскутные пластики по Foley [25] или Culp-DeWeerd [26].
Процент неудовлетворительных результатов после хирургической коррекции пиелоуретеральной обструкции оставался весьма высоким довольно длительное время. Риск стенозирования вновь созданного соустья особенно велик у детей в воз-расте до года [27, 28]. С целью профилактики явлений анастомозита зарубежные и отечественные хирурги стали применять ультратонкий синтетический шовный материал 6/0–7/0 с прецизионной техникой наложения шва, используя для этих целей оптическое увеличение. Это позволило значительно улучшить результаты оперативного лечения гидронефроза [29].
В литературе имеются единичные публикации о морфологических исследованиях ЛМС при гидронефротической трансформации [30–32]. Проводимые различными авторами гистологические исследования удаленного ЛМС направлены на уточнение происходящих в нем патологических процессов [33].
При гидронефрозе в ЛМС в большинстве случаев наблюдаются закономерные патологические изменения в виде диффузного склероза стромы с распространением на все слои стенки и дезорганизация мышечного аппарата с выраженной гипоплазией и атрофией мышечных волокон. Изменения миоархитектоники характеризуются истончением мышечного слоя, разобщением мышечных пучков коллагеновыми волокнами, развитием межмышечного и концентрического фиброза, нарушением межмышечных контактов и как следствие – нарушением биомеханизма мышечного сокращения.
В литературных источниках предлагаются различные методики лечения гидронефроза у детей. Большинство этих методик не учитывают морфологические изменения в ЛМС. Обоснование выбора оперативного лечения, основанное на морфологических изменениях, послужило поводом выполнения данной работы.
Материалы и методы. В НИИ детской хирургии НЦЗД РАМН были обследованы 110 пациентов с односторонним гидронефрозом III стадии.
Как видно из табл. 1, гидронефроз у мальчиков встречался в 2 раза чаще, чем у девочек.
При поступлении всем детям с целью уточнения диагноза и определения тактики дальнейшего лечения проводилось обследование с использованием методов лучевой диагностики (рис. 1, 2).
После установления диагноза и предоперационной подготовки проведено оперативное лечение.
Всем больным проведена пиелопластика по методу Anderson–Hynes (рис. 3).
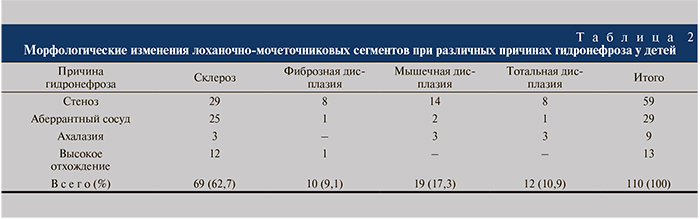
Причина гидронефроза определялась интраоперационно. В 29 случаях имел место аберрантный сосуд, в 59 – стеноз ЛМС, в 13 – высокое отхождение мочеточника и в 9 – его ахалазия.
Резецированные ЛМС подвергли морфологиче-скому исследованию. Окраску препаратов осуществляли по Ван–Гизону.
Результаты и обсуждение. Все выявленные морфологические изменения можно разделить на 4 группы: склероз, фиброзная дисплазия, мышечная дисплазия и тотальная дисплазия.
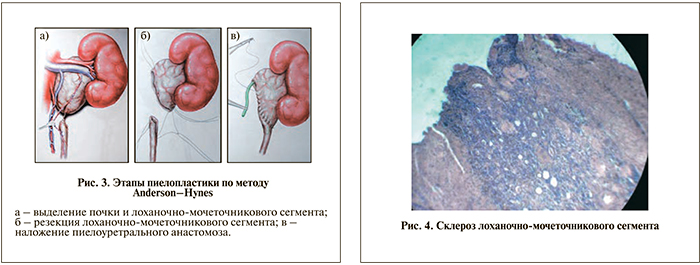
Склеротические явления в большинстве случаев сочетались с признаками хронического воспаления. На уровне лоханочно-мочеточникового сегмента определялся резко выраженный склероз стенки с обширными полями гиалинизированной рубцовой ткани, в которой имелись лишь единичные атрофированные мышечные фрагменты. Из-за выраженности вторичного склероза и атрофии мышечных волокон было невозможно судить о первоначальном состоянии стенки ЛМС (рис. 4).
Фиброзная дисплазия ЛМС проявлялась гиперплазией коллагеновых и эластических волокон.
В результате этого подслизистый слой мочеточника утолщался, оттесняя мышечный в сторону адвентиции, и как итог – приводил к сужению просвета пиелоуретерального сегмента.
При мышечной дисплазии имелось истончение стенки сегмента без явных признаков сужения его просвета. У одних больных выявлялась выраженная дезориентация мышечных пучков, у других отмечалась циркулярная аплазия на ограниченном участке, где подслизистый слой непосредственно подлежал к адвентиции. В некоторых случаях мышечной дисплазии на ограниченном участке ЛМС имелось резкое недоразвитие мышечных пучков, которые определялись как отдельные волокна, лежащие среди прослоек соединительной ткани. Выше зоны гипоплазии мышечные волокна были гипертрофированы.
В случаях тотального недоразвития всех слоев стенки (слизистой, мышечного слоя и адвентиция) имелось сужение наружного и внутреннего просвета мочеточника.
Как свидетельствуют приведенные в табл. 2 данные, при стенозе ЛМС в половине случаев имели место выраженные вторичные склеротические изменения, которые не позволяли оценивать исходное состояние всех слоев прилоханочного отдела мочеточника. У оставшихся 50,8% больных выявлены различные формы дисплазии.
При наличии дополнительного нижнеполярного сосуда также преобладал склероз стенки ЛМС. Различные формы дисплазии имели место только у 4 больных. Следовательно, в патогенезе развития гидронефротической трансформации на почве аберрантного сосуда ведущая роль принадлежит механическому воздействию сосуда на прилоханочный отдел мочеточника с последующим развитием склероза, что приводит к нарушению уродинамики.
Ахалазия ЛМС в 66,7% наблюдений морфологически характеризовалась его дисплазией. Обращает внимание, что ни в одном случае не выявлена фиброзная дисплазия. Мышечная и тотальная дисплазии встречались с одинаковой частотой (по 3 случая).
У 3 больных резко выраженный склероз не позволял провоить анализ слоев мочеточника, однако, судя по отсутствию анатомического сужения ЛМС, можно предположить, что и у этих больных изначально присутствовали диспластические проявления.
Только у 1 из 13 больных с высоким отхождением мочеточника имелась фиброзная дисплазия прилоханочного отдела мочеточника. В остальных случаях определялся выраженный склероз. Исходя из этого, можно утверждать, что высокое отхождение мочеточника служит не причиной гидронефроза, а его следствием. По мере увеличения внутрипочечного гидростатического давления лоханка расширяется во все стороны, оттесняя ЛМС вверх и медиальнее, что на операции расценивается как высокое отхождение мочеточника.
В целом склеротические изменения ЛМС у детей с гидронефрозом выявлены в 62,7% случаев. Различные формы дисплазии имели место у 37,3% больных, причем наиболее часто встречалась мышечная дисплазия (17,3%). Несколько реже наблюдались тотальная (10,9%) и фиброзная (9,1%) дисплазии.
Заключение. Исследования ЛМС показали, что его стеноз в 49,2% случаев обусловлен склеротическими изменениями и в 50,8% – различными видами дисплазии, среди которых преобладает мышечная (23,7%).
Аберрантный сосуд в 86,2% случаев вызывает склеротические изменения в месте перекреста с мочеточником, что в свою очередь приводит к нарушению уродинамики. Следовательно, резекция сосуда или антевазальное перемещение ЛМС без его резекции может несколько улучшить отток мочи из почки, но не восстановит уродинамику в полной мере.
Морфологическим субстратом ахалазии мочеточника у 66,7% больных является мышечная или тотальная дисплазия. Оценить исходное состояние 33,3% детей не представляется возможным из-за выраженного вторичного склероза. Поскольку фиброзная дисплазия при данной патологии не встречается, следовательно, у данных детей в первую очередь нарушен мышечный компонент транспорта мочи по ЛМС.
При высоком отхождении мочеточника у 92,3% детей отмечены склеротические изменения ЛМС, что свидетельствует о вторичном перемещении прилоханочного отдела мочеточника. Это значит, что не следует считать высокое отхождение мочеточника самостоятельной причиной гидронефроза.
Результаты проведенного морфологического исследования показали, что при гидронефрозе III стадии в ЛМС преобладают склеротические изменения на фоне различных форм дисплазии, что необходимо учитывать при выборе вида оперативного лечения. С целью адекватного восстановления уродинамики предпочтение, на наш взгляд, необходимо отдавать резекционным методикам.



