Введение. Среди аномалий мочевыделительной системы большое значение имеют различные варианты обструктивных уропатий – заболеваний, которые приводят к нарушению оттока мочи из верхних мочевых путей. а в дальнейшем – к снижению ренальных функций, развитию пиелонефрита и хронической почечной недостаточности, ранней инвалидизации и снижению качества жизни больного [1].
Наиболее часто встречающийся вид обструктивных уропатий у детей – пузырно-мочеточниковый рефлюкс (ПМР). Данное заболевание представляет собой ретроградный заброс мочи из мочевого пузыря в верхние мочевыводящие пути. Он встречается среди 60–75% больных с расстройствами мочеиспускания и рецидивирующей мочевой инфекцией [2, 3].
Возникнув в раннем возрасте, рефлюкс вызывает уродинамическую обструкцию верхних мочевых путей, что способствует присоединению вторичного пиелонефрита [4]. Рефлюкс-нефропатия, сохраняющаяся и после излечения ПМР, включает повреждение всех структурных компонентов нефрона и может служить причиной артериальной гипертензии, а также терминальной почечной недостаточности в детском возрасте.
В связи с этим своевременное выявление и определение оптимальной тактики лечения ПМР у конкретного больного становятся одной из актуальных проблем детской урологии.
В настоящее время не существует единого мнения об эффективности консервативного, эндоскопического и открытого оперативного способов лечения ПМР и показаниях к этим хирургическим процедурам.
При выборе способа коррекции ПМР руковод- ствуются данными о причинах его возникновения, выраженности рефлюкс-нефропатии, эффективности проведенной ранее консервативной терапии. Кроме того, тактика лечения зависит от возраста больного и результатов цистоскопии [5].
Применение консервативного метода лечения ПМР основывается на следующих положениях: первичный рефлюкс низких степеней с возрастом может самопроизвольно купироваться либо степень его может самопроизвольно снижаться. При этом K. Weingärtner и соавт. указывают на применимость выжидательной тактики только в случае низкой активности микробно-воспалительного процесса на фоне поддержки антибактериальными препаратами и в случаях отсутствия сопутствующих аномального строения устьев мочеточников (по типу «лунки для гольфа») и/или инфравезикальной обструкции [8]. Консервативная терапия рефлюкса исключает оперативную травму и тяжелый послеоперационный период, однако подразумевает длительную антибактериальную терапию с развитием антибиотикорезистентности и периодические дорогостоящие обследования пациентов для контроля течения патологического процесса. Согласно рекомендациям Немецкого общества урологов и Европейской ассоциации урологов, консервативному лечению подлежит первичный рефлюкс всех степеней у детей в возрасте до года и I–III степеней у детей до 5 лет.
Основным способом лечения рефлюкса считается оперативный, преимущество которого заключается в быстром прекращении ретроградного тока мочи [2, 6].
На сегодняшний день разработана масса различных способов хирургической коррекции ПМР. При этом ввиду внедрения высокотехнологичных методов лечения отмечается тенденция к минимизации травматичности антирефлюксных операций, уменьшению числа осложнений и рецидивов.
Задача подобных операций состоит в создании достаточно протяженного подслизистого отдела мочеточника. При этом моча, заполняющая мочевой пузырь, во время сокращения детрузора прижимает эластичную верхнюю стенку мочеточника к нижней, лежащей на довольно плотном мышечном слое мочевого пузыря, что обеспечивает клапанную антирефлюксную функцию [7].
Cуществует два основных пути «удлинить» подслизистый отдел мочеточника: эндоскопическая коррекция рефлюкса и открытые антирефлюксные операции [8].
Метод малоинвазивного лечения был впервые предложен в 1981 г. E. Matoushek и заключается в субуретеральном введении фиксирующих веществ при помощи эндоскопического оборудования.
Эндоскопическая коррекция ПМР имеет ряд преимуществ перед открытыми антирефлюксными операциями, главными из которых остаются низкая травматичность, отсутствие длительного послеоперационного периода и возможность проведения процедуры в амбулаторных условиях [8, 9].
Несмотря на перечисленные преимущества, применение коллагена и других фиксирующих веществ сопряжено с довольно высокой частотой неудач. Эффективность метода оценивается разными авторами в пределах от 67 до 80 %. Более низкая по сравнению с открытыми операциями эффективность метода в некоторых случаях приводит к необходимости повторения процедуры до трех раз. Кроме того, определенные ограничения в применении метода также обусловлены высокой стоимостью фиксирующих веществ [9].
К открытым антирефлюксным операциям прибегают в случае выявления при цистоскопии необратимых изменений устьев мочеточников или в случаях, когда аномальное анатомическое строение устьев не позволяет надеяться на положительный результат от эндоскопического введения фиксирующих веществ.
Несмотря на высокую эффективность открытых оперативных вмешательств, все они имеют существенные недостатки: высокую травматичность, необходимость в длительном комбинированном наркозе, дренировании верхних мочевыводящих путей в послеоперационном периоде и др. [7].
Следует отметить, что в современной урологической практике вопрос об оперативном лечении и выборе конкретной оперативной методики решается строго индивидуально, с учетом субъективной оценки специалистом стадии процесса и степени поражения паренхимы почек по результатам ультразвуковых и лучевых методов исследова- ния.
 Целью настоящего исследования было провести сравнительный ретроспективный анализ эффективности проведенных пациентам с ПМР эндоскопических операций в нашей клинике.
Целью настоящего исследования было провести сравнительный ретроспективный анализ эффективности проведенных пациентам с ПМР эндоскопических операций в нашей клинике.
Материалы и методы. С начала 2010-го по июнь 2014 г. в отделении репродуктивного здоровья НИИ детской хирургии наблюдались 202 пациента. Все дети были госпитализированы в клинику впервые. В ходе рентгенурологического обследования у всех детей был выявлен изолированный ПМР различной степени — от I до IV. Возраст детей варьировался от 3 мес до 14 лет.
При госпитализации всем детям проведено общеклиническое лабораторное обследование (общий анализ крови, общий анализ мочи, биохимический анализ крови), в ходе которого оценивали активность хронического микробно-воспалительного процесса в верхних мочевых путях и функциональное состояние почек. Детей с явлениями хронической болезни почек в исследование не включали.
Бактериологическое исследование мочи осуществлено в лаборатории микробиологии НЦЗД. Антибиотикорезистентность возбудителей инфекции мочевых путей изучали дискодиффузионным методом на среде Мюллера–Хинтона (диски BBL, США), бактериологическом анализаторе Vitek («BioMerieux»).
Анатомическое состояние верхних мочевых путей, ренального кровотока и состояние почечной паренхимы оценивали в ходе УЗИ, которое выполняли в В-режиме линейными датчиками (частота – 7–12 МГц) и режиме цветного допплеровского картирования (ЦДК) конвексными датчиками (частота – 7 МГц).
Функциональную оценку состояния нижних мочевых путей проводили по данным комплексного уродинамического исследования (КУДИ). Наличие расстройства уродинамики по функционально обструктивному типу стало критерием исключения пациента из исследования. Следует также отметить, что по техническим причинам исследование проведено только пациентам старше трех лет.
Для оценки степени ПМР всем пациентам выполняли микционную цистоуретрографию. В качестве рентгенконтрастных веществ (РКВ) применялись 10–15% раствор неионных низкоосмолярных или изоосмолярных РКВ: йодпромид и йодиксанон.
Предварительно опорожненный мочевой пузырь ретроградно (при помощи уретрального катетера) заполняли раствором контрастного вещества, температура которого соответствовала таковой тела. После возникновения позыва на микцию (детям младшего возраста вводили количество раствора, соответствовавшее физиологическому объему мочевого пузыря) производили три снимка: при полном мочевом пузыре, во время микции (девочкам в прямой проекции, мальчикам в косой) и после мочеиспускания. Эффективная доза облучения составила 0,1 мЗв.
В случаях когда по данным УЗИ органов мочевыводящей системы определялось расширение мочеточника на протяжении его отделов, для исключения различных форм мегауретера выполняли экскреторную урографию. Исследование проведено после предварительной подготовки (очистительные клизмы, голод в день процедуры), использовали неионные низко- или изоосмолярные препараты. Доза вводимого РКВ зависела от клиренса креатинина и в среднем составила 0,5–0,6 мл на 1 кг массы тела, скорость инфузии – 0,2 мл/с. Введение РКВ осуществлено на снимочном столе, пациент находился в положении лежа. Эффективная доза облучения составила 0,2 мЗв. Первый снимок выполнен до введения РКВ с целью выявления рентгеноконтрастных конкрементов почек и мочеточников, следующий – сразу после введения (нефрофаза) для получения изображения почек, последующие — на 5–7-й, 12–15-й, 20–25-й минуте исследования, при этом получали изображение верхних мочевых путей, на основании которого оценивали их морфофункциональное состояние. Кроме того, всем пациентам сделан снимок в ортостазе, что позволило оценить подвижность почек и выявить нарушение пассажа РКВ по мочеточникам.
Показанием к проведению открытого оперативного лечения служили IV степень ПМР, непрерывно рецидивирующее течение хронического пиелонефрита, конфигурация устья мочеточника по типу «лунки для гольфа» (цистоскопическая картина) и/или явления нефросклероза на стороне поражения. Таких пациентов в нашей работе было 52. Всем детям этой группы была выполнена неоимплантация мочеточника в мочевой пузырь с резекцией предпузырного отдела по методике Cohen.
Эндоскопическая коррекция ПМР проведена 150 пациентам. В зависимости от типа введенного объемообразующего вещества – бычий коллаген, гель уродекс и гель vantris – было выделено 3 подгруппы.
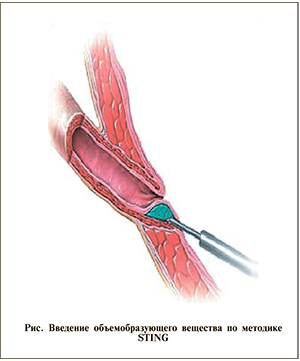
Во всех подгруппах использовали единую методику коррекции STING (см. рисунок), предусматривающую введение фиксирующего объемобразующего вещества непосредственно под внутрипузырный отдел мочеточника. Введение осуществлено при помощи иглы через рабочий канал цистоскопа № 11 Сh. Объем вводимого вещества оценивали визуально по степени смыкания устья.
По окончании процедуры мочевой пузырь дренировали баллонным катетером Фолея соответствующего возрасту размера сроком на сутки. Интраоперационно пациент получал суточную дозу антибиотика, в послеоперационном периоде для профилактики инфекции все дети получали курс уросептиков.
Результаты оценивали по данным микционной цистографии через 6 мес после операции. Под хорошим результатом понимали полное исчезновение ПМР либо значительное снижение его степени. Допускалось двукратное выполнение эндоскопической коррекции рефлюкса. При неэффективности последней ребенку проводилось открытое оперативное лечение.
В первой подгруппе было 80 пациентов с ПМР I–III степеней, из них в возрасте до 1,5 лет – 29. Выделение подобного порога мы посчитали целесообразным, исходя из способности пузырно-мочеточникового соустья к дозреванию. Всем больным данной подгруппы в качестве фиксирующего веще- ства вводили бычий коллаген в концентрации 35 мг/мл. Хороший результат лечения констатировали у 51 (63,75 %) ребенка, при этом в данную группу вошли все дети в возрасте до 1,5 лет.
Во вторую подгруппу вошли 34 ребенка, из них в возрасте 1,5 лет – 13. Фиксирующим веществом выступал препарат уродекс – стерильный, вязкий гель, состоящий из суспензии микрочастиц декстраномера и поперечно сшитых молекул гиалуроновой кислоты неживотного происхождения, биосовместимый и биодеградируемый. Микрочастицы декстраномера оказывают стимулирующее действие на формирование соединительной ткани в месте инъекции. Хороший результат удалось получить 25 (73,5%) больным, включая пациентов в возрасте до 1,5 лет.
Препарат vantris представляет собой синтетиче- ское, не рассасывающееся объемобразующее веще ство, состоящее из частиц полиакрилатно-полиспиртового кополимера, погруженного в среду-носитель, включающую глицерол и соляной раствор. Группу пациентов, которым коррекция производилось данным полимером, составили 36 человек, из них в возрасте до 1,5 лет – 10 детей. Хороший результат был получен от 30 (83,3 %) пациентов, в том числе от 9 детей в возрасте до 1,5 лет.
Обсуждение. Применение эндоскопической коррекции пузырно-мочеточникового рефлюкса у детей в современной урологии считается важным шагом в сторону минимизации сроков пребывания пациента в стационаре, снижения анестезиологических рисков и рисков послеоперационных осложнений (по сравнению с «открытыми» оперативными вмешательствами).
Наш опыт применения различных видов объемообразующих веществ позволяет характеризовать эндоскопическую коррекцию рефлюкса как высокоэффективную лечебную процедуру, нередко способную стать альтернативой классическим операциям (например, по Cohen). В то же время в ряде случаев нам не удалось добиться положительного эффекта от введения объемобразующих веществ, что, видимо, связано с ригидностью устья и внутрипузырного отдела мочеточника при нормальной цистоскопической картине. Подобное положение дел позволяет рассматривать эндоскопическое лечение рефлюкса у детей как высокоэффективный метод, с которого следует начинать терапию рефлюкса у детей.
Выводы
- Эндоскопическая коррекция ПМР является высокоэффективным и малоинвазивным методом лечения данной патологии.
- Максимального эффекта от применения современных объемобразующих веществ следует ожидать при коррекции заболевания у детей младшей возрастной группы.
- Наибольшее число положительных результатов от эндоскопического введения объемобразующих веществ удалось добиться при использовании не рассасывающегося препарата vantris.
- Эндоскопическая коррекция ПМР у детей в полном объеме не может заменить открытые антирефлюксные операции.



