Введение. Одной из сложных урологических проблем остаются стриктуры мочеиспускательного канала и гипоспадии. В настоящее время не существует общепризнанных алгоритмов оперативного лечения данных заболеваний, хотя определенный прогресс, безусловно, наблюдается [1–3]. Заболеваемость стриктурами уретры в развитых странах ниже, чем в развивающихся. Так, в США заболеваемость стриктурами уретры в потенциально предрасположенной группе составляет 0,6% и обусловливает 5000 первичных обращений к урологу в год [4]. Лечение стриктур уретры, как правило, только хирургическое. К малоинвазивным методикам относятся бужирование и внутренняя оптическая уретротомия [5]. Однако при их использовании частота рецидивов стриктуры уретры составляет не менее 50% [6]. Применение различных видов открытых хирургических операций на уретре (уретропластик) позволяет добиваться гораздо более высокой эффективности, составляющей от 73 до 98%, а в некоторых случаях – и 100% (при длительном сроке наблюдения) [7–11].
При коротких стриктурах луковичного отдела уретры наиболее эффективна и целесообразна анастомотическая уретропластика [3, 11]. Если же имеет место рецидив стриктуры, либо ее длина превышает 2 см, либо стриктура локализуется в пенильном отделе уретры, оптимально применение различных вариантов заместительной уретропластики. Диаметр уретры в этом случае увеличивается за счет «вставки» фрагмента ткани в рассеченные края мочеиспускательного канала. Вставляемым фрагментом ткани может быть лоскут/flap (на питающей ножке) либо трансплантат/graft (перемещенный участок ткани без собственного осевого кровоснабжения). Лоскутами могут служить крайняя плоть, кожа полового члена или мошонки (в настоящее время не рекомендуется к применению), влагалищная оболочка яичка и др.
В качестве трансплантатов используются позадиушная кожа, слизистая оболочка мочевого пузыря, слизистая оболочка ротовой полости, особенно слизистая щеки, и др. [12–16].
Как правило, при заместительной уретропластике применяются не тубуляризированные, а плоскостные трансплантаты. Использование тубуляризированных трансплантатов сопряжено с крайне высоким риском неудач (более 50%) [17].
Принимая во внимание тот факт, что с точки зрения реконструктивно-пластической хирургии заместительная уретропластика подразумевает использование лоскутов или трансплантатов, предпринимались и предпринимаются попытки внедрения альтернативных материалов для замещения суженной части просвета мочеиспускательного канала [18, 19]. Одним из наиболее перспективных подходов к созданию оптимального по свойствам материала для заместительной уретропластики является тканевая инженерия.
Представленная ниже работа служит логическим продолжением ранее опубликованного экспериментального исследования по созданию тканеинженерной матрицы на основе децеллюляризированной сосудистой стенки [20]. Результатом эксперимента стало получение матрицы, свойства которой позволили предложить ее в качестве материала для заместительной уретропластики человеку.
 Цель исследования: оценить безопасность и эффективность заместительной уретропластики при стриктуре уретры у мужчины с использованием тканеинженерной конструкции на основе децеллюляризированной матрицы из трупной артериальной стенки (ДМТАС) и аутологичных эпителиоцитов слизистой оболочки щеки.
Цель исследования: оценить безопасность и эффективность заместительной уретропластики при стриктуре уретры у мужчины с использованием тканеинженерной конструкции на основе децеллюляризированной матрицы из трупной артериальной стенки (ДМТАС) и аутологичных эпителиоцитов слизистой оболочки щеки.
Для достижения данной цели были поставлены и решены следующие задачи:
- создать тканеинженерную конструкцию на основе ДМТАС и эпителиоцитов слизистой оболочки щеки человека;
- выполнить заместительную уретропластику с использованием тканеинженерной конструкции на основе ДМТАС и аутологичных эпителиоцитов слизистой оболочки щеки при стриктуре луковичного отдела уретры.
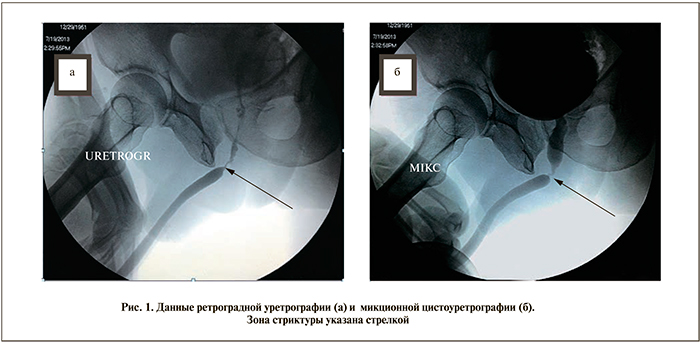
Материалы и методы. Больной Б. 1951 года рождения с 2003 г. стал отмечать ухудшение мочеиспускания. В 2005 г. диагностирована доброкачественная гиперплазия предстательной железы, выполнена позадилонная аденомэктомия. После удаления уретрального катетера мочеиспускание восстановилось. Спустя 1 мес стал отмечать прогрессивное ухудшение мочеиспускания. При обследовании диагностирована стриктура уретры. С 2005 по 2013 г. выполнены многократные бужирования уретры, оптические уретротомии с временным положительным эффектом. По данным рентгенологических методов обследования (ретроградная уретрография, микционная цистоуретрография), протяженность стриктуры проксимальной части луковичного отдела уретры составила 2,5 см (рис. 1).
С учетом анамнеза заболевания, нетравматической этиологии, а также протяженности стриктуры уретры было принято решение о выполнении заместительной уретропластики. В качестве материала для субституции была выбрана тканеинженерная конструкция. Пациентом было подписано информированное согласие на проведение операции и необходимые исследования, а также получено разрешение независимого локального этического комитета на проведения исследования.
В качестве матрицы была использована ДМТАС, полученная ранее описанным методом [20]. После изъятия трупной артерии механически удалены периартериальная клетчатка и фасциальный футляр, выделены отходящие сосудистые ветви. Затем артерию промыли различными растворами и произвели ферментную обработку раствором террилитина при 40˚С в течение 4 ч в фосфатном буфере с рН 7,5–8,0 и расходе фермента 15–25 ПЕ/г влажной ткани. Контроль децеллюляризации осуществлен морфологически (по отсутствию клеток на гистологических срезах артерии). Промытые сосуды подвергли отжиму салфетками для удаления избыточной влаги и радиационной стерилизации (дозой 2,5 Мрад).
 Далее фрагмент слизистой оболочки щеки размером 5×5 мм иссекли под местной анестезией 2%-ным раствором лидокаина. Рана донорской зоны зажила первичным натяжением (без наложения швов). Клетки выделили из данного фрагмента с использованием 0,2%-ного раствора диспазы («Sigma», США). Полученные клетки культивировали в полной культуральной среде, состоявшей из бессывороточной среды Keratinocyte-SFM («Life Technologies», США) с добавлением инсулина в концентрации 5 мкг/мл, гидрокортизона 5 мкг/мл, эпидермального фактора роста 10 нг/мл, холерного токсина 10×10 М, трансферрина 5 мг/мл, аденина 1,8×104 М, лиотиронина 2×10-11М, в увлажненной среде при температуре 37°С в СО2-инкубаторе при концентрации СО2 5%. Смену питательной среды осуществляли каждые 48 ч. Продолжительность культивирования клеток перед высеванием на матрицу составила 5 нед. При высевании на подготовленную матрицу размером 17×43 мм был использован третий пассаж эпителиоцитов из расчета 3×106 клеток на 1 см2, после чего культивирование продолжалось в течение 5 сут до имплантации конструкции. Тканеинженерная конструкция была доставлена в урологическую клинику в специальном термоконтейнере. Полученная тканеинженерная конструкция имплантирована пациенту в проксимальную часть луковичного отдела уретры по технике Asopa (dorsal inlay).
Далее фрагмент слизистой оболочки щеки размером 5×5 мм иссекли под местной анестезией 2%-ным раствором лидокаина. Рана донорской зоны зажила первичным натяжением (без наложения швов). Клетки выделили из данного фрагмента с использованием 0,2%-ного раствора диспазы («Sigma», США). Полученные клетки культивировали в полной культуральной среде, состоявшей из бессывороточной среды Keratinocyte-SFM («Life Technologies», США) с добавлением инсулина в концентрации 5 мкг/мл, гидрокортизона 5 мкг/мл, эпидермального фактора роста 10 нг/мл, холерного токсина 10×10 М, трансферрина 5 мг/мл, аденина 1,8×104 М, лиотиронина 2×10-11М, в увлажненной среде при температуре 37°С в СО2-инкубаторе при концентрации СО2 5%. Смену питательной среды осуществляли каждые 48 ч. Продолжительность культивирования клеток перед высеванием на матрицу составила 5 нед. При высевании на подготовленную матрицу размером 17×43 мм был использован третий пассаж эпителиоцитов из расчета 3×106 клеток на 1 см2, после чего культивирование продолжалось в течение 5 сут до имплантации конструкции. Тканеинженерная конструкция была доставлена в урологическую клинику в специальном термоконтейнере. Полученная тканеинженерная конструкция имплантирована пациенту в проксимальную часть луковичного отдела уретры по технике Asopa (dorsal inlay).
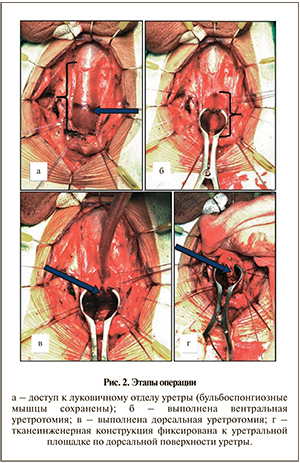
Техника операции. Через срединный разрез промежности осуществлен доступ к луковичному отделу уретры без пересечения бульбоспонгиозных мышц (мышце-, нервосберегающая техника; рис. 2.а). Последовательно выполнены вентральная и дорсальная уретротомии над зоной стриктуры (рис. 2, б, в), а также по 1 см дополнительно (проксимально и дистально) в пределах визуально неизмененных тканей уретры. Фиксация тканеинженерной конструкции к краям нативной слизистой оболочки мочеиспускательного канала, а также к подлежащей белочной оболочке кавернозных тел (дорсальная фиксация) осуществлена одиночными узловыми швами Vicryl 6-0 (рис. 2, г). После проведения силиконового уретрального катетера Фолея № 16 Ch целостность спонгиозного тела по вентральной поверхности восстановлена одиночными узловыми швами Vicryl 5-0 и 4-0 в два ряда.
Мочевой пузырь дополнительно дренирован цистостомическим дренажом. На 28-й день после операции уретральный катетер удален, выполнены ретроградная и микционная цистоуретрография, урофлоуметрия, проведена оценка объема остаточной мочи. Полученные в ходе адаптации формы и размеры тканеинженерной конструкции под форму и размеры уретральной площадки фрагменты тканеинженерной конструкции были подвергнуты гистологическому исследованию.
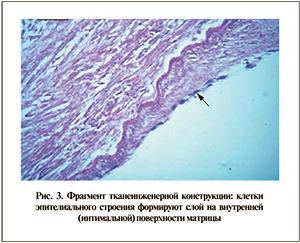
Результаты. Гистологическое исследование срезов эпителизированной матрицы показало, что клетки эпителиального строения формируют слой на внутренней (интимальной) поверхности матрицы (рис. 3).
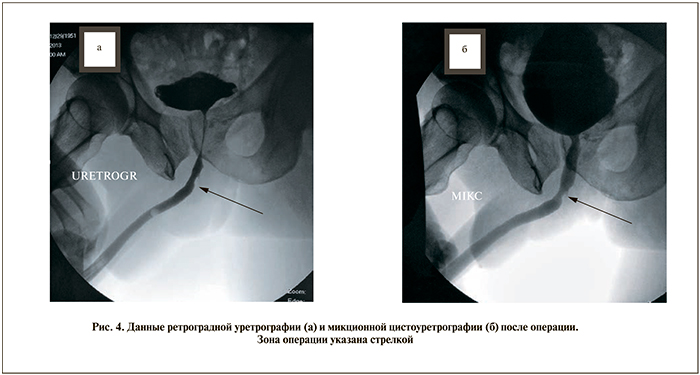
Течение послеоперационного периода без особенностей. Через 4 нед после операции уретральный катетер был удален. По данным ретроградной уретрографии и микционной цистоуретрографии стриктур и затеков контрастного вещества в зоне операции не выявлено (рис. 4).
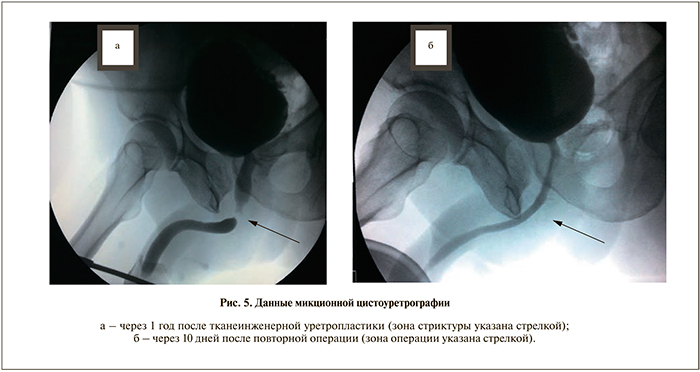
Максимальная скорость мочеиспускания составила 24,6, средняя – 16,3 мл/с при объеме 132 мл без остаточной мочи. Спустя 4 мес после операции у пациента был диагностирован рецидив стриктуры уретры. Выполнены уретроскопия, оптическая уретротомия. При уретроскопии выявлено, что рецидив стриктуры возник вне зоны расположения тканеинженерной конструкции (на границе дистальной части тканеинженерной конструкции и нативной уретры). В течение последующих 8 мес пациенту дважды выполнено бужирование уретры в связи со снижением интенсивности струи мочи. Спустя год после тканеинженерной уретропластики при обследовании был выявлен рецидив стриктуры луковичного отдела уретры (рис. 5, а). Протяженность рецидива стриктуры составила 0,5 см (включая зону облитерации). Выполнено повторное оперативное вмешательство: иссечение суженного участка уретры, уретро-уретральный анастомоз (операция Хольцова). Течение послеоперационного периода без особенностей. Спустя 10 дней после операции уретральный катетер удален. По данным микционной цистоуретрографии патологических изменений не выявлено (рис. 5, б). Через 5 мес после повторной операции признаков ухудшения качества мочеиспускания нет.
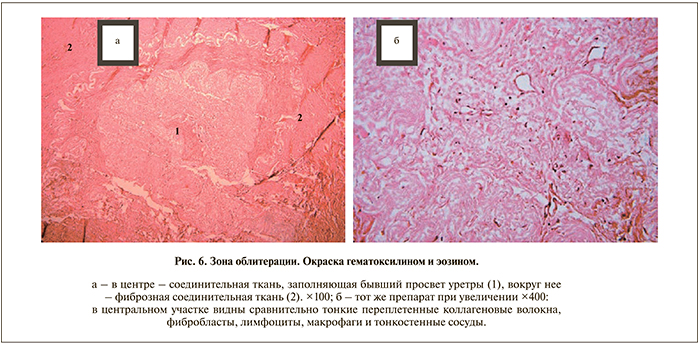
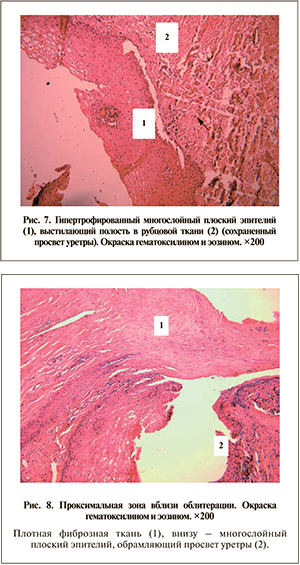
При гистологическом исследовании резецированных во время повторной операции фрагментов уретры выявлено следующее. Зона облитерации: данный участок уретры представляет собой массивный блок грубой рубцовой соединительной ткани разной структуры. В центре биоптата (возможно, в бывшем просвете уретры) ткань состоит из беспорядочно переплетенных, но относительно тонких коллагеновых волокон; клетки в ней представлены фибробластами, лимфоцитами, макрофагами и немногочисленными нейтрофильными лейкоцитами. Кроме того, в ткани видны тонкостенные сосуды: капилляры, венулы и артериолы (рис. 6). Фиброзно-рубцовая соединительная ткань, окружающая вышеописанный центральный участок, состоит из плотно упакованных пучков толстых коллагеновых волокон. Между волокнами видны фибробласты, немногочисленные лимфоциты и макрофаги, воспалительная инфильтрация практически отсутствует. Таким образом, в области облитерации просвет уретры и окружающие его ткани практически полностью замещены рубцовой соединительной тканью различной степени зрелости. Однако на периферии образца выявлен участок, где ткань покрыта многослойным плоским эпителием (рис. 7).
Проксимальная зона, близкая к участку облитерации. В участке ткани, взятой в этой области, имеется грубая рубцовая соединительная ткань, частично выстланная многослойным плоским эпителием (рис. 8). Это свидетельствует о сохранении в этой зоне просвета уретры. Вне этого участка также обнаруживается фиброзная рубцовая ткань, но менее плотная.
Таким образом, данные гистологического исследования указывают на то, что:
- тканеинженерная конструкция, матриксом которой служит лишенная клеток стенка артерии, полностью резорбируется, замещаясь фиброзной тканью;
- в области облитерации соединительная ткань, заполняющая просвет уретры, имеет более рыхлый и незрелый характер, чем окружающая ее фиброзно-рубцовая ткань;
- практически не определяется воспалительная инфильтрация, что свидетельствует о незначительной иммуногенности тканеинженерной конструкции;
- примыкающий к зоне облитерации участок уретры сохраняет просвет; его внутренняя поверхность эпителизирована, что свидетельствует о функциональной состоятельности тканеинженерной конструкции и/или регенерации этой части уретры.
Обсуждение. Как уже было сказано выше, настоящее клиническое исследование является второй частью единой научной работы. В первой части путем децеллюляризации трупной артериальной стенки была получена тканеинженерная матрица — ДМТАС. Сроки и характер биодеградации данной матрицы были оценены в эксперименте на крысах. Далее тубуляризированная ДМТАС использовалась для замещения дефекта уретры у самцов кроликов.
Результаты указанных выше экспериментов позволили заключить:
- Коллагеновая матрица на основе децеллюляризированной трупной артерии человека обладает низкой биологической активностью и безопасна в качестве материала для заместительной уретропластики.
- В эксперименте на крысах биодеградация сосудистой матрицы (ДМТАС) наступает в течение 60–90 сут.
- В эксперименте на кроликах при пластике уретры сосудистой матрицей (ДМТАС) имеют место медленная деструкция матрицы и прогрессирующая эпителизация соединительнотканной капсулы.
- Использование ДМТАС в качестве материала для заместительной уретропластики в эксперименте на кроликах показало хороший структурный и функциональный результат.
 Полученные данные позволили предложить данную матрицу в качестве основы для тканеинженерной конструкции, которая (после одобрения этическим комитетом) была использована при заместительной уретропластике в данном клиническом исследовании.
Полученные данные позволили предложить данную матрицу в качестве основы для тканеинженерной конструкции, которая (после одобрения этическим комитетом) была использована при заместительной уретропластике в данном клиническом исследовании.
В литературе представлено несколько работ по клиническому использованию рецеллюляризированных матриц при заместительной уретропластике человеку. В двух из них была использована монокультура клеток [21, 22], в остальных – ко-культура [23–25].
M. Fossum и соавт. [22] получали уротелиальные клетки путем промывания мочевого пузыря. Полученные клетки культивировали и наносили на децеллюляризированный дермальный матрикс, который затем использовали для создания неоуретры 6 мальчикам с мошоночной или промежностной формой гипоспадии. При среднем сроке наблюдения (87 мес) только у одного мальчика была выполнена оптическая уретротомия с целью восстановления нормального мочеиспускания.
O. Engel и соавт. [21] представили работу, в которой была использована матрица собственного производства на основе коллагена (MukoCell®). Матрицу засевали культивированными эпителиоцитами слизистой оболочки щеки. Полученную тканеинженерную конструкцию имплантировали в область стриктуры. Эффективность составила 90%, однако авторы не указывают длительность наблюдения.
S. Bhargava и соавт. [23] впервые использовали тканеинженерную конструкцию для реконструкции уретры у людей. Матрицей служила донорская деэпидермизированная дерма (donor deepidermised dermis), на которую высаживались культивированные кератиноциты и фибробласты щеки. В исследование были включены 5 пациентов со сложными рецидивными стриктурами уретры на фоне склеротического лихена. Трем пациентам была выполнена двухэтапная операция, двум – одноэтапная.
В двух случаях потребовалось полное либо частичное удаление трансплантата из-за выраженного фиброза и гипертрофии тканей соответственно. В трех оставшихся случаях требовались инструме нтальные вмешательства для коррекции возникших стриктур.
A. Raya-Rivera и соавт. [24] использовали тубуляризированную матрицу из полимера полигликолевой кислоты (PGA), на внутреннюю поверхность которой высаживали культивированные эпителиальные клетки мочевого пузыря, а на внешнюю – гладкомышечные клетки мочевого пузыря. Все пациенты страдали посттравматической облитерацией мембранозного отдела уретры. После иссечения рубцовых тканей была выполнена имплантация тканеинженерной уретры. При среднем сроке наблюдения 71 мес эффективность составила 100%.
В настоящем исследовании мы успешно культивировали эпителиоциты слизистой оболочки щеки пациента, высеянные на матрицу, полученную путем децеллюляризации трупной артериальной стенки. Полученная тканеинженерная конструкция была использована при заместительной уретропластике. Следует отметить, что ранний послеоперационный период не сопровождался какими-либо осложнениями и побочными эффектами. Отсутствие затеков контрастного вещества во время микционной цистоуретрографии (при удалении уретрального катетера) свидетельствует о полном приживлении тканеинженерной конструкции и отсутствии реакции отторжения.
В позднем послеоперационном периоде (через 4 мес после операции) в средней части тканеинженерной конструкции отмечен рецидив стриктуры. Рецидив мог возникнуть в результате как использования конкретной тканеинженерной конструкции, так и естественного течения стриктурной болезни уретры. Следует отметить, что протяженность рецидива стриктуры уретры (вместе с зоной облитерации) составила 0,5 см, в то время как протяженность использованной тканеинженерной конструкции была 4,5 см, а протяженность стриктуры до операции – 2,5 см. Исходя из этого, можно предположить, что локальный ограниченный рецидив стриктуры уретры был связан с неадекватной васкуляризацией тканеинженерной конструкции в зоне контакта с резидентными тканями (фиброз), а также ее ишемией и постишемическим склерозом. Наличие у пациента в анамнезе множества трансуретральных вмешательств (оптической уретротомии, бужирования, катетеризации) могли способствовать развитию рубцово-склеротических процессов в зоне стриктуры, что косвенно подтверждает предположение, высказанное выше. Тем не менее наличие нормального просвета уретры, покрытого эпителиальной выстилкой, в зоне, прилегающей к рецидиву стриктуры, указывает на функциональность конструкции, а отсутствие элементов матрицы в резецированных тканях свидетельствует о полной биодеградации тканеинженерной конструкции.
Тканевая инженерия мочеиспускательного канала является клинической реальностью. Требуются дополнительные доклинические и клинические исследования для определения оптимального вида матрицы и типа клеток, что позволит максимально эффективно использовать тканеинженерные конструкции в реконструктивной хирургии мочеиспускательного канала.
Выводы
- Коллагеновая матрица на основе децеллюляризированной трупной артерии человека формирует стабильную тканеинженерную конструкцию с культивированными аутологичными эпителиоцитами щеки.
- Тканеинженерная конструкция на основе ДМТАС и аутологичных эпителиоцитов щеки безопасна в качестве материала для заместительной уретропластики. Решение вопроса об эффективности требует дополнительных исследований.
Благодарности
Авторы благодарят за помощь в работе над проектом зав. виварием А.В. Лузина, зав. каф. оперативной хирургии и топографической анатомии проф. С.С. Дыдыкина, зав. каф. иностранных языков И.Ю. Марковину, начальника отдела клинических исследований И.И. Ермолаеву, председателя независимого этического комитета проф. Д.А. Балалыкина, независимых экспертов проф. Н.А. Григорьева и проф. Е.А. Безрукова.
Работа выполнена при финансовой поддержке РФФИ (проект №13-02-01363 А – Тканеинженерные конструкции для уретропластики) и РНФ (проект №15-15-00132 – Новые фотополимеризующиеся биосовместимые композиции и скаффолды для регенеративной и реконструктивной урологии, создаваемые методом лазерного 3D принтинга).



