Введение. Радикальная простатэктомия (РПЭ) остается высокоэффективным методом лечения больных как локализованным [1, 2], так и местнораспространенным [3] раком предстательной железы (РПЖ), продемонстрировавшим преимущество в раковоспецифической выживаемости по сравнению с выжидательной тактикой в двух проспективных рандомизированных исследованиях [4, 5].
 Последнее десятилетие ознаменовалось широким внедрением роботассистированной радикальной простатэктомии (РАРПЭ), особенно в странах с развитой экономикой, несмотря на отсутствие рандомизированных исследований, указывающих на преимущество данной методики по сравнению с «классической» позадилонной радикальной простатэктомией (ПРПЭ) [6]. Наличие противоречивых данных обусловило активную полемику относительно целесообразности признания РАРПЭ новым «золотым» стандартом РПЭ [7, 8]. Стоит отметить, что клинические рекомендации ведущих урологических ассоциаций в отсутствие достаточной доказательной базы указывают на равенство всех вариантов РПЭ [9].
Последнее десятилетие ознаменовалось широким внедрением роботассистированной радикальной простатэктомии (РАРПЭ), особенно в странах с развитой экономикой, несмотря на отсутствие рандомизированных исследований, указывающих на преимущество данной методики по сравнению с «классической» позадилонной радикальной простатэктомией (ПРПЭ) [6]. Наличие противоречивых данных обусловило активную полемику относительно целесообразности признания РАРПЭ новым «золотым» стандартом РПЭ [7, 8]. Стоит отметить, что клинические рекомендации ведущих урологических ассоциаций в отсутствие достаточной доказательной базы указывают на равенство всех вариантов РПЭ [9].
Одним из принципиальных, не разрешенных к настоящему времени вопросов остается онкологическая эффективность РАРПЭ и ПРПЭ, в частности частота позитивных хирургических краев (ПХК). Несмотря на то что ПХК, по данным последних исследований, не является независимым предиктором раковоспецифической смертности, его наличие может увеличить риск биохимического рецидива, потребность в дополнительной терапии РПЖ, а также быть источником значительного беспокойства пациентов [10]. Различные результаты ряда работ, указывающих как на преимущество РАРПЭ [11, 12], так и на равенство обеих методик в частоте ПХК [13, 14], побудили к проведению собственного исследования, целью которого стал сравнительный анализ частоты ПХК у пациентов, перенесших РАРПЭ и ПРПЭ (опыт одного хирурга).
Материалы и методы. В исследование (ретроспективный анализ) включены 179 пациентов, которым с января 2014 по апрель 2015 г. в урологическом отделении ГКБ им. С. П. Боткина одним хирургом выполнена РАРПЭ (n=63) и ПРПЭ (n=116) соответственно. Все РАРПЭ выполнены с использованием роботизированной хирургической системы da Vinci Si («Intuitive Surgical»®) трансперитонеальным доступом.

Стратификация пациентов по группам риска развития рецидива после лечения проведена согласно классификации Европейской ассоциации урологов (EAU) [9]: низкий риск – пациенты с клинической стадией cT1–T2a, суммарным индексом Глисона после биопсии ≤6 и уровнем простатического специфического антигена (ПСА) <10 нг/мл; промежуточный риск – пациенты с клинической стадией cT2b–T2c, суммарным индексом Глисона после биопсии, равным 7, и уровнем ПСА 10–20 нг/мл; высокий риск – пациенты с клинической стадией cT3а, суммарным индексом Глисона после биопсии, равным 8–10, и уровнем ПСА >20 нг/мл; очень высокий риск – пациенты со стадией cT3b–Т4 и/или данными за поражение лимфатических узлов. В исследование не включены 9 пациентов с РПЖ очень высокого риска, перенесших ПРПЭ, по причине отсутствия пациентов очень высокого риска в группе РАРПЭ.
 Гистологическое исследование всех удаленных препаратов (предстательная железа [ПЖ] с семенными пузырьками; при наличии – лимфатические узлы, отдельные участки дистальной уретры/шейки мочевого пузыря) проводилось в патологоанатомическом отделении ГКБ им. С. П. Боткина. Наличие опухолевой ткани в окрашенном крае резекции определено как ПХК.
Гистологическое исследование всех удаленных препаратов (предстательная железа [ПЖ] с семенными пузырьками; при наличии – лимфатические узлы, отдельные участки дистальной уретры/шейки мочевого пузыря) проводилось в патологоанатомическом отделении ГКБ им. С. П. Боткина. Наличие опухолевой ткани в окрашенном крае резекции определено как ПХК.
Для характеристики групп исследования использованы методы описательной статистики: среднее значение со стандартным отклонением. Для сравнения непрерывных переменных использовали U-тест Манна–Уитни, при сравнительном анализе категориальных данных использовали критерий χ2 Пирсона. При всех видах статистического анализа за достоверное принималось значение p<0,05. Для статистической обработки использовано программное обеспечение Graph Pad Prism 6 (Graph Pad Soft ware Inc, La Jolla, США).
Результаты. В первую очередь необходимо отметить существенные различия между двумя группами. Так, в группе ПРПЭ у пациентов чаще выявляли более высокое содержание ПСА, низкодифференцированные опухоли, среди них было больше пациентов с местнораспространенным процессом и высоким риском развития рецидива (см. таблицу).
При оценке общей частоты ПХК в обеих группах отмечена тенденция к их меньшей встречаемости в группе РАРПЭ по сравнению с ПРПЭ, однако различия не достигли статистической значимости – 12,7 против 21,6% (p=0,09). В группе РАРПЭ ПХК наиболее часто констатировали в зоне шейки мочевого пузыря (4,7%), в базальных (3,2%) и боковых (3,2%) отделах ПЖ и реже всего – в зоне апекса ПЖ (1,6%). В группе ПРПЭ, напротив, ПХК наиболее часто имел место в зоне апекса (6,9%) и далее в базальном отделе ПЖ (6%), боковых отделах (2,6%) и области шейки мочевого пузыря (2,6%); в 3,5% случаев определен мультифокальный ПХК.
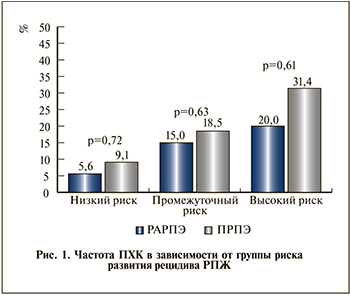
При сравнительной оценке частоты ПХК в зависимости от группы риска развития рецидива различий между группами выявлено не было (рис. 1). Более того, использование обеих методик сопровождалось одинаковой частотой ПХК после стратификации пациентов в зависимости от патологической стадии (рис. 2).
Обсуждение. Интенсивная экспансия РАРПЭ как в США, так и в экономически развитых странах Европы и Азии породила в экспертной среде активную дискуссию о научной обоснованности данного явления. Опубликованные к настоящему моменту исследования позволяют сделать вывод о как минимум схожей онкологической и функциональной эффективности РАРПЭ по сравнению с ПРПЭ, причем отдельные работы указывают на ее большую эффективность.
Так, ряд исследований продемонстрировал меньшую частоту ПХК после РАРПЭ. Например, J. Smith и соавт. [11] отметили меньшую частоту ПХК после РАРПЭ по сравнению с ПРПЭ как при оценке всех включенных в исследование случаев (15 и 35% соответственно, p<0,001), так и отдельно при стадии pT2 (9,4 и 24,1%, p<0,001) и pT3 (50 и 60%, p<0,001). В крупном ретроспективном исследовании [15] также продемонстрировано преимущество РАРПЭ в общем количестве ПХК (13,6 против 18,3%, p<0,001), при клинически локализованном (pT2) и местнораспространенном (pT3a) процессе и при РПЖ промежуточной и высокой групп риска (достоверных различий при РПЖ низкой группы риска выявлено не было). Схожие данные представлены в ретроспективном обзоре [12]; в качестве ограничений исследования указаны большая доля пациентов высокого риска и более ранние сроки операции в группе ПРПЭ.
В то же время существенное количество работ демонстрирует отсутствие различий в частоте ПХК между двумя методиками. В частности, L-O. Gagnon и соавт. [16] не выявили различий между РАРПЭ и ПРПЭ ни по общей доле ПХК (24,6 и 31% соответственно, p=0,18), ни при патологической стадии pT2 (17,3 и 21,7%, p=0,43) и pT3–4 (51,2 и 43,5%, p=0,45). Отсутствие различий продемонстрировано также в ретроспективном исследовании M. Alemozaffar и соавт. [13] (24,4% после РАРПЭ и 23,1% после ПРПЭ), проспективном мультицентровом исследовании E. Haglind и соавт. [14] (21,8% после РАРПЭ и 20,9% после ПРПЭ) и в работе П. И. Раснера и соавт. [17] (6,4% после РАРПЭ и 6,1% после ПРПЭ).
В настоящем исследовании, несмотря на имевшую место тенденцию к меньшей частоте ПХК в группе РАРПЭ (может объясняться значительно более неблагоприятными клиническими характеристиками больных группы ПРПЭ), не выявлено различий при стратификации пациентов в зависимости от группы риска и патологической стадии РПЖ. Интересно отметить различную превалирующую локализацию ПХК – апекс при ПРПЭ, шейка мочевого пузыря и базальные отделы при РАРПЭ – потенциально указывающую на более благоприятные условия для этапа апикальной диссекции при РАРПЭ. Из ограничений исследования в первую очередь необходимо отметить его ретроспективный характер и нерандомизированный дизайн, что является общим недостатком всех работ, посвященных сравнению данных методик. Кроме того, продолжающаяся кривая обучения в РАРПЭ позволяет рассчитывать на улучшение результатов в процессе накопления опыта [18].
Заключение. При ретроспективной оценке результатов выполненных одним хирургом РАРПЭ и ПРПЭ не выявлено значимых различий в частоте ПХК.
В настоящее время приоритет РАРПЭ в отношении онкологического контроля РПЖ не доказан и требует дальнейшего исследования.


