Введение. Около 15% пар не могут зачать детей в первый год совместной жизни и 8% остаются бездетными в течение всей жизни; в половине случаев причина – мужской фактор [1, 2]. В последние годы стало ясно, что плохое качество сперматозоидов – причина не только отсутствия беременности, но и нарушений развития зародыша, врожденных аномалий и даже рака у детей [3–5]. Актуальность данной проблемы не вызывает сомнений, однако разработка стандартов помощи бездетным парам представляет весьма трудную задачу. Анализ четырех руководств, вышедших за последние годы (2008–2015), показывает расхождения в их подходах и содержании окончательных рекомендаций, что ограничивает их полезность в стандартизации клинической практики для улучшения результатов лечения бесплодия [6].
Настоящая работа посвящена рассмотрению актуальных вопросов этиопатогенеза, диагностики, профилактики и лечения нарушений репродуктивной функции мужчин как с клинических позиций, так и с точки зрения организации здравоохранения.
Этиопатогенез. Мужское бесплодие – это многофакторный синдром, включающий широкий спектр нарушений, симптом множества различных патологических состояний, затрагивающих как половую, так и другие системы организма: эндокринную, нервную, кровеносную, иммунную [7–9].
Согласно рекомендациям ВОЗ [1], выделяют 16 основных нозологий, каждая из которых включает до нескольких десятков конкретных патогенетических факторов; 4 из 16 диагнозов описательные, без указания истинной причины: идиопатическая олиго-, астено- , терато- и азооспермия. Большая часть «идиопатических» форм на самом деле генетически обусловлена и связана с мутациями и полиморфизмом многих генов – развитие сперматозоидов регулируют более 2000 генов, только несколько десятков из них находятся в Y-хромосоме [3, 4]. Довольно широк перечень факторов внешней среды [7–9]. Значительную долю случаев составляют нарушения качества спермы, формально соответствующей «нормозооспермии» [10]
Этиопатогенез мужского бесплодия, по нашему мнению, может быть представлен следующим образом (табл. 1).

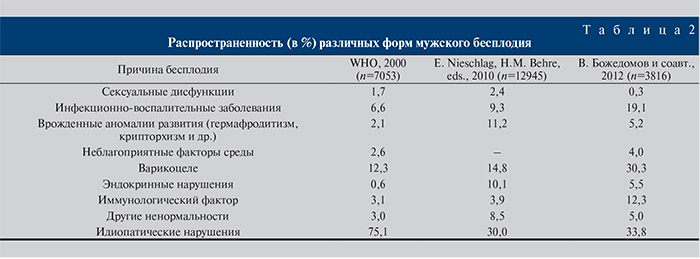
Данные о распространенности основных причин мужского бесплодия, по данным многоцентровых отечественных и зарубежных исследований, представлены в табл. 2.
При этом для многих «общепринятых» факторов риска, включая варикоцеле и простатит, взаимосвязь с бесплодием остается не доказанной [2, 7–9]. В зависимости от генетических особенностей одни и те же факторы могут либо снижать фертильность мужчин, либо нет. Например, фактором риска развития бесплодия при инфекционно-воспалительном процессе считают присутствие в сперме Anaerococcus, E. coli, C. trachomatis, U. urealyticum, M. hominis, нарушение равновесия активация/апоптоз лейкоцитов в репродуктивном тракте мужчины, степень гиперпродукции активных форм кислорода (АФК), нарушение дренажной функции семенных пузырьков, наличие фиброза простаты и др. [11–15]. В качестве предрасполагающих факторов развития бесплодия при варикоцеле описаны антиспермальные антитела (АСАТ), микроделеции некоторых митохондриальных генов, недостаточность белков теплового шока, экспрессии каспаз, Bak, р53 и ряда других факторов, противостоящих оксидативному стрессу (ОС) и нарушающих соотношение пролиферация/апоптоз сперматогенных клеток [15–18].
Из множества предполагаемых на сегодняшний день причин, вызывающих нарушение функции сперматозоидов, повреждение ядерной ДНК – наиболее изученная и все более признаваемая в качестве ключевого фактора, влияющего на качество эмбриона, его развитие и имплантацию [3, 4, 7]. До 40% выкидышей может быть предсказано на основании результатов оценки целостности спермальной ДНК [3, 19, 20]. Мета-анализы, посвященные роли фрагментации ДНК, показали, что риск спонтанных абортов и нарушений развития зародыша увеличивается до четырех раз при повышенной фрагментации ДНК сперматозоидов (норма – 15–30% в зависимости от использованных методов) даже после ЭКО и ИКСИ [3, 20]. При этом повышенная фрагментация ДНК может иметь место даже при «нормозооспермии» [3, 4, 10]. Избыточная фрагментация ДНК может быть врожденной – нарушения протаминации, недостаточная активность топоизомераз и чаперонов – или вызвана влиянием внешних факторов: курение табака, инфекционно-воспалительные процессы репродуктивного тракта, перегревание яичек, варикоцеле, АСАТ, диабет и др. [3, 4, 15, 19–22]. Ведущим патогенетическим механизмом таких повреждений считают гиперпродукцию АФК – озона, перекиси водорода, оксида азота, что приводит к ОС сперматозоидов [3, 7, 9, 15].
Обследование мужчин из бездетных пар. Стан-дартизированный подход к обследованию пациентов описан в руководстве ВОЗ [1], уточнен в последующих руководствах и монографиях [2, 6–9, 23, 24]. В большинстве (60–70%) случаев при тщательном сборе анамнеза, физикальном обследовании, УЗИ мошонки и простаты, по результатам анализа спермы, специальных гормональных, генетических, микробиологических и других исследований удается выявить причины мужского бесплодия. В соответствии с современными требованиями лаборатория андрологии-сперматологии должна выполнять анализ спермы, включающий оценку количества, морфологии, жизнеспособности и подвижности сперматозоидов, признаков воспаления (лейкоциты, эластаза, АФК), антиоксидантную активность эякулята, повреждения ДНК сперматозоидов, АСАТ, анализ постэякуляторной мочи; оценивать взаимодействие сперматозоидов с цервикальной слизью и другие функциональные тесты [2, 7–9, 24, 25].
Объем обследования и методическая оснащенность лабораторий должны различаться в различных ЛПУ. С позиций организации здравоохранения можно выделить три уровня обследования и, соответственно, оснащения.
Первый обязателен для всех ЛПУ, имеющих в своем составе кабинет уролога. Он включает:
- первичное обследование мужчины, обратившегося к урологу в связи с отсутствием желаемой беременности у супруги (жалобы, анамнез, физикальное обследование);
- выявление инфекционно-воспалительных процессов репродуктивного тракта (определение лейкоцитов в мазке и секрете простаты, микробиологическое и молекулярно-генетическое исследование на инфекции);
- УЗИ органов мошонки, предстательной железы и семенных пузырьков;
- анализы крови на ВИЧ (с согласия пациента), вирусные гепатиты В и С, сифилис.
Второй уровень обязателен для всех ЛПУ, в той или иной форме занимающихся проблемой бесплодного брака: андрологических кабинетов окружных (кустовых, районных и т.п.) урологических амбулаторно-поликлинических отделений, консультаций «Брак и семья», центров планирования семьи и репродукции.
Он включает:
- выполнение стандартной спермограммы, в том числе окраску сперматозоидов специальными красителями и «строгую» оценку морфологии;
- определение АСАТ на подвижных сперматозоидах (MAR- или IBT-тест);
- гормональные исследования (ФСГ, пролактин, ингибин В, тестостерон, андроген-связывающий глобулин и др.).
Это позволяет выделить группу мужчин с нарушениями качества спермы и направить их для более углубленного обследования в специализированные клиники третьего уровня, где должны быть проведены дополнительные исследования:
- генетические (кариотипирование, микроделеции и точечные мутации AZF, муковисцидоз, полиморфизм рецепторов андрогенов и др.);
- биохимические исследования эякулята (фруктоза, цитрат, цинк, альфа-гликозидаза, акрозин и др.);
- оценка взаимодействия сперматозоидов с цервикальной слизью in vivo и in vitro;
- гипоосмотический тест;
- оценка акросомой реакции (иммунофлюоресценция, проточная цитометрия);
- измерение продукции АФК в нативном эякуляте и отмытыми сперматозоидами (хемилюминесценция);
- оценка фрагментации ДНК (TUNEL, COMET, SCD);
- оценка нарушений упаковки и конденсации хроматина (CMA3, Aniline blue, Acridine orange);
- комплексное исследование «отмытых» сперматозоидов.
Не следует забывать, что нарушения качества спермы – изменение акросомной реакции, фрагментация ДНК, аутоиммунные реакции и др. – могут иметь место при «нормозооспермии».
Урологи-андрологи кабинетов второго и третьего уровней должны владеть специальными теоретическими знаниями и практическими навыками, позволяющими целенаправленно выявлять патологические состояния, приводящие к снижению фертильности мужчины, назначать соответствующую терапию, при необходимости выполнять оперативные пособия, а также проводить отбор пациентов для вспомогательных репродуктивных технологий (ВРТ).
Установление конкретных патогенетических механизмов нарушения мужской репродуктивной функции позволяет шире использовать возможности специфической терапии, повышать ее эффективность и снижать стоимость.
Сохранение и восстановление репродуктивной функции мужчин. Рекомендации по лечению мужчин из бездетных пар представлены во многих руководствах, монографиях и статьях [2, 6–9, 23]. Однако имеющиеся на сегодняшний день данные противоречивы и недостаточно надежны с точки зрения доказательной медицины [6]. Стандартов помощи бездетным парам с мужским фактором нет ни в одной стране мира.
По нашему мнению, ведение мужчин из бездетных пар следует рассматривать в виде трех взаимосвязанных этапов комплексной профилактики нарушений репродуктивной функции.
I этап: первичная профилактика – устранение потенциально вредных факторов окружающей среды, работы и образа жизни (см. табл. 1). При некоторых аномалиях, например крипторхизме, травмах, инфекциях, действии токсических веществ и лекарственных препаратов, бесплодие можно предотвратить.
Для восстановления фертильности мужчин необходимо:
- наладить нормальный ритм труда и отдыха, полноценное питание, ритм половой жизни, провести лечение сопутствующих заболеваний;
- исключить перегревание, снизить физические нагрузки при занятиях экстремальными видами спорта;
- устранить факторы, вызывающие депрессию, состояние страха, неврозы.
Выполнение этих условий в половине случаев способствует улучшению показателей спермограммы.
II этап: вторичная профилактика – адекватное обследование и патогенетическое лечение.
Методы обследования, необходимые для постановки обоснованного диагноза, описаны выше.
В ряде случаев – при инфекционно-воспалительных заболеваниях, варикоцеле, непроходимости семявыносящего тракта, гиперпролактинемии при опухолях гипофиза и др. – возможно этиотропное лечение. Однако эффективность лечения остается во многих случаях неопределенной [2, 7–9, 23]. Например, обзоры и мета-анализы, посвященные варикоцеле, констатируют улучшение лабораторных показателей спермы после варикоцелэктомиии в отсутствие достоверного увеличения числа беременностей [26–28]; данные по родам практически отсутствуют. По результатам специального мета-анализа, посвященного роли нарушений ДНК при варикоцеле, варикоцелэктомия уменьшает фрагментацию ДНК спермы в среднем всего на 3,4% (95% доверительный интервал [ДИ] – от -4,1 до -2,6) [29]. Несмотря на то что операция по Иваниссевичу характеризуется самой большой частотой рецидивов, а микрохирургическая из субингвинального доступа – самой маленькой [2], в отсутствие рецидива варикоцелэктомия независимо от хирургической техники обеспечивает схожие результаты: улучшение показателей спермограммы в 60–85% случаев, наступление спонтанных беременностей примерно в 30% наблюдений [26–28].
В качестве важных прогностических факторов восстановления фертильности после варикоцелэктомии, по нашему мнению, следует учитывать не только традиционные (возраст, объем яичек, степень олигозооспермии, стадию варикоцеле, уровень ФСГ и ингибина В), но и охарактеризованные выше – уровень ОС, фрагментацию ДНК, количество АСАТ [30].
Во многих случаях возможно патогенетическое лечение: при гипогонадотропном гипогонадизме, ОС, секреторной недостаточности дополнительных половых желез, сексуальной и эякуляторной дисфункции и др. [2, 7–9, 23].
Поскольку во многих случаях патогенез снижения фертильности мужчин не ясен (чаще из-за недостаточного объема обследования), применяют так называемую эмпирическую терапию (табл. 3).

Ни для одного из методов эмпирической терапии эффективность с точки зрения доказательной медицины не подтверждена [2, 7–9, 23]. Однако опыт показывает, что все эти препараты могут быть рекомендованы определенным группам пациентов, если удается понять реальный патогенез ухудшения качества спермы: например, антиоксиданты при ОС; антиэстрогены – при сниженном уровне гонадотропинов и нормальном содержании ингибина В; карнитины, фруктоза, лимонная кислота – при функциональной недостаточности придатка яичек, семенных пузырьков и простаты соответственно [4, 7–9, 31].
В ряде случаев этиопатогенетическое лечение невозможно: при врожденном отсутствии семявыносящего протока, после лечения онкологических заболеваний цитостатиками, при микроделеции в локусе AZFc и других генетических нарушениях, приводящих к гипосперматогенезу. В этом случае рекомендованы методы ВРТ, в первую очередь ИКСИ.
В ряде случаев: нечувствительность к андрогенам, микроделеции в локусах AZFa и b, другие генетические дефекты, приводящие к синдрому «только клетки Сертоли», – лечение невозможно и паре должны быть предложены альтернативные способы достижения социального отцовства: инсеминация донорской спермой и усыновление.
Поскольку лекарственная терапия должна быть достаточно длительной (не менее 3 мес с учетом продолжительности цикла сперматогенеза), важно иметь некие предварительные критерии будущей эффективности. В этом смысле клинически значимым считается выделение форм мужского бесплодия в зависимости от содержания в крови гонадотропинов: гипо- , нормо- и гипергонадотропной [2, 7–9, 23].
Гипогонадотропная форма (менее 10% случаев) – это нарушение регуляции сперматогенеза и/или андрогенпродуцирующей функции яичек из-за секреторной недостаточности гипоталамуса и/или гипофиза. При дефиците ФСГ сперматогенные клетки еще в яичке подвергаются пассивному апоптозу, и в сперме снижено количество сперматозоидов. В этом случае высокоэффективна заместительная терапия ГТ-РГ или гонадотропинами [2, 7–9, 23].
Гипергонадотропная форма (15–20% случаев) отражает недостаточность яичек вследствие генетических или приобретенных повреждений (орхит вирусной, хламидийной, туберкулезной или аутоиммунной этиологии, радиация, интоксикации). Прогностически это самая неблагоприятная форма мужского бесплодия: чем выше уровни гонадотропинов в крови, тем больше выражены нарушения функции яичек: склероз и гиалиноз канальцев, отсутствие клеток сперматогенеза, в эякуляте – азооспермия (редко олигозооспермия).
Нормогонадотропная форма снижения качества спермы – самая распространенная и полиэтиологичная форма мужского бесплодия. В ее основе лежат как врожденные, так и приобретенные нарушения рецепции гормонов, системы внутриклеточных вторичных мессенджеров, недостаточность дополнительных половых желез, воспаление и др. механизмы. Эффективность лечения данной формы определяется установлением патогенетического механизма снижения фертильности. Нормогонадотропная форма азооспермии с частотой до 20% является следствием непроходимости семявыносящего тракта – обструкции [2, 7–9, 23].
Продолжительность этиопатогенетического и симптоматического лечения не должна превышать 1–2 лет. В случаях когда этиопатогенетическое лечение оказалось неэффективным (или невозможно), используют симптоматическое лечение. Применительно к лечению мужского бесплодия – это методы ВРТ, в первую очередь ИКСИ. Отбор пациентов для оказания медицинской помощи с использованием ВРТ в России регламентируется Приказом МЗ РФ N 107н [32]. Эффективность ICSI в среднем по Европе – 30% беременностей и менее 20% родов после одного цикла [33].
III этап: третичная профилактика – снижение частоты осложнений симптоматического лечения.
Использование для ИКСИ сперматозоидов, не прошедших «сито» естественного отбора, вызывает обеспокоенность. Эксперты EAU отмечают [2]:
«…Дети, рожденные после оплодотворения по методу ИКСИ, подвержены более высокому риску хромосомных аберраций de novo (в 3 раза по сравнению с детьми, зачатыми естественным путем) и наследуемых структурных хромосомных аномалий. Экстракорпоральное оплодотворение сопряжено с повышенным риском сердечно-сосудистых, скелетно-мышечных, мочеполовых и желудочно-кишечных нарушений и детского церебрального паралича…» [34–36]. Остается неясным, связано ли это с процедурой ЭКО, или это характерно для больных, прибегающих к ЭКО, однако наиболее актуальный на сегодняшний день по-прежнему вопрос о возможных отдаленных последствиях ЭКО. Рассмотрение этих вопросов является предметом дальнейших исследований. Следует иметь в виду, что методы ВРТ – способ преодоления бесплодия, который не устраняет факторов, приводящих к привычному спонтанному аборту на ранних сроках, в том числе обусловленному плохим качеством сперматозоидов. Преимплантационный генетический скрининг не повышает при этом безопасность и эффективность ЭКО [37]. Использование методов ВРТ не исключает, а дополняет патогенетическое лечение, которое по возможности должно проводиться в процессе реализации всей программы ВРТ.
Заключение. Установление патогенеза нарушений мужской репродуктивной функции позволяет использовать возможности специфической терапии, повышать ее эффективность, снижать стоимость. Реализация предлагаемого алгоритма ведения мужчин из бездетных пар подразумевает совершенствование работы системы ЛПУ, создание специальных подразделений уроандрологического, гинекологического, клинико-лабораторного профиля, тесно взаимодействующих между собой, и их соответствующего оснащения. Необходима программа последипломного повышения квалификации урологов по андрологии для получения необходимых знаний, в том числе из смежных дисциплин: эндокринологии, дерматовенерологии, сексологии, гинекологии, эмбриологии, иммунологии, генетики. «Мужской фактор» следует рассматривать не только в качестве частой причины бесплодного брака, но и как фактор риска невынашивания беременности, т.е. вынужденно бездетного брака.



