Введение. Инцидентальный рак предстательной железы (РПЖ) – рак, выявленный непреднамеренно в ходе исследования гистологического материала после трансуретральной резекции (ТУР) доброкачественной гиперплазии предстательной железы (ДГПЖ). Частота выявления инцидентального РПЖ не превышает 10%, однако может сильно варьироваться в зависимости от опыта патоморфолога и особенностей морфологического исследования [1]. Тактика лечения подобных больных остается предметом активных дискуссий. Неизвестен объем оставшейся после ТУР ДГПЖ опухолевой ткани и степень риска прогрессирования ракового процесса.
По данным крупного европейского исследования, проведенного до внедрения в практику ПСА-скрининга, включившего 23 288 пациентов с инцидентальным РПЖ, специфическая 10-летняя смертность составила 26,6%. В исследовании нет данных о стадии процесса (Т1а, Т1b), степени дифференцировки опухоли, уровне простатспецифического антигена (ПСА) [2].
По данным B. Tombal [3], из 182 больных инцидентальным РПЖ лишь у 8% со стадией T1a продолжительность «безопухолевого» периода составила 73 месяца. У 29% РПЖ стадии T1b прогрессировал в среднем через 17 месяцев.
В другом исследовании [4] из 40 больных инцидентальным РПЖ (T1a – 16 больных, T1b – 24) прогрессирование не было зарегистрировано в группе T1a при среднем сроке наблюдения 90 месяцев. В группе больных со стадией T1b прогрессирование наблюдалось лишь у 12,5% пациентов со средней продолжительностью «безракового» периода 70 месяцев.
 Ведение больных инцидентальным РПЖ предполагает следующие варианты: активное наблюдение и выжидательную тактику, HI-FU-терапию [5], радикальную трансуретральную резекцию простаты [6], радикальную простатэктомию (РПЭ) [7]. Дистанционная лучевая терапия и брахитерапия не получили широкого распространения ввиду неудовлетворительных функциональных результатов и высокого уровня послеоперационных осложнений. Гормональная терапия не обладает преимуществами по сравнению с активным наблюдением и не может быть рекомендована пациентам с инцидентальным РПЖ [8].
Ведение больных инцидентальным РПЖ предполагает следующие варианты: активное наблюдение и выжидательную тактику, HI-FU-терапию [5], радикальную трансуретральную резекцию простаты [6], радикальную простатэктомию (РПЭ) [7]. Дистанционная лучевая терапия и брахитерапия не получили широкого распространения ввиду неудовлетворительных функциональных результатов и высокого уровня послеоперационных осложнений. Гормональная терапия не обладает преимуществами по сравнению с активным наблюдением и не может быть рекомендована пациентам с инцидентальным РПЖ [8].
Мнение о целесообразности РПЭ после ранее выполненной трансуретральной резекции простаты претерпевает определенные изменения. Еще 20 лет назад ТУР ДГПЖ в анамнезе у больного РПЖ являлся относительным противопоказанием к РПЭ. Изменения анатомии фасциальных пространств, трудности мобилизации простаты и семенных пузырьков, относительно высокий риск положительных хирургических краев, неудовлетворительные функциональные результаты стали предпосылкой к отказу от радикального хирургического лечения больных инцидентальным РПЖ [5, 9–12].
Тем не менее современные технические достижения в хирургии РПЖ, рост числа больных инцидентальным РПЖ, увеличение числа выполняемых РПЭ во всем мире заставляют с новых позиций оценить эту непростую группу больных и, возможно, изменить существующие позиции на менее категоричные.
Материалы и методы. Проведен ретроспективный анализ 1000 историй болезни больных РПЖ, подвергшихся РПЭ с 2010 по 2015 г. Отобраны 20 пациентов инцидентальным РПЖ, 12 из которых удалось вызвать и провести контрольное обследование. Эти больные составили 1-ю группу (ТУР+РПЭ). Клиническая стадия болезни определялась как Т1а-T1b N0-Х М0. Среднее время между ТУР ДГПЖ и РПЭ составило 15 недель (от 12 недель до года). Контрольную, 2-ю, группу составили 15 больных РПЖ с клинической стадией Т1с-T2 N0-Х М0, подвергшихся обычной позадилонной РПЭ (без трансуретральных операций в анамнезе). Предоперационное обследование предусматривало оценку жалоб, сбор анамнеза, физикальный осмотр (в том числе пальцевое ректальное исследование), клинико-лабораторные исследования (в том числе определение уровня ПСА общего свободного соотношения, свободного и общего ПСА), МРТ (рис. 1) и УЗИ (рис. 2), гистологический и иммуногистохимический (ИГХ) анализы биопсийного материала.
Возраст пациентов в 1-й группе колебался от 54 до 72 лет (средний возраст – 58,2±2,2 года), во 2-й группе – от 56 до 74 лет (средний возраст – 60,4±1,6 года). Объем предстательной железы, по данным трансректального УЗИ, в 1-й группе варьировался от 12 до 87 см³ (средний – 48,2±1,8 см³), во 2-й – от 44 до 80 см³ (средний –50,5±1,2 см³). Средний уровень ПСА в 1-й и 2-й группах составил 9,2 (от 6,8 до 16,2) и 10,4 (от 7,6 до 18,0) нг/мл соответственно.
Все операции выполнены под эндотрахеальным наркозом. В 1-й группе использовали позадилонный (n=11) и лапароскопический (n=1) доступы. Во 2-й группе все операции выполнены из позадилонного доступа. Все больные оперированы четырьмя опытными хирургами, выполнившими в течение года не менее 40 РПЭ.
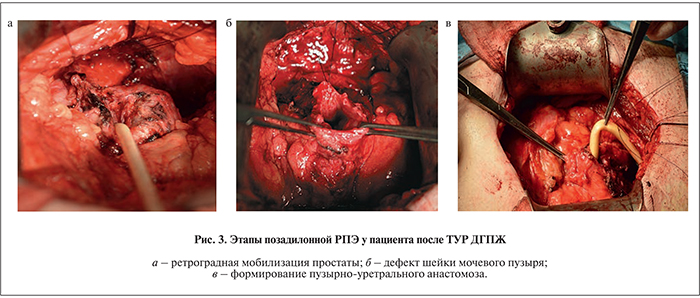
При позадилонном доступе пациент находился в положении Тренделенбурга (угол наклона стола 20° с приподнятым тазовым концом). Осуществляли продольный срединный разрез от лобкового симфиза до пупка. После перевязки и пересечения дорсального венозного комплекса пересекали уретру на границе с предстательной железой. Далее проводили стандартную ретроградную мобилизацию и удаление предстательной железы и семенных пузырьков с обязательным захватыванием в препарат листков фасции Денон–Вилье. Анастомоз формировали шестью нитями монокрил 3/0 (рис. 3).
При лапароскопической РПЭ использовали 5 портов с предварительной установкой структурного баллона для создания рабочего экстраперитонеального пространства. При помощи биполярного диссектора и ультразвукового скальпеля выделяли переднебоковые поверхности простаты. Далее прошивали элементы дорзального венозного комплекса. Простату с семенными пузырьками удаляли антеградно (рис. 4). Уретроцистоанастомоз формировали непрерывным монокриловым швом 3/0 с двумя иглами.
Результаты. Длительность операции в 1-й группе варьировалась от 155 до 250 мин (в среднем 210 мин), во 2-й группе – от 75 до 195 мин (в среднем 110 мин).
 Средний объем кровопотери (данные анестезиологических протоколов) составил 430 мл в группе ТУР ДГПЖ+РПЭ по сравнению с 240 мл во 2-й группе. Интраоперационная гемотрансфузия в объеме 500 мл крови потребовалась 1 (8,3%) больному из 1-й группы. Во 2-й группе гемотрансфузию не осуществляли. Нервосберегающая техника применена в отношении 3 пациентов группы ТУР ДГПЖ (односторонняя у 1 и двусторонняя у 2 пациентов) по сравнению с 9 пациентами 2-й группы (односторонняя у 3 и двусторонняя у 6 пациентов). Средние показатели дренирования малого таза, катетеризации мочевого пузыря и послеоперационный койко-день составили 5 и 3, 15 и 9, 16 и 10 в 1-й и 2-й группах соответ-ственно.
Средний объем кровопотери (данные анестезиологических протоколов) составил 430 мл в группе ТУР ДГПЖ+РПЭ по сравнению с 240 мл во 2-й группе. Интраоперационная гемотрансфузия в объеме 500 мл крови потребовалась 1 (8,3%) больному из 1-й группы. Во 2-й группе гемотрансфузию не осуществляли. Нервосберегающая техника применена в отношении 3 пациентов группы ТУР ДГПЖ (односторонняя у 1 и двусторонняя у 2 пациентов) по сравнению с 9 пациентами 2-й группы (односторонняя у 3 и двусторонняя у 6 пациентов). Средние показатели дренирования малого таза, катетеризации мочевого пузыря и послеоперационный койко-день составили 5 и 3, 15 и 9, 16 и 10 в 1-й и 2-й группах соответ-ственно.
Установлены значимые различия в частоте осложнений между группами. Наиболее частым осложнением являлась несостоятельность пузырно-уретрального анастомоза, требовавшая пролонгированной катетеризации, – 5 человек 1-й группы против 2 человек 2-й группы. Травма прямой кишки произошла у 1 мужчины 1-й группы вследствие склеротического процесса между простатой и передней стенкой прямой кишки (хирургический край отрицательный).
Послеоперационный показатель по шкале Глисон в обеих группах был сравнимым. У 1 пациента 1-й группы с дооперационным баллом Глисона 6 в исследованном послеоперационном гистологическом материале балл по шкале Глисон составил 8. Положительный хирургический край не выявлен ни у одного больного обеих групп. Биохимический рецидив в течение 6 месяцев был выявлен у 3 пациентов: 2 из 1-й группы и 1 из 2-й. В настоящий момент этим пациентам проводится гормональная терапия с эффектом — уровень ПСА составляет не более 0,2 нг/мл (срок наблюдения – 10 месяцев с момента выявления рецидива).
Все пациенты до операции удерживали мочу. Показатель удержания мочи через 3 месяца после операции был значительно выше во 2-й группе – 10 пациентов против 4 в 1-й группе.
Обсуждение. Относительная малочисленность больных РПЖ, которым выполнена ТУР ДГПЖ перед РПЭ, делает выполнение любого сравнительного статистически достоверного анализа довольно затруднительным. На наш взгляд, РПЭ у больных после удаления ДГПЖ может сопровождаться рядом особенностей, усложняющих оперативное пособие и повышающее хирургический риск.
Нечеткая дифференцировка слоев при отсечении базальных отделов простаты от мочевого пузыря, что чревато оставлением ткани простаты или ее гиперплазии; в дальнейшем проявляется повышением уровня ПСА, трактовка которого порой довольно затруднительна.
Для радикального удаления железы на этапе отсечения ее от шейки мочевого пузыря целесообразен антеградный подход. Его преимущества – радикальное удаление органа, контроль за устьями, риск повреждения которых после ТУР ДГПЖ выше (находятся в непосредственной близости от железы), возможность максимально сохранить шейку мочевого пузыря, что увеличивает шансы на удовлетворительную континенцию.
Апикальные фрагменты простаты плотно фиксированы к прямой кишке и мышцам тазового дна, что требует более каудального пересечения уретры во избежание оставления фрагментов апекса (риск рецидива рака). Вследствие этого также повышается риск инконтиненции.
Отсутствие дифференцировки между листками фасции Денон–Вилье, что повышает риск повреждения прямой кишки, особенно у больных со слабо выраженной жировой клетчаткой.
При выполнении нервосберегающих пособий больным, перенесшим в анамнезе ТУР ДГПЖ, следует иметь в виду интимное прилежание висцерального листка тазовой фасции к органу, что на ряде участков не позволяет производить ее интрафасциальное (интерфасциальное) удаление без повышенного риска оставления ткани простаты и рецидива рака.
При ранних (1–4 месяца после ТУР ДГПЖ) операциях отмечено наличие участков с незавершенной эпителизацией, что не позволяет производить удовлетворительную эверсию слизистой мочевого пузыря. Отмечено прорезывание лигатур. Это в свою очередь требует укрепления анастомоза и дефекта шейки мочевого пузыря за счет ушивания фасций и детрузора с остатками ректоуретральной мышцы.
Заключение. Проведенный нами анализ позволяет считать, что выполнение РПЭ после ранее перенесенной ТУР ДГПЖ вполне возможно. Тем не менее предшествующая трансуретральная операция может оказаться причиной ряда технических трудностей на этапе простатэктомии. Радикальная простатэкомия после ТУР ДГПЖ связана с удлинением времени операции, увеличением объема кровопотери, сложностью сохранения сосудисто-нервного пучка, более высоким риском несостоятельности анастомоза и худшими краткосрочными результатами удержания мочи по сравнению с пациентами без предшествующего удаления ДГПЖ. Пациенты должны быть информированы о потенциальном риске осложнений после выполнения РПЭ. Данное оперативное пособие должно выполняться опытным хирургом.



