Введение. Гиперактивный мочевой пузырь (ГМП) – заболевание, характеризующееся наличием ургентного (в сочетании и без ургентного недержания мочи) и учащенного мочеиспускания как в дневное, так и в ночное время. В большинстве случаев ГМП не представляет угрозы для жизни пациентов, но в значительной мере ухудшает качество их жизни. Так, например, по некоторым данным, уровень депрессии намного выше у пациентов с ГМП, чем у тех, кто данным заболеванием не страдает. При этом существует связь между тяжестью симптомов ургентного и учащенного мочеиспускания и степенью выраженности сниженного настроения [1].
Холинолитики являются медикаментозным средством выбора в лечении больных различными формами ГМП. Однако известно, что около 50% больных прекращают лечение холинолитиками по причине не только побочных эффектов, но и недостаточной эффективности [2]. Одним из способов повысить клиническую эффективность м-холиноблокаторов для больных ГМП является назначение увеличенной дозы препарата. Вот почему недавно официально одобрено использование удвоенной дозы солифенацина, а именно 10 мг, в качестве стартовой и стандартной. Установлено, что данная мера по увеличению дозы препарата оправданна, так как способствует улучшению результатов лечения и лишь в незначительной степени увеличивает частоту и выраженность побочных эффектов. Ряд исследований также подтверждает обоснованное назначение высоких доз троспия хлорида (90–120 мг) больным с нейрогенной детрузорной гиперактивностью. Клинические данные в этом случае подтверждены уродинамически [3]. Цель нашего исследования состояла в оценке эффективности и безопасности различных доз троспия хлорида в лечении больных идиопатическим ГМП.
Материалы и методы. В широкомасштабную наблюдательную программу «Ресурс» были включены 669 пациентов с идиопатическим ГМП – 359 женщин и 310 мужчин – из 34 регионов РФ. Средний возраст пациентов составил 55,4±0,5 года. Из исследования были исключены пациенты, для которых причиной ГМП стали неврологические заболевания (данные в отношении этих больных оценивали отдельно).
Критерии включения в исследование: не менее двух эпизодов ургентного недержания мочи в течение 3 дней, более 8 мочеиспусканий в сутки, продолжительность симптомов не менее 3 мес, максимальная скорость потока мочи более 14 мл/с, отсутствие остаточной мочи, а также бактериурии и лейкоцитурии. Гиперактивность мочевого пузыря определяли на основании результатов заполнения дневника мочеиспусканий, в котором фиксировали частоту мочеиспусканий, количество ургентных позывов и эпизодов ургентного недержания мочи за 72 ч. Оценку качества жизни осуществляли при помощи визуальной аналоговой шкалы (ВАШ), которая представляет собой нанесенную на лист бумаги горизонтальную линию длиной 100 мм. Левый конец линии соответствует состоянию больного, когда «имеющиеся симптомы ГМП крайне негативно влияют на качество жизни», а правый — когда «симптомов ГМП нет». Также всем больным выполняли УЗИ почек, мочевого пузыря с определением объема остаточной мочи.
Пациенты должны были прекратить прием других м-холиноблокаторов, включая троспия хлорид, не менее чем за 3 мес до начала исследования. На первом визите всем пациентам назначали троспия хлорид в стандартной дозе 45 мг/сут. Результаты лечения оценивали на четырех последующих визитах, имевших место через 3, 6, 9 и 12 нед. Помимо заполнения дневника мочеиспусканий, оценки качества жизни по ВАШ и проведения УЗИ на визитах пациентов подробно опрашивали с целью выявления возможных побочных эффектов. В зависимости от результатов обследования корректировали дозу препарата в сторону как ее снижения (при наличии побочных эффектов), так и увеличения (при недостаточном эффекте лечения). Перед началом исследования все больные подписывали информированное согласие. Статистический анализ полученных данных проводился с использованием критерия Стьюдента и пакета статистических программ Statistica 8.0.
Результаты. В ходе исследования уже на II визите все пациенты были разделены на три группы. Первая группа в количестве 299 человек сообщила о хорошей переносимости 45 мг препарата, а данные дневника мочеиспускания и ВАШ соответствовали достоверному улучшению симптомов ургентного учащенного мочеиспускания. Данная группа больных продолжила прием 45 мг троспия хлорида в сутки. Сто восемнадцать пациентов (вторая группа) предъявляли жалобы на наличие тех или иных побочных эффектов, связанных с приемом препарата, поэтому доза препарата им была снижена до 30 мг/сут. Остальные 252 больных (третья группа) сообщили о хорошей переносимости препарата при недостаточной клинической эффективности.
В связи с этим доза троспия хлорида для них была увеличена до 60 мг/сут.
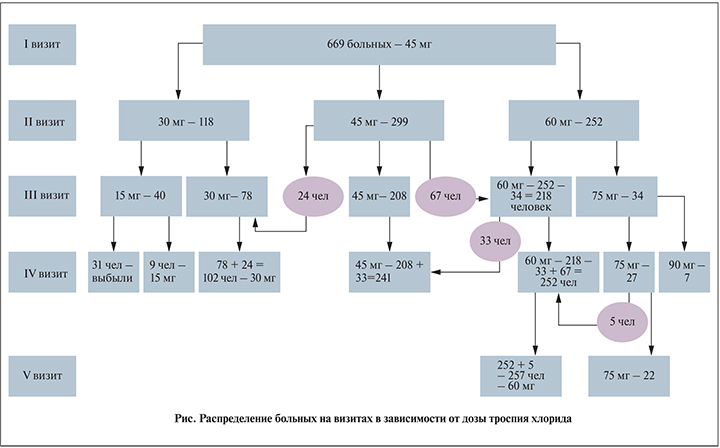
На III визите 34 больных третьей группы, принимавших 60 мг/сут, сообщили о том, что клиническая эффективность данной дозы все еще недостаточна для них, при этом они хорошо переносили прием холинолитика. Вот почему доза препарата им была увеличена до 75 мг/сут. Эти пациенты составили четвертую группу. В то же время 33 человека из группы, получавшей 60 мг/сут троспия хлорида, пожаловались на возникновение побочных эффектов, вызванных увеличением дозы препарата, поэтому им было предложено вновь вернуться к дозировке 45 мг/сут.
Также на III визите 67 пациентов из группы, принимавшей 45 мг, сообщили о том, что эффективность препарата недостаточна и они хотели бы улучшить результаты лечения. В связи с этим доза троспия хлорида этим пациентам была увеличена до 60 мг/сут. Другие же 24 пациента, напротив, сообщили, что при приеме 45 мг отмечали нежелательные явления, поэтому на III визите дозу препарата им снизили до 30 мг/сут.
Сорок пациентов из тех, которые на II визите начали принимать троспия хлорида в дозировке 30 мг/сут в связи с развитием нежелательных явлений, сообщили о сохранившихся побочных эффектах, несмотря на снижение дозы препараты. По этой причине им было предложено принимать 15 мг троспия хлорида в сутки.
На IV визите 31 пациент из тех, кто принимал 15 мг троспия хлорида, отметил сохранение нежелательных явлений, а также отсутствие какого-либо выраженного клинического эффекта в отношении симптомов ГМП, поэтому они выбыли из исследования досрочно. Остальные 9 больных продолжили прием препарата в дозировке 15 мг/сут.
Также на IV визите 5 из 34 пациентов, принимавших троспия хлорид в дозировке 75 мг/сут, отметили возникновение нежелательных явлений, поэтому они снова вернулись к приему 60 мг/сут. Однако 7 человек сообщили, что 75 мг/сут для устранения симптомов ургентного и учащенного мочеиспускания все еще недостаточно, поэтому им предложили принимать 90 мг холинолитика в сутки.
Таким образом, на V визите (принимая во внимание число больных, достаточных для статистического анализа и закончивших исследование) результаты лечения оценивали в четырех группах пациентов: у 102 больных, принимавших препарат в дозировке 30 мг/сут; у 241 – 45 мг/сут; у 257 – 60 мг/сут и у 22 – 75 мг/сут (см. рисунок).
В группе пациентов, получавших 30 мг препарата, среднее число эпизодов ургентного недержания мочи через 12 нед уменьшилось с 3,67±0,04 до 2,04±0,05 (р≤0,05), среднее количество актов мочеиспускания в сутки – с 14,21±0,7 до 12,01±0,5 (р≤0,05), а средний балл качества жизни по ВАШ вырос с 59,5±2,3 до 70,2±3,1 (р≤0,05).
В группе больных, принимавших 45 мг троспия хлорида в сутки, среднее количество эпизодов ургентного недержания через 12 нед приема препарата сократилось с 3,62±0,02 до 1,79±0,02 (р≤0,05); среднее число актов мочеиспускания в сутки – с 14,04±0,5 до 10,18±0,2 (р≤0,05). Показатель качества жизни по ВАШ до лечения составил 58,9±1,8, а через 12 нед – 75,6±2,9 (р≤0,05).
В третьей группе больные, которые получали троспия хлорид в дозировке 60 мг/сут, также констатировали достоверное улучшение всех параметров мочеиспускания и качества жизни. Так, среднее число эпизодов ургентного недержания мочи до лечения составляло 3,81±0,05, тогда как после лечения – 1,18±0,04 (р≤0,05). Среднее количество мочеиспусканий в сутки также уменьшилось с 14,16±0,2 до 10,03±0,3 (р≤0,05). Средний балл качества жизни до лечения равнялся 59,1±2,2, а после лечения – 77,0±2,5 (р≤0,05).

По результатам обследования пациентов, принимавших 75 мг троспия хлорида в сутки, отмечены следующие результаты. Среднее количество эпизодов недержания мочи уменьшилось с 3,9±0,1 до 1,3±0,09 (р≤0,05); среднее число мочеиспусканий в сутки составило 15,0±0,3 и 10,01±0,6 до и после лечения соответственно (р≤0,05); средний балл качества жизни – 57,9±2,7 и 78,9±2,5 соответственно (р≤0,05).
Таким образом, мы отметили статистически значимое улучшение всех клинических параметров во всех группах пациентов с идиопатической формой ГМП через 12 нед приема троспия хлорида (см. таблицу).
Примечательно, что при сравнении клинических показателей в группах, получавших разные дозы троспия хлорида (30, 45, 60 и 75 мг), мы не выявили статистически значимых различий (р> 0,05).
Известно, что применение м-холиноблокаторов ограничено различными побочными эффектами, связанными с их приемом. В данном исследовании также наблюдали нежелательные явления, которые заставляли врача и пациента либо снижать дозу препарата, либо вовсе отказываться от него и прекрашать участие в исследовании. Побочные эффекты различной степени выраженности отмечены у 180 больных, что составило 26,9%.
Основным побочным эффектом для всех больных являлось развитие сухости во рту. Данное осложнение наблюдали 87 (13%) пациентов. Нарушение опорожнения мочевого пузыря в виде появления остаточной мочи более 50 мл отметили 39 (5,8%) человек, нарушение опорожнения кишечника – 26 (3,9%), сухость кожных покровов – 18 (2,7%), нарушение сердечного ритма в виде тахикардии – 10 (1,5%). Из 31 (4,6%) пациента, который прекратил исследование ввиду выраженных побочных эффектов, 19 имели выраженную сухость во рту, 11 жаловались на нарушение опорожнения кишечника, 1 – на тахикардию.
Обсуждение. Гиперактивный мочевой пузырь – это широко распространенное заболевание среди мужчин и женщин любого возраста. Установлено, что в настоящее время около 11% населения США страдают ГМП [4]. Согласно подсчетам ученых, в Европейском Союзе к 2020 г. количество людей, страдающих данным заболеванием, превысит 25 млн [5].
Известно, что ГМП включает три основные формы: нейрогенную детрузорную гиперактивность, идиопатическую детрузорную гиперактивность и ГМП без детрузорной гиперактивности. Однако необходимо отметить, что ГМП – это клинический, а не уродинамический диагноз. Кроме этого зачастую довольно непросто разделить пациентов на тех, у кого симптомы ГМП обусловлены каким-либо неврологическим заболеванием, и тех, у кого клиническая картина заболевания имеет идиопатическую природу. При этом количество последних несколько превышает число больных нейрогенным ГМП и составляет 55 против 45% соответственно [6].
На сегодняшний день поиск эффективных методов лечения симптомов ургентного, учащенного мочеиспускания высокоактуален. Согласно данным Европейской ассоциации урологов, эффект применения м-холиноблокаторов больными идиопатическим ГМП нередко бывает кратковременным, а длительность приема во многом ограничена возникновением побочных эффектов [7]. Применение медленновысвобождающихся форм холинолитиков и накожной формы оксибутинина гидрохлорида (в виде пластыря) несколько снижает частоту побочных эффектов, но значимо не повышает эффективность лечения [8].
Средством лечения ГМП второй линии являются внутридетрузорные инъекции ботулинического токсина типа А. Данная методика высокоэффективна для пациентов с рефрактерными к лечению м-холинолитиками ГМП. Более 65% больных отмечают клиническое улучшение вплоть до полного исчезновения ургентности на протяжении 6 и более месяцев после лечения [9]. Однако данная методика инвазивная и в ряде случаев приводит к развитию инфекции нижних мочевыводящих путей, а также к нарушению функции опорожнения мочевого пузыря. Последнее обстоятельство заставляет пациентов прибегать к периодической самокатетеризации мочевого пузыря [7].
Не так давно в клиническую практику лечения идиопатической детрузорной гиперактивности был внедрен новый препарат, мирабегрон, относящийся к группе агонистов β3-адренорецепторов. Его эффективность, однако, не намного превышает таковую м-холиноблокаторов [10, 11].
Все эти обстоятельства обусловливают поиск новых и альтернативных средств или усовершенствование существующих способов лечения симптомов ургентного и учащенного мочеиспускания у больных ГМП.
В данном исследовании мы попытались оценить возможность применения высоких доз препарата троспия хлорид больными идиопатической формой ГМП.
Как известно, троспия хлорид является уникальным препаратом, который можно титровать в различных вариантах. Данная способность помогает «адаптировать» его для каждого пациента, выбрав оптимальный баланс между эффективностью и безопасностью. На сегодняшний день троспия хлорид является одним из самых безопасных м-холиноблокаторов. Это достигается за счет его высокой специфичности к м1- и м3-холинорецепторам мочевого пузыря. Он также оказывает ганглиоблокирующее и миотропное действия, подобно папаверину, не вызывает побочных эффектов со стороны нервной системы вследствие своей гидрофильности [12].
Важным обстоятельством является и то, что троспия хлорид в основном метаболизируется почками и на 80% выводится с мочой в неизменном виде, блокируя м-холинорецепторы мочевого пузыря [13–14].
В результате настоящего исследования выяснилось, что троспия хлорид является эффективным препаратом для лечения больных симптомами ургентного и учащенного мочеиспускания при ГМП. Согласно рекомендациям фирмы-производителя и инструкции к препарату, рекомендуемая доза троспия хлорида для лечения больных ГМП составляет 30 мг в сутки. Наши данные показывают, что нередко стандартной дозировки бывает недостаточно и в таком случае ее следует увеличивать, не опасаясь развития серьезных нежелательных явлений. Так, стандартную дозу 30 мг/сут предпочли 102 из 669 пациентов, что составило лишь 15,2%. Двести сорок один (36%) пациент выбрал дозу 45 мг/сут, 257 (38%) – 60, 22 (3,3%) – 75 и 7 (1,1%) – 90 мг/сут. Таким образом, вопрос о титровании дозы троспия хлорида должен решаться индивидуально в каждом конкретном случае, исходя из предполагаемой эффективности и безопасности препарата.
Одним из важных и интересных аспектов нашего исследования являлось сравнение эффективности лечения разными дозами троспия хлорида с точки зрения его влияния на симптомы ГМП и качество жизни больных. Не было выявлено прямой корреляции между увеличением дозы троспия хлорида и улучшением клинической симптоматики ГМП, т.е. достоверные различия полученных в разных группах результатов отсутствовали. Данное обстоятельство свидетельствует о том, что прямой связи между увеличением дозы троспия хлорида и повышением эффективности не существует. Иными словами, больные ГМП демонстрируют индивидуальную чувствительность к определенной дозе троспия хлорида. Некоторые больные отметят клиническое улучшение при использовании стандартной дозы 30 мг/сут, а другие – при использовании более высоких доз, включая 75 и 90 мг/сут.
Хорошо известен ряд побочных эффектов холинолитиков. Наиболее часто их прием сопровождается сухостью во рту и кожных покровов, нарушением опорожнения кишечника, головокружением и др. Как правило, появление и выраженность нежелательных явлений напрямую связаны с повышением дозы препарата [15, 16]. При этом степень выраженности последних во многом определяет саму возможность проведения лечения. Принимая во внимание тот факт, что мы использовали высокие дозы троспия хлорида, оценке его переносимости уделяли пристальное внимание. По нашим данным, оказалось, что снижение дозы троспия хлорида на разных визитах было необходимо 220 (32,8%) больным и выбыл из исследования 31 (4,6%) пациент.
Поэтому по результатам исследования можно сделать предположение об отсутствии прямо пропорциональной зависимости между увеличением дозы троспия хлорида и частотой встречаемости, а также степенью выраженности побочных эффектов. Это обстоятельство еще раз подчеркивает необходимость индивидуального подбора дозы троспия хлорида как одного из немногих титруемых холинолитиков. Такой подход требует много времени как от пациента, так и от врача, но в то же время открывает перед врачами новые возможности в лечении больных ГМП.
Таким образом, полученные результаты показывают, что индивидуальный подход к выбору дозы троспия хлорида для больных с идиопатической формой ГМП может являться эффективной и довольно безопасной мерой в достижении оптимального клинического результата с хорошим профилем безопасности.
Выражаем благодарность всем врачам, принявшим участие в исследовании «Ресурс».



