Введение. В настоящее время металлические эндопротезы рутинно используются в кардиоваскулярной и билиарной хирургии при восстановлении проходимости трахеи и пищевода [1–3]. В урологии нитиноловые стенты применяются при лечении больных стриктурой мочеточника и уретры, доброкачественной гиперплазией предстательной железы [4–8]. За последние два десятилетия в литературе увеличилось число публикаций о возможности хирургической коррекции сужений или облитераций мочеточника нитиноловыми эндопротезами. К частым показаниям к их использованию относятся опухолевые обструкции верхних мочевых путей (ВМП) [6, 8–10], рецидивные протяженные сужения мочеточника [6, 10, 11] или стриктуры мочеточниково-кишечных анастомозов [12, 13]. В отечественной литературе имеются единичные публикации об эндопротезировании мочеточника [14–17].
Результаты эндопротезирования пиелоуретерального сегмента (ПУС) нитиноловыми стентами изучены недостаточно. Мы обнаружили единственную работу [18], в которой в отношении четырех пациентов c рецидивной стриктурой ПУС использовали Wallstent. Этим больным ранее выполнялась открытая пиелопластика по Хайнс–Андерсену. Однако данное сообщение не позволяет установить показания к эндопротезированию ПУС, определить его технические особенности и оценить эффективность.
Цель: оценить эффективность восстановления проходимости ПУС нитиноловыми эндопротезами.
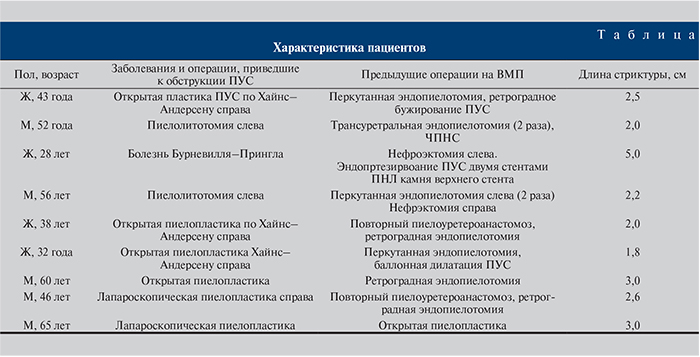
Материалы и методы. С 2003 по 2015 г. в нашей клинике эндопротезирование мочеточника выполнено 54 больным. Показанием к операции 34 больным были рецидивные стриктуры ВМП, 20 – опухолевые обструкции мочеточников. Мужчин было 30, женщин – 24, возраст их колебался от 28 до 75 лет. У 21 пациента были диагностированы протяженные сужения брюшного отдела мочеточника, у 8 – ПУС, у 4 – мочеточника пересаженной почки, у 1 – стриктура уретерокаликоанастомоза после операции Нейверта. Четырем больным ранее выполнялась пересадка трупной почки по поводу хронической почечной недостаточности (ХПН). Двум из них в связи с некрозом мочеточника-донора произведено анастомозирование собственного мочеточника с лоханкой пересаженной почки. Однако в обоих случаях отмечен рецидив стриктуры ПУС. У оставшихся двух пациентов было диагностировано сужение уретероцистанастомоза. Повторные реконструктивные и эндоскопические операции им также оказались безуспешными. Причиной стеноза мочеточника у 6 больных была опухоль прямой кишки, у 13 – рак шейки матки. Больной болезнью Бурневилля–Прингла металлический протез был установлен в ПУС единственной правой почки.
 Показания к эндопротезированию мочеточника: неэффективность пластических операций на ВМП и желание больных избавиться от наружных дренажей. Во всех случаях использовали нитиноловые стенты из никелида титана. Сорока пяти больным установлен отечественный эндопротез фирмы «МИТ», 9 дренирование ВМП осуществлено стентом Memokath. Пятидесяти трем больным проведено одностороннее эндопротезирование мочеточников, одному пациенту с болезнью Ормонда – двустороннее.
Показания к эндопротезированию мочеточника: неэффективность пластических операций на ВМП и желание больных избавиться от наружных дренажей. Во всех случаях использовали нитиноловые стенты из никелида титана. Сорока пяти больным установлен отечественный эндопротез фирмы «МИТ», 9 дренирование ВМП осуществлено стентом Memokath. Пятидесяти трем больным проведено одностороннее эндопротезирование мочеточников, одному пациенту с болезнью Ормонда – двустороннее.
Девяти (16,6%) из 54 больных (8 больных после реконструктивных операций на ПУС+1 больная туберозным склерозом) данное вмешательство проведено по поводу протяженных рецидивных стриктур ПУС. Женщин было 4, мужчин – 5, возраст колебался от 28 до 65 лет (см. таблицу). Восемь пациентов ранее перенесли различные хирургические вмешательства на ПУС, приведшие к его протяженной стриктуре, из них 2 – открытую пиелотомию, 6 – пиелопластику открытую (4) и лапароскопическую (2). Последующие открытые реконструктивные или эндоскопические вмешательства оказались неудачными, а прогрессирующее нарушение уродинамики ВМП привело к снижению функции почки. В этих случаях методом выбора служит эндопротезирование ПУС, позволяющее избавлять больных от наружных дренажей и восстанавливать адекватную проходимость ВМП. Больной болезнью Бурневилля–Прингла в ПУС единственной правой почки было установлено два металлических протеза.
Двум (22,2%) больным операция произведена антеградным путем, что было обусловлено наличием нефростомического дренажа, установленного в связи с обструктивным пиелонефритом. При данном доступе сначала выполнены нефроскопия и осмотр полостной системы почки. После этого через суженный участок провели струну, осуществили эндопиелотомию «холодным» ножом по задней или заднелатеральной поверхности ПУС и его бужирование до 14 Fr. Далее с помощью доставочного устройства установлен металлический эндопротез и выполнена антеградная пиелоуретерография. Если положение эндопротеза было правильным, удаляли его толкатель. Операция заканчивалась установкой нефростомического дренажа, который при хорошей проходимости ВМП, по данным антеградной пиелоуретерографии, удаляли. Семи (77,8%) больным эндопротезирование ПУС проведено ретроградным доступом. Вначале выполняли уретероскопию с эндопиелотомией «холодным» ножом и бужирование суженного ПУС. Затем с помощью доставочного устройства эндопротез устанавливали в зону ПУС, а адекватность положения оценивали с помощью рентгеноскопии. После эндопротезирования выполняли ретроградную уретеропиелографию, уточняли проходимость нитинолового стента. При эндопротезировании ПУС нужно подобрать металлический стент адекватной длины. Важным этапом данной операции является установка проксимального участка эндопротеза. Его верхний конец не должен значительно выходить в полость лоханки, что минимизирует риск камнеобразования, и упираться в шейки чашечек во избежание гематурии (рис. 1).
В послеоперационном периоде проведена антибактериальная терапия в течение 7–10 дней. На 2–4-е сутки пациентов выписали на амбулаторное лечение.
Результаты. Во всех случаях нитиноловый стент был адекватно установлен в зону сужения ПУС. Миграций эндопротеза не было. Гематурия наблюдалась у 1 пациента, купировалась на фоне гомеостатической терапии через 5 дней. Каждые 6 месяцев после операции пациентам выполняли лабораторные (креатинин и мочевина крови, клинический анализ и посев мочи) и инструментальные исследования (УЗИ почек, экскреторная или КТ-урография, динамическая сцинтиграфия), уточняли положение эндопротеза и функциональное состояние почки.
Результаты эндопротезирования оценивали по трехстепенной системе как хорошие, удовлетворительные и неудовлетворительные. Под хорошим результатом понимали состояние, когда пациент считал себя здоровым, не предъявлял жалоб, имел нормальные анализы мочи. Рентгенологически при этом констатировали полную проходимость мочеточника, сокращение расширенной полостной системы почки, хорошее состояние ее паренхимы по данным УЗИ и улучшение функции по данным динамической нефросцинтиграфии. Удовлетворительным считали результат в отсутствие жалоб больного, в сравнительном улучшении функции почки по данным урографии и нефросцинтиграфии, при этом определены умеренная лейкоцитурия и редкие обострения хронического пиелонефрита, отсутствие или незначительное сокращение размеров полостной системы почки. По данным УЗИ отмечено умеренное истончение паренхимы почки. При неудовлетворительном результате пациент отмечал наличие тупой боли в поясничной области, субфебрильной температуры; определены лейкоцитурия, иногда – позитивный посев мочи. На урограммах имело место значительное замедление контрастирования полостной системы почки, при УЗИ – выраженное расширение чашечек и лоханки почки, истончение ее паренхимы.
За период наблюдения от 8 до 60 мес (медиана – 32 мес) результат расценен как хороший для 6 (66,7%) пациентов, как удовлетворительный – для 2 (22,2%). Неудовлетворительный результат в отношении 1 (11,1%) пациента был связан с обструкцией эндопротеза пролиферативной тканью через 10 мес после операции. Выполнена уретероскопия с реканализацией нитинолового стента. У больной болезнью Бурневилля–Прингла спустя 16 мес после эндопротезирования ПУС наблюдалась обструкция мочеточника увеличивающимися ангиолипоматозными узлами, результат не был неудовлетворительным, в связи с чем ретроградно установлен второй нитиноловый стент. У той же больной в лоханочном конце проксимального эндопротеза образовался камень, по поводу чего проведена перкутанная нефролитотрипсия. У 1 пациента 65 лет, которому эндопротезирование проведено по поводу рецидивной стриктуры ПУС, камень нижней чашки мигрировал и вклинился в проксимальный конец нитинолового стента (рис. 2). Также выполнена чрескожная нефроскопия с удалением камня.
Приводим одно из клинических наблюдений успешного эндопротезирования ПУС больному с единственной почкой.
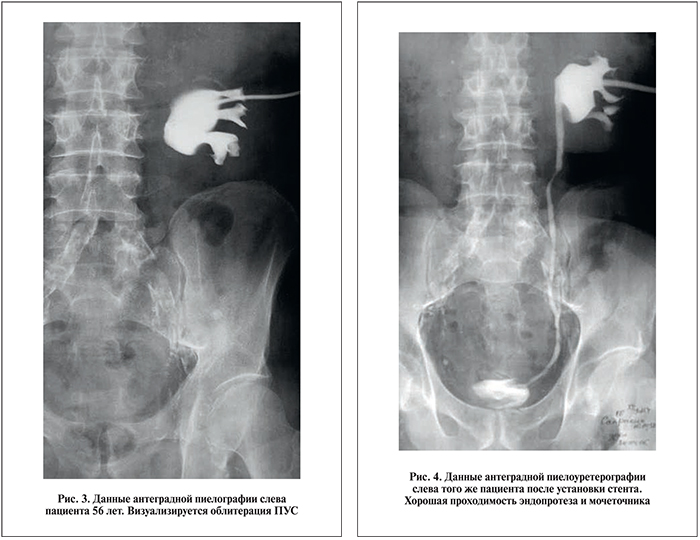
П а ц и е н т 56 лет госпитализирован в клинику урологии с диагнозом «протяженная стриктура ПУС единственной левой почки, нефростома слева, хронический пиелонефрит, латентная фаза, ХПН 2-й ст.». В анамнезе нефрэктомия справа в 1990 г. по поводу гнойного пиелонефрита. При обследовании в 2006 г. выявлен камень лоханки левой почки размером 2,5 см, повышение уровня креатинина до 576 мкмоль/л, мочевины до 28,5 ммоль/л. В связи с выраженной ХПН решено временно дренировать ВМП путем пункционной нефростомии. Была произведена чрескожная пункционная нефростомия, осложнившаяся кровотечением, тампонадой полостной системы почки и анурией. Поэтому выполнена люмботомия, пиелолитотомия, удаление сгустков крови и открытая пиелонефростомия. Состояние больного на фоне антибактериальной и инфузионной терапии стабилизировалось, и он с нефростомическим дренажом был выписан на амбулаторное лечение. В течение последующих лет неоднократно проводилась смена дренажа, несколько раз пациент в связи с обострением хронического пиелонефрита находился на стационарном лечении. Постоянное наличие нефростомического дренажа вызвало у пациента депрессивное состояние, он уволился с работы и оформил инвалидность. В дальнейшем с учетом негативного отношения пациента к нефростоме, относительной стабилизации явлений ХПН, отсутствия тяжелых соматических заболеваний было решено восстановить проходимость ПУС путем эндопротезирования. По данным антеградной пиелоуретерографии выявлена облитерация ПУС слева (рис. 3). Уровень креатинина в крови составил 180 мкмоль/л, мочевины – 10,4 ммоль/л. Выполнены трансуретральная уретероскопия, реканализация и бужирование зоны облитерации ПУС. Затем под рентгенологическим контролем ретроградно установлен нитиноловый стент. После операции выполнена антеградная пиелоуретерография: проходимость протеза и всего мочеточника хорошая, расширение чашечно-лоханочной системы умеренное (рис. 4). Нефростомический дренаж был удален. При контрольном обследовании спустя 14 мес общее состояние пациента стабильное, на ультрасонограмме умеренный гидронефроз; содержание креатинина в крови 160 мкмоль/л, мочевины – 9,8 ммоль/л. По данным контрольных обследований, сохранялось незначительное расширение чашечно-лоханочной системы, ХПН в динамике не нарастала.
Таким образом, эндопротезирование ПУС позволило восстановить проходимость мочеточника единственной почки и реабилитировать пациента.
Обсуждение. В настоящее время при лечении больных протяженными стриктурами мочеточника и уретры применяются металлические эндопротезы различных фирм-производителей. На этапе их внедрения в клиническую практику показаниями к использованию в основном были опухолевые обструкции ВМП [6–9]. F. Burgos и соавт. [7] выполнили эндопротезирование мочеточника 24 больным с протяженными сужениями ВМП. Причиной нарушения уродинамики ВМП у 11 из них были опухоли органов малого таза, у 13 – протяженные стриктуры различного генеза. Эффективность дренирования нитиноловыми стентами за период наблюдения от 3 до 60 мес составила 86,5% случаев. В работе [9] 73 пациентам установлено 86 эндопротезов. В 55 случаях причиной обструкции были рецидивные сужения мочеточника, в 31 – опухоли органов малого таза или забрюшинная лимфоаденопатия. За период наблюдения 17,1 мес функция 68 (79%) эндопротезов была удовлетворительной, у 6 человек наблюдалась инкрустация эндопротеза, у 12 – его миграция вниз по мочеточнику.
Нитиноловые стенты также активно применяются при лечении больных протяженными рецидивными стриктурами различных отделов мочеточника. Однако методика эндопротезирования ПУС и результаты подобных вмешательств недостаточно освещены в литературе. G. Barbalias и соавт. [18] эндопротезирование ПУС выполнили 4 больным, которым ранее была проведена открытая пиелопластика по Хайнс–Андерсену. В дальнейшем у них развилась стриктура пиелоуретероанастомоза протяженностью более 2,5 см. Всем пациентам антеградно установлен эндопротез длиной 4 см и диаметром 7 мм. Каждые 3 мес после операции выполнялись анализы крови и мочи, УЗИ почек, трехмерная мультиспиральная компьютерная томография с виртуальной уроскопией. В течение 16 мес никаких изменений отмечено не было. У одного больного сформировался камень в нижней чашке, который затем мигрировал и вклинился в дистальной части стента. Ему успешно выполнена дистанционная литотрипсия с отхождением всех фрагментов. В 1 случае через 2 мес диагностирован рецидив стриктуры ПУС вследствие прорастания металлического стента рубцовой тканью. Больной был повторно оперирован: эндопротез удален и установлен более длинный его аналог.
Эндопротезирование ПУС выполнено нами 9 больным, у 8 из которых были диагностированы рецидивные сужения ПУС. Повторные реконструктивные и эндоскопические операции были для них неэффективными. Использование нитиноловых стентов позволило восстановить проходимость ВМП и избавить больных от наружных дренажей. Данное вмешательство технически не является сложным, но требует соблюдения ряда условий. Во-первых, нужно подбирать оптимальные по диаметру и длине стенты. В клинической практике чаще применяются эндопротезы диаметром 4–6 мм. Что касается длины нитинолового стента, то предварительно с помощью компьютерной томографии следует точно определить протяженность суженного участка. Во-вторых, эндопротез должен быть на 1–2 см длиннее стриктуры мочеточника и после установки его концы должны располагаться выше и ниже зоны сужения на 0,5–1 см.
К недостаткам эндопротезирования мочеточника относятся развитие гиперплазии уротелия и инкрустация стента, приводящие к нарушению его проходимости. Для исключения этих осложнений некоторые авторы предлагают покрывать нитиноловые эндопротезы веществом с антипролиферативным действием или слоем политетрафлуороэтилена [8, 17, 19, 20]. Так, E. Liatsikos и соавт. [19, 20] провели экспериментальные исследования с использованием обычных нитиноловых стентов и эндопротезов, покрытых Pacliataxel-DES, обладающим антипролиферативным свойством. Отечественная компания «МИТ» производит нитиноловые стенты с покрытием из политетрафлюроэтилена, который исключает контакт мочи и уротелия с нитями эндопротеза.
В настоящее время разрабатываются съемные нитиноловые стенты для уретры и мочеточника. Результаты клинических испытаний этих эндопротезов позволят дать оценку их эффективности в лечении больных протяженными рецидивными и опухолевыми сужениями мочеточников.
Заключение. Эндопротезирование мочеточника является эффективным способом восстановления проходимости ПУС при его протяженных рецидивных стриктурах. Для нормальной функции эндопротеза и исключения послеоперационных осложнений необходимо использовать нитиноловые стенты адекватной длины. После установки его лоханочный конец не должен располагаться выше ПУС более чем на 0,5–1 см. Эндопротезирование мочеточника не является радикальным способом хирургической коррекции стриктуры ПУС. Однако после неоднократных реконструктивных и эндоскопических операций по восстановлению проходимости ПУС можно прибегнуть к данной операции, позволяющей избавлять больного от наружных дренажей и улучшать качество жизни.


