Введение. Обструктивный тип мочеиспускания в послеоперационном периоде радикальной простатэктомии является ведущим симптомом стеноза везикоуретрального анастомоза (ВУА). Помимо отрицательного влияния на здоровье пациента данное послеоперационное осложнение также является выраженным дезадаптирующим фактором, значительно снижающим качество жизни пациента.
В большинстве случаев стеноз ВУА проявляется ослаблением струи мочи, частым и болезненным мочеиспусканием, эпизодами острой задержки мочи.
В 2004 г. D. Besarani и соавт. [1] определили стеноз ВУА как узкий циркулярный рубец с точечным отверстием, располагающийся проксимальнее наружного сфинктера уретры. Несмотря на постоянное совершенствование техники наложения анастомоза в ходе радикальной простатэктомии (РПЭ) открытым и лапароскопическим (в том числе робот-ассистированным) доступом, частота развития послеоперационного стеноза ВУА по-прежнему остается высокой. По мнению Kampanga M. [2], у каждого пятого пациента, перенесшего РПЭ, имеется риск развития стеноза ВУА. Частота развития стеноза ВУА варьируется от 0,7 до 10,6% [3, 4].
Важным моментом, обеспечивающим сохранение высокого качества жизни пациентов после радикальной простатэктомии, является восстановление адекватного мочеиспускания. Единого подхода, направленного на лечение стеноза ВУА, не существует.
Эффективность предложенных методов коррекции разнится и основана лишь на небольших сериях наблюдений [5–7]. Важность стеноза ВУА обусловлена тем, что у ряда пациентов имеется тенденция к рецидивированию стеноза ВУА. В большинстве случаев при развитии стеноза ВУА пациенту может быть предложена эндоскопическая коррекция зоны ВУА или открытая операция, направленная на реконструкцию ВУА [8, 9].
Уретральный катетер является самым распространенным и востребованным устройством в стационаре. Его применение оправданно как в хирургических отделениях (после перенесенного оперативного лечения), так и в отделениях терапевтического профиля (в случае развития острой задержки мочи, у спинальных больных и т.д.). По мнению P. Tenke и соавт. [10], до 25% всех госпитализированных пациентов нуждаются по меньшей мере в однократной катетеризации, а спустя 3 дня нахождения уретрального катетера в полости мочевого пузыря в среднем у 10–25% пациентов в моче может быть высеяна бактериальная флора [11].
Катетер-ассоциированная инфекция мочевыводящих путей (КАИМП) является наиболее распространенной формой инфекции в стационаре и составляет до 40% от всех госпитальных инфекций [11]. Трудно оценить дополнительные расходы, связанные с развитием инфекций мочевыводящих путей (ИМП), на конкретно взятого пациента, однако доказано, что риск развития КАИМП добавляет по крайней мере один день к госпитализации [12].
В течение долгих лет авторами изучались различные варианты уретральных катетеров и материалы, из которых последние были изготовлены; в частности, оценивали влияние покрытия уретрального катетера на частоту бактериурии и симптоматической ИМП [13–15]. Тем не менее доказательств влияния того или иного вида уретрального катетера на частоту бактериальной колонизации и симптоматической ИМП недостаточно [10, 16].
Силикон является самым часто используемым инертным материалом для производства уретральных катетеров. Нанесение на поверхность уретрального катетера тонкого слоя из комбинации золота, палладия и серебра, по мнению ряда авторов, способно уменьшать адгезию бактерий и теоретически снижать частоту симптоматической ИМП [17]. По данным K. Stenzelius и соавт. [18], кратковременная катетеризация (периоперационное дренирование) мочевого пузыря уретральным катетером с покрытием из благородных металлов обеспечивает снижение частоты ИМП по сравнению с пациентами, которым был установлен стандартный силиконовый катетер.
Согласно D.G. Maki и Р.А. Tambyah [17], риск развития КАИМП с каждым днем увеличивается в среднем на 3–7%, а с учетом риска колонизации бактерий в последующем может приводить к развитию вторичной бактериемии. После установки уретрального катетера на его наружной и внутренней поверхностях формируется биопленка, повышающая адгезивную способность микроорганизмов и обусловливающая увеличение колонизации бактерий [19]. Применение антибактериальных препаратов, а также промывание мочевого пузыря и уретрального катетера растворами антисептических средств могут снижать уровень свободно циркулирующих бактерий, а значит, и риск развития КАИМП [20].
Лечение ИМП подразумевает проведение эффективной антибактериальной терапии при условии восстановления нормальной уродинамики и направлено на профилактику уросепсиса и возникновения рецидивов. Исключение составляют КАИМП, в большинстве случаев исчезающие после удаления катетера. Открытым остается вопрос о необходимости антибактериальной терапии пациентов с асимптоматической бактериурией. Большинство урологов считают, что лечение в подобных ситуациях не показано [21].
Поиск альтернативных методов, направленных на лечение пациентов со стенозом ВУА, а также на снижение частоты развития КАИМП, обусловлен высоким числом пациентов с данными патологиями [22]. В ходе нашего исследования была проведена оценка первичных результатов внедрения в клиническую практику двух новых моделей уретрального катетера, разработанных кафедрой урологии МГМСУ им. А. И. Евдокимова совместно с ФГБУ НЦАГиП им. академика В. И. Кулакова.
Цель исследования. На основании проведенного литературного поиска, а также ретроспективного анализа послеоперационных осложнений, возникающих после РПЭ и других хирургических вмешательств, сопровождающихся формированием ВУА, оценить эффективность внедрения в клиническую практику новых моделей уретрального катетера.
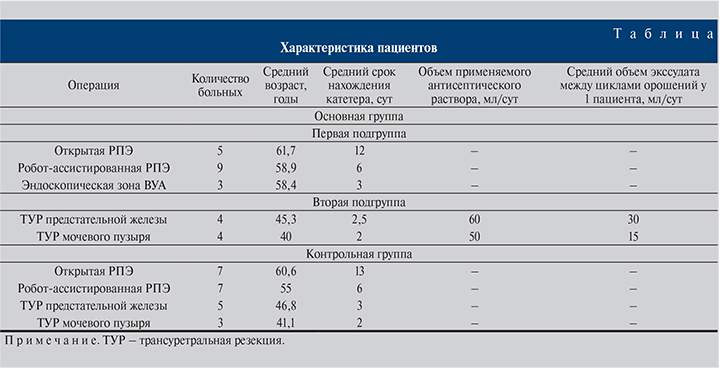
Материалы и методы. В исследование были включены 25 пациентов (основная группа), подписавших информированное согласие и проходивших лечение в клинике урологии МГМСУ им. А. И. Евдокимова (см. таблицу). В первую подгруппу больных были включены 14 пациентов, перенесших открытую (n=5) и робот-ассистированную (n=9) РПЭ, а также 3 пациента, которым после ранее перенесенной открытой (n=2) и робот-ассистированной (n=1) РПЭ выполнена эндоскопическая коррекция зоны ВУА. Всем пациентам по завершении операции мочевой пузырь был дренирован по уретре специально разработанным силиконовым уретральным катетером, предусматривающим возможность контролируемого наполнения дополнительного баллона, располагающегося в области ВУА (рис. 1). В послеоперационном периоде пациентам данной подгруппы проведено дилатирование ВУА: на протяжении всего периода нахождения уретрального катетера в полости мочевого пузыря (см. таблицу) дополнительный баллон наполняли 1,5–2,0 мл жидкости, после чего баллон спускали в зависимости от выраженности субъективных ощущений (в среднем через 4 мин). Процедуру повторяли 2–3 раза в день.
 Во вторую подгруппу (n=8) вошли пациенты, которым по завершении операции в объеме ТУР мочевого пузыря или предстательной железы мочевой пузырь был дренирован по уретре специально разработанным катетером, предусматривающим возможность орошения слизистой мочеиспускательного канала лекарственными препаратами в послеоперационном периоде (рис. 2). В качестве лекарственного препарата для орошения использовали 0,1%-ный водный раствор хлоргексидина биглюконата, являющийся местным антисептиком с преимущественно бактерицидным действием. Орошение проводилось не реже 2 раз в день (в среднем 3 раза) путем введения 10–20 мл антисептического раствора по специальному рабочему «каналу» уретрального катетера, после чего к рабочему «каналу» подсоединялся мочеприемник, а жидкость выходила через наружное отверстие мочеиспускательного канала в лоток для сбора жидкости. Бактериологический анализ полученного экссудата и мочи (после удаления уретрального катетера) в данном исследовании не проводился.
Во вторую подгруппу (n=8) вошли пациенты, которым по завершении операции в объеме ТУР мочевого пузыря или предстательной железы мочевой пузырь был дренирован по уретре специально разработанным катетером, предусматривающим возможность орошения слизистой мочеиспускательного канала лекарственными препаратами в послеоперационном периоде (рис. 2). В качестве лекарственного препарата для орошения использовали 0,1%-ный водный раствор хлоргексидина биглюконата, являющийся местным антисептиком с преимущественно бактерицидным действием. Орошение проводилось не реже 2 раз в день (в среднем 3 раза) путем введения 10–20 мл антисептического раствора по специальному рабочему «каналу» уретрального катетера, после чего к рабочему «каналу» подсоединялся мочеприемник, а жидкость выходила через наружное отверстие мочеиспускательного канала в лоток для сбора жидкости. Бактериологический анализ полученного экссудата и мочи (после удаления уретрального катетера) в данном исследовании не проводился.
В контрольной группе (n=22) мочевой пузырь после операции был дренирован стандартным двух- или трехходовым катетером Фолея № 18–22 Ch.
Субъективную оценку эффективности новой модели урологического катетера проводили посредством анкетирования с использованием опросника, включившего следующие вопросы:
- переносимость уретрального катетера (1 – хорошая/2 – плохая);
- подтекание мочи мимо катетера (1 – нет/2 – есть);
- ложные позывы (1 – отсутствуют/2 – имеются);
- дизурические явления после удаления катетера (1 – не выражены/2 – выражены).
Для расчетов описательной статистики использована программа Microsoft Exсel 2010, с помощью которой проведено объективное сравнение получаемых результатов и комплексная оценка достоверности различий в результатах.
Результаты. Анализ результатов использования новой модели урологического катетера показал, что средний период дренирования мочевого пузыря в основной и контрольной группах практически не различался (см. таблицу, р>0,05). В основной группе больных отмечена хорошая переносимость уретрального катетера, средний суммарный балл при заполнении опросника составил 3,6, в контрольной группе – 5,2 балла. После удаления уретрального катетера в обеих группах восстановлено самостоятельное мочеиспускание; объем остаточной мочи не превышал 20 мл (р>0,05). Частота дизурических явлений (малообъемное мочеиспускание, учащенное мочеиспускание, никтурия и др.) в первые сутки после удаления катетера была выше в контрольной группе (средний суммарный балл составил 6,1, тогда как в основной группе – 4,7 балла, р>0,05).
В позднем послеоперационном периоде (по прошествии 3, 6, 9 и 12 мес) при обследовании пациентов, перенесших РПЭ (первая подгруппа), максимальная скорость мочеиспускания, по данным урофлоуметрии, составила не менее 17 мл/с. Симптомов обструкции ни у одного из пациентов не выявлено.
Данный факт может трактоваться как результат дилатирования зоны ВУА и орошения слизистой уретры. Тем не менее полученные данные предварительные, а разница статистически недостоверна. Оценка эффективности предложенных новых моделей урологического катетера займет дополнительное время и потребует обследования большего числа пациентов.
Обсуждение. В зависимости от степени сужения просвета шейки мочевого пузыря и протяженности рубцового процесса пациентам со стенозом ВУА могут быть выполнены баллонная дилатация, эндоскопическая инцизия «холодным ножом», трансуретральная электрорезекция рубцовой ткани. Выбор метода коррекции стеноза ВУА должен основываться на жалобах, степени выраженности симптомов и индивидуальных анатомических особенностях.
В 2011 г. A. Vanni и соавт. [24] сообщили о выполнении трансуретральной инцизии зоны ВУА «холодным ножом» на 4, 8, 12 или на 3, 6, 9, 12 ч условного циферблата. В каждом случае разрез доходил до появления паравезикальной жировой клетчатки, а просвет шейки мочевого пузыря после инцизии составлял более 26 Fr. В каждом случае рассечение рубцовой ткани сопровождалось инъекцией в зону ВУА 0,3–0,4 мг митомицина С. Эффективность данного метода составила 72%.
Лазерную инцизию гольмиевым лазером стенозированного участка ВУА на 3 и 9 ч условного циферблата с последующей инъекцией в зону анастомоза триамцинолона описали в своем исследовании E. Eltahawy и соавт. [5]. В 83% случаев не было выявлено признаков рецидива стеноза ВУА. В 2015 г. H. Öztürk [6] сообщил об эффективном применении плазменной вапоризации в лечении рецидивов стеноза ВУА после баллонной дилатации анастомоза или эндоскопической инцизии анастомоза; при медиане наблюдения 24 мес эффективность составила 89,2%. В качестве альтернативного метода лечения стеноза ВУА была предложена брахитерапия с использованием зерен ирридия192, эффективность которой составила 60% [7].
На сегодняшний день имеются данные об успешном применении различных техник открытой реконструкции анастомоза у пациентов со стенозом или полной облитерацией ВУА. Однако в большинстве случаев после открытой реконструкции у пациентов развивается тотальное недержание мочи, что в последующем может потребовать имплантации искусственного мочевого сфинктера [25].
К наиболее частым возбудителям ИМП относятся Escherichia coli, Enterococcus species, Candida species, Pseudomonas aeruginosa и Klebsiella species. Среди эндогенных причин, приводящих к развитию КАИ, следует выделить наличие микроорганизмов, расположенных в области меатуса, ануса или влагалища.
К экзогенным причинам относят наличие патогенных микроорганизмов на медицинском оборудовании или руках медицинского персонала [26].
В 2012 г. R. Pickard и соавт. [27] были опубликованы данные многоцентрового рандомизированного контролируемого исследования, описавшего частоту развития КАИМП у пациентов (n=7102) при использовании латексного уретрального катетера, покрытого серебром (1-я группа), силиконового уретрального катетера, покрытого нитрофураном (2-я группа) и латексного уретрального катетера, покрытого политетрафторэтиленом (3-я группа, контрольная). Показано, что пациенты во всех трех группах не различались по длительности нахождения уретрального катетера. Также не было отмечено разницы в эффективности применяемых катетеров, их влияния на риск развития КАИМП и частоту развития симптоматической КАИМП.
Исследуя адгезивную способность E. coli при использовании уретральных катетеров, покрытых оксидом серебра и фурацилином, D. Desai и соавт. [28] пришли к выводу, что эффективность их применения достигается лишь в первые 5 дней, а снижение адгезии микроорганизмов к поверхности катетера не приводит к значимому уменьшению числа КАИ.
В работе R. Wang и соавт. [29] была изучена эффективность гликонаночастиц серебра. По мнению авторов, при необходимости длительного дренирования мочевого пузыря применение уретрального катетера с замедленным высвобождением серебряных наночастиц, нанесенных на стенку силиконового катетера в 1 или 2 слоя, способно противостоять инкрустации последнего в течение 12 и 45 дней соответственно.
Скорость развития КАИ во многом зависит от времени нахождения уретрального катетера. Так, было показано, что те пациенты, которым уретральный катетер был удален в срок до двух дней, имели более низкий риск развития ИМП по сравнению с теми пациентами, которым катетер был удален в более поздние сроки [30]. Краткосрочное дренирование мочевого пузыря уретральным катетером, импрегнированным оксидом серебра, также снижает скорость развития КАИМП [31]. В случае длительного дренирования мочевого пузыря (или длительной интермиттирующей катетеризации у «лежачих» пациентов) проблема развития КАИМП становится еще более актуальной. Проведенное открытое рандомизированное многоцентровое клиническое исследование [32] c участием 742 «лежачих» пациентов показало, что использование уретрального катетера с антисептическим покрытием сплава серебра в срок до 30 дней достоверно снижает риск развития КАИМП по сравнению с уретральным катетером без антисептического покрытия.
Заключение. Инфекции мочевыводящих путей являются одной из наиболее распространенных бактериальных инфекций, затрагивающих 150 млн человек каждый год по всему миру. Сохраняющийся, по мнению ряда авторов, высокий уровень рецидивов и повышение устойчивости к противомикробным препаратам предопределяют необходимость разработки и внедрения в клиническую практику альтернативных стратегий лечения и профилактики КАИМП.
На сегодняшний день в клинической практике не существует достаточного числа методов профилактики и лечения функциональных осложнений РПЭ [33]. Данная задача может быть решена путем применения новой модели уретрального катетера, препятствующего развитию сужения ВУА в раннем послеоперационном периоде у больных, перенесших РПЭ, а также в процессе лечения пациентов, перенесших оперативное лечение по поводу рака или аденомы предстательной железы, сопровождавшееся формированием ВУА.
Предварительные результаты оценки эффективности использования новых моделей уретральных катетеров показали хорошую их переносимость.
Работа выполнена при поддержке РНФ, соглашение № 16-15-00233.


