Введение. Тепловая ишемия почки является вынужденным техническим фрагментом лапароскопической резекции почечной ткани и используется в целях лимитирования потерь крови в процессе данного хирургического вмешательства [1, 2]. Кроме того, временное обескровливание оперируемой почки позволяет существенно оптимизировать визуальный контроль манипуляций, выполняемых при иссечении пораженного фрагмента и ушивании ренальной паренхимы [3–5]. Однако прямым следствием снижения кровенаполнения любого органа или ткани становится кислородная депривация с торможением функциональной активности клеток-эффекторов и высокой вероятностью их структурных нарушений. В частности, во время и после лапароскопической резекции ренальной ткани интраоперационная тепловая ишемия служит потенциальной причиной активации патогенетических механизмов дезорганизации экскреторной функции почки [6–9].
При обескровливании ренальной паренхимы объектом альтерации первого порядка становятся эндотелиоциты сосудистых стенок и клетки эпителия канальцев, функциональные и структурные нарушения которых в конечном итоге приводят к торможению процессов клубочковой фильтрации и канальцевой реабсорбции [10]. При этом максимально высокая чувствительность к недостатку кислорода отмечается у эпителиоцитов проксимальных канальцев по сравнению с таковой у других нефроцитов [11, 12].
Важнейшим фрагментом патогенеза ишемического повреждения эпителиоцитов проксимальных канальцев становится нарушение функций митохондрий с разобщением окислительного фосфорилирования и торможением образования АТФ [13–17]. Дефицит АТФ приводит к блокированию работы ионных насосов, нарушению внутри- и внеклеточного электролитного баланса, а также стимулирует развитие окислительного стресса и способствует реализации программы клеточной смерти [18, 19]. Нормализация уровня клеточного АТФ после ишемии и реперфузии возможна только при условии сохранности биологических мембран [20].
Наряду с собственно обескровливанием, вызывающим истощение пула АТФ в эпителии почечных канальцев, существенные повреждения морфофункциональной организации почки происходят и в момент восстановления органного кровотока (реперфузии). Основным механизмом реперфузионного повреждения является генерация свободно-радикальных соединений, к важнейшим из которых относятся активные формы кислорода (АФК): супероксидный анион-радикал О2- и его продукты – перекись водорода Н2О2, гидроксильный радикал ОН-, гипохлорит ClO-. В условиях опосредованного ишемией истощения ферментных систем аварийной нейтрализации АФК (Манухина Е. Б. и соавт., 2013) инициируется перекисное окисление липидов биологических мембран, повреждение белков и ДНК клеток канальцевого эпителия, а также эндотелия перитубулярных капилляров [21].
Таким образом, тепловая ишемия почки, а также последующая реперфузия служат фактором острой альтерации эпителиальных клеток почечных канальцев, что приводит к обнажению субэпителиального слоя, увеличению внутриканальцевого давления, снижению общего фильтрационного давления, скорости и объема фильтрации в клубочках [9].
Эффективность лечебных мероприятий, направленных на предупреждение и/или коррекцию нарушений структуры и функций канальцевых эпителиоцитов, зависит от учета особенностей и своевременной диагностики этих нарушений [22].
Целью настоящей работы явилось экспериментальное изучение ультраструктурных и биохимических признаков острого повреждения ренальной паренхимы после тепловой ишемии почки различной продолжительности и последующей реперфузии.

С учетом литературных сведений [23, 24], а также результатов собственных предшествовавших исследований [12] в данной работе анализ ультраструктурной организации ренальной паренхимы был сфокусирован на клеточной патологии эпителиоцитов проксимальных почечных канальцев в условиях ишемии-реперфузии.
Материалы и методы. Эксперименты выполнены на 44 конвенциональных кроликах-самках породы шиншилла массой тела 2,6–2,7 кг, полученных из питомника лабораторных животных РАМН «Рапполово» (Ленинградская обл.). Все особи перед отправкой из питомника подвергались 30-суточному карантину, во время которого образцы биологических жидкостей и тканей исследовались в государственной ветеринарной лаборатории. Непосредственно перед началом исследования животных повторно помещали на двухнедельный карантин в экспериментальном отделе СПбНИИФ.
Все кролики находились в стандартных условиях обитания и кормления, регламентированных Санитарными правилами по устройству, оборудованию и содержанию вивариев, утвержденными приказом № 51 от 29.08.2014, Правилами лабораторной практики (GLP) и приказом Минздрава России «Об утверждении Правил надлежащей лабораторной практики» № 199н от 01.04.2016. При работе с лабораторными животными руководствовались требованиями European Convention for the Protection of Vertebral Animals Used for Experimental and Other Scientific Purposes. CETS No. 123.
В исследование включали бессимптомных (здоровых) кроликов, присваивали им индивидуальные номера-метки, фиксировали массу тела и регистрировали данные в специальном журнале. Индивидуальный номер, а также сведения о названии исследования и принадлежности данной особи к той или иной опытной группе указывались на карточке, прикрепленной к каждой клетке.
Перед началом эксперимента методом рандомизации были сформированы 4 группы по 11 животных.
Первую контрольную группу составили ложнооперированные кролики.
Во второй, третьей и четвертой группах моделировали тепловую ишемию ренальной ткани. Для этого выполняли срединную лапаротомию, тупым и острым путем осуществляли доступ к почке, выделяли и скелетировали почечную ножку на всем протяжении. Затем на почечную артерию накладывали микрососудистый зажим. Длительность пережатия сосуда составила 30, 60 и 90 мин в группах № 2– 4 соответственно. После полного восстановления кровоснабжения почки, продолжавшегося 60 мин, а также контроля гемостаза, подсчета материала и инструментов, рану передней брюшной стенки ушивали отдельными узловыми викриловыми швами. Для профилактики микробного заражения интраоперационно внутримышечно вводили раствор бициллина-5 в дозе 1,5 млн ЕД/кг.
Анестезиологическое пособие включило изофлуран ингаляционно, миорелаксант рометар (ксилазин, «Биовет», Чехия) в виде 2%-ного раствора внутримышечно в объеме 1–1,5 мл. Операционную стадию наркоза контролировали с помощью изофлуран-кислородной смеси.
Для изучения влияния продолжительности тепловой ишемии на структурно-функциональное состояние оперированной почки выполняли электронно-микроскопическое исследование ренальной ткани, лабораторную индексацию количества в сыворотке крови и моче биохимических маркеров острого почечного повреждения (ОПП) и оценку клиренса креатинина.
Электронно-микроскопический анализ проводили в НИИ гриппа. Материалом исследования служили биоптаты почечной паренхимы, полученные во время хирургического вмешательства после 30-, 60- и 90-минутной тепловой ишемии и 60-минутной реперфузии.
Немедленно после выделения образцы фиксировали в 2,5%-ном растворе глутарового альдегида на 0,1 М фосфатном буфере в течение 1 ч при комнатной температуре, затем промывали в трех сменах фосфатного буфера. Далее выполняли постфиксацию материала в 1%-ном растворе тетроксида осмия на том же буфере, при той же температуре в течение 1 ч. После фиксации объекты были обезвожены в серии растворов этанола возрастающей концентрации (30%, 50, 70, 96, 100%), пропитаны ацетоном и заключены в эпоксидную смолу Эпон.
Ультратонкие срезы толщиной 50–70 нм, выполненные на ультрамикротоме Leica UC7, были собраны на медные сетки для электронной микроскопии и отконтрастированы в спиртовом растворе уранил-ацетата и водном растворе цитрата свинца. Электронно-микроскопическое исследование срезов проведено на микроскопе JEOL JEM 1011. Цифровые электронные микрофотографии были получены с использованием камеры Morada (Digital Imaging Solutions Inc.).
Концентрацию в крови и моче биохимических маркеров ОПП, а также клиренс креатинина определяли исходно, на 1-е, 5, 7, 14, 21 и 35-е сутки послеоперационного периода. Мочу собирали через катетер. Анализ проводили в образцах сыворотки крови и суточной мочи после перемешивания, для расчета использовали трипликаты образцов.
Для индексации маркеров ОПП применяли технологию иммуноферментного анализа. Использовали стандартные тест-системы, с помощью которых определяли количество в сыворотке крови и моче нейтрофильного желатиназоассоциированного липокалина (NGAL, липокалин-2; Lipocalin-2/NGAL ELISA, RD191102200R), цистатина С (Cystatin C ELISA, RD191009100); в моче – молекул повреждения почек-1 (KIM-1, «BCM Diagnostics», США), белка, связывающего жирные кислоты (L-FABP, «HycultBiotechnology», Нидерланды), и интерлейкина-18 (ИЛ-18, «BenderMed-Systems», США).
Клиренс креатинина рассчитывали по содержанию данного вещества в крови и моче и величине суточного диуреза. Креатинин определяли энзиматическим PAP-методом по конечной точке с использованием наборов Креатинин-ПАП-Ново (100) (ЗАО «ВЕКТОР-БЕСТ», Россия) на автоматическом биохимическом анализаторе KeyLab Automatic Analyzer («BPC+BioSed», Италия). Валидность методики и получаемых результатов проверяли путем внутреннего контроля качества лаборатории безопасности лекарственных средств в НИИ гриппа по контрольному материалу HUM ASY CONTROL 2/3 («RANDO», Великобритания). Содержание креатинина выражали в ммоль/л. Величину суточного диуреза (мл) делили на количество часов сбора мочи, минутный диурез выражали в мл/мин. Расчет клиренса креатинина проводили по формуле:
ClCr=(UCr×D)/SCr,
где UCr – концентрация креатинина в моче, ммоль/л; D – минутный диурез, мл/мин; SCr – концентрация креатинина в сыворотке крови, ммоль/л.
Все данные, полученные в ходе выполнения исследования, были занесены в рабочие протоколы и в книги программы Microsoft Excel. Проверку на нормальность распределения значений в группах определяли тестом Шапиро–Уилка. В случае ненормального распределения показателей для сравнения использовали непараметрические критерии Краскела–Уоллиса и Манна–Уитни. При нормальном распределении выборок сравнение проводили с помощью дисперсионного анализа (ANOVA) и теста Даннета. Критический уровень значимости был принят равным 0,05. Для проведения статистических тестов использовали программу GraphPadPrism 7.00.
Результаты. 30-минутная тепловая ишемия почки с последующей 60-минутной реперфузией вызвала ряд изменений ультраструктуры клеток проксимального канальца, прежде всего набухание микроворсинок щеточной каймы (рис. 1). Набухшие микроворсинки щеточной каймы имели диаметр 90–110 нм (в норме 60–70 нм) и выглядели электронно-прозрачными на поперечных ультратонких срезах (рис. 1, б). Кроме того, часто наблюдалось слияние мембран микроворсинок друг с другом с формированием сложных лабиринтообразных мембранных структур и инвагинаций данных структур в цитоплазму эпителиальных клеток (рис. 1, в). Набухание щеточной каймы служило прямым следствием ишемии. Оно отражало нарушения трансмембранного осмотического равновесия, связанные с истощением пула АТФ и дисфункцией систем активного ионного транспорта, прежде всего Na+-K+-АТФазы. Вместе с тем структурная перестройка микроворсинок с появлением клубкообразных мембранных лабиринтов и погружением данных образований в апикальную цитоплазму эпителиоцитов происходила именно в условиях ишемии-реперфузии. Мы не наблюдали подобных изменений морфологии щеточной каймы в ранее выполненном исследовании ультраструктуры почки при ишемическом стрессе (без реперфузии) [18].
Вторым выраженным изменением структуры клеток проксимального канальца наряду с деструктивной реорганизацией щеточной каймы стало появление электронно-прозрачных вакуолей различного размера (0,4–3 мкм) в их цитоплазме (рис. 1, а, г). Вакуолизация цитоплазмы, т.е. включение в вакуоли излишков поступившей в клетку воды, очевидно, являлась средством борьбы с осмотическим шоком и была направлена на поддержание целостности плазматической мембраны и выживание клетки.
Необходимо отметить, что, несмотря на перечисленные выше морфологические изменения, эпителий проксимального канальца сохранял жизнеспособность через 30 мин тепловой ишемии и 60 мин реперфузии. В частности, сохранялась целостность эпителиального слоя, поддерживалась нормальная организация межклеточных плотных контактов (рис. 1, а), хроматина (рис. 1, г) и митохондрий (рис. 1, д).
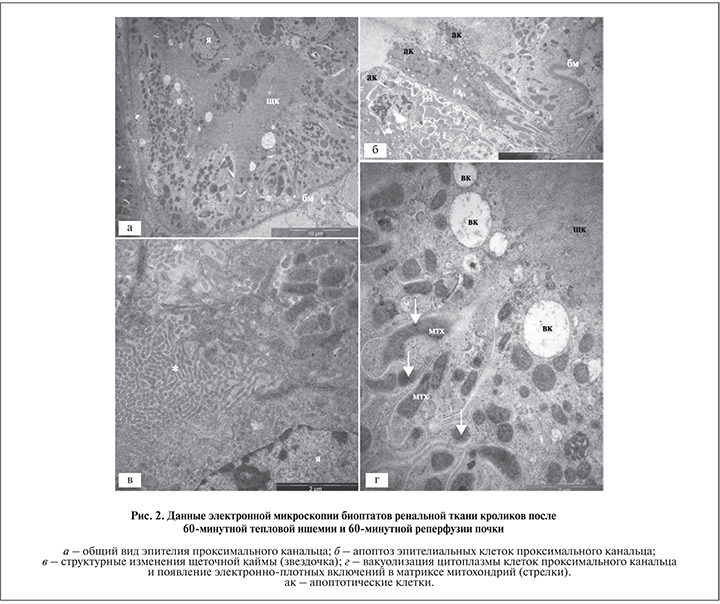
Через 60 мин ишемии и 60 мин реперфузии в эпителии проксимального канальца прослеживались более глубокие деструктивные изменения клеточной организации по сравнению с таковыми после 30-минутного обескровливания и 60-минутной реперфузии. В образцах почечной ткани животных этой группы, как правило, сохранялась целостность эпителиального слоя (рис, 2, а), однако в некоторых эпителиоцитах обнаруживались явные морфологические признаки апоптотической гибели – конденсация хроматина, высокая электронная плотность цитоплазмы, фрагментация цитоплазмы с формированием апоптозных телец размером 1–3 мкм (рис. 2, б).
Так же как и во второй группе, наблюдалось слияние мембран микроворсинок щеточной каймы, образование лабиринтообразных мембранных агрегатов (рис. 2, в), вакуолизация цитоплазмы эпителиальных клеток (рис. 2, г). Дополнительно прослеживалось повышение электронной плотности матрикса митохондрий и появление в нем небольших (50–200 нм) электронно-плотных включений (рис. 2, г).
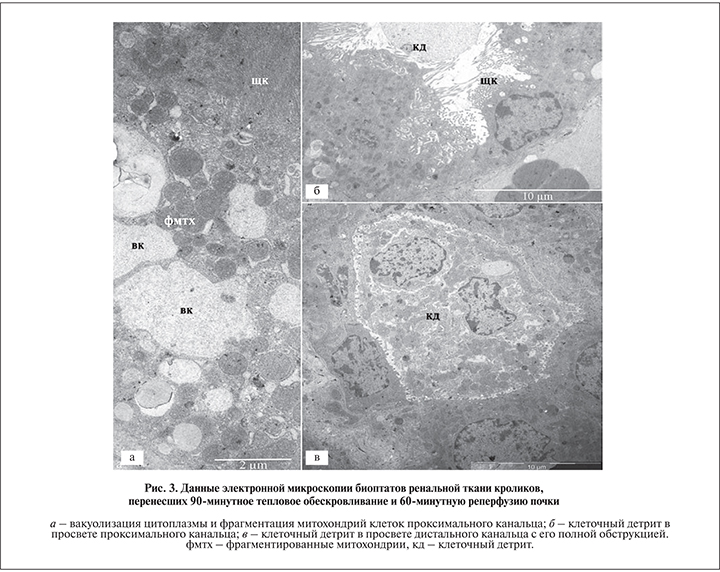
После 90 мин ишемии и 60 мин реперфузии цитопатологические изменения эпителия проксимального канальца усиливались. Помимо упомянутых выше признаков деструкции щеточной каймы и вакуолизации цитоплазмы выявлялась реорганизация митохондрий эпителиальных клеток с их фрагментацией на многочисленные округлые структуры диаметром 0,5–1,0 мкм (рис. 3, а). Было отмечено появление компонентов клеточного детрита в просвете почечных канальцев, как проксимальных (рис. 3, б), так и дистальных, нередко с полной обструкцией просвета (рис. 3, в). Эти данные свидетельствовали о продолжении массовой клеточной гибели канальцевого эпителия, первые признаки которой обнаруживались через 60 мин тепловой ишемии и 60 мин реперфузии.
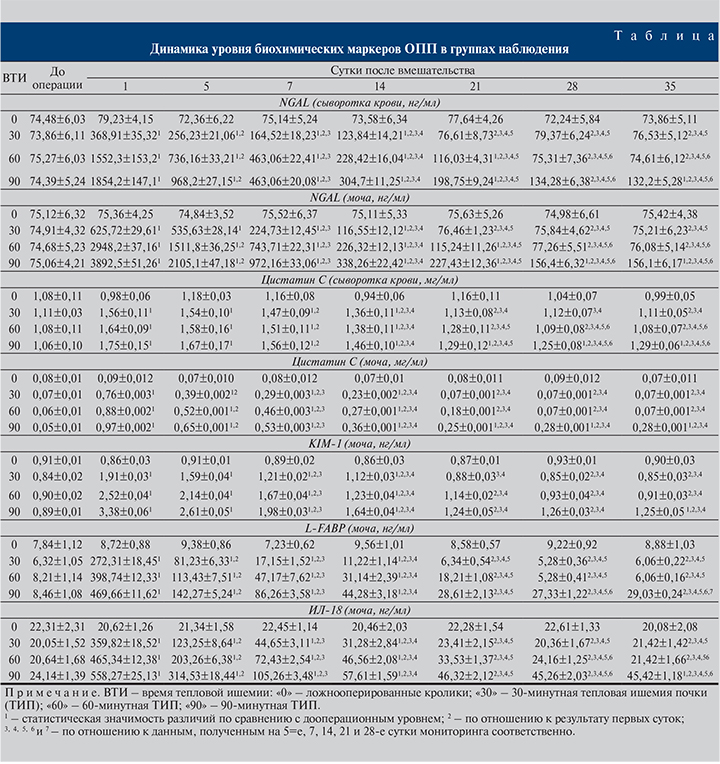
Динамика содержания в сыворотке крови и/или в моче NGAL, цистатина С, KIM-1, L-FABP и ИЛ-18 у животных, перенесших экспериментальное тепловое обескровливание почки, показана в таблице.
Количество сывороточного NGAL в первые сутки после экспериментального теплового обескровливания ренальной ткани резко и статистически значимо повышалось у всех без исключения животных, степень выраженности отмеченного нарушения зависела от длительности гипоксически-реоксигенационного воздействия. Например, после 90-минутной ишемии концентрация данного соединения в сыворотке увеличилась в 25 раз по сравнению с дооперационной, после 60- и 30-минутной – в 20 и в 5 раз соответственно. Далее отмечено постепенное снижение уровня NGAL. Возвращение к исходным значениям во второй группе произошло к 21-м суткам, в третьей группе – на 1 нед. позже. В четвертой группе к концу периода наблюдения количество NGAL оставалось достоверно выше такового у интактных животных (см. таблицу).
Концентрация NGAL возрастала не только в сыворотке крови, но и в моче. Общие закономерности изменения концентрации мочевого и сывороточного NGAL были в целом схожими: после первоначального быстрого и выраженного подъема показателя к концу первой послеоперационной недели появлялись признаки тенденции к восстановлению, которое происходило тем раньше, чем меньше времени была обескровлена почка. В четвертой группе нормализации уровня NGAL в моче не произошло (см. таблицу).
Содержание цистатина С в сыворотке крови кроликов групп № 2, 3 и 4 было также статистически значимо увеличено в течение 3, 4 и 5 нед. после экспериментального 30-, 60- и 90-минутного интраоперационного обескровливания соответственно. Максимальные сывороточные концентрации этого соединения индексировались на первые и пятые сутки после вмешательства, когда уровень цистатина С превышал результаты измерений до начала эксперимента у интактных особей второй, третьей и четвертой групп в 1,4; 1,5 и 1,7 раза соответственно.
Интраоперационная гипоксия, 60- и 60-минутная реоксигенация приводили также к увеличению уровня цистатина С в моче животных, при этом выраженность и длительность нарушений находились в прямой зависимости от времени тепловой ишемии. Полное восстановление показателей было отмечено у всех кроликов второй и третьей групп соответственно на 21-й и 28-й день курации и отсутствовало в 4-й группе (см. таблицу).
Уровень KIM-1 в моче в первые 24 ч после тепловой ишемии и последующей реперфузии был статистически значимо повышен по сравнению с предоперационным значением в 2,3 раза во второй группе, в 2,8 – в третьей и в 3,8 раза – в четвертой группах. В дальнейшем во всех группах наблюдалось постепенное снижение показателя, но нормализация имела место только у кроликов второй и третьей групп. У животных четвертой группы содержание KIM-1 к концу эксперимента оставалось повышенным (см. таблицу).
Количество L-FABP в моче в первые сутки после 30-минутной ишемии и реперфузии было увеличено в 40 раз, а в сериях с обескровливанием в течение 60 и 90 мин – в 50 и 55 раз соответственно. В дальнейшем показатель снижался. Сначала до конца первой недели это происходило быстро, стремительно, затем замедлялось. Для нормализации уровня мочевого L-FABP потребовалось не менее 3 нед. после 30-минутного ограничения поступления крови, не менее 4 нед. после 60-минутной ишемии. В четвертой группе уровень L-FABP не вернулся к исходным значениям (см. таблицу).
Во всех группах после гипоксически-реоксигенационного воздействия изменение уровня ИЛ-18 в моче отличалось характерным пикообразным повышением концентрации на первые сутки мониторинга и последующим ее снижением. Результаты измерений данного аналита утрачивали статистически значимые отличия от таковых у здоровых животных на 21-е сутки после операции во второй группе и на 28-е – в третьей. В четвертой группе содержание ИЛ-18 в моче оставалось повышенным (см. таблицу).
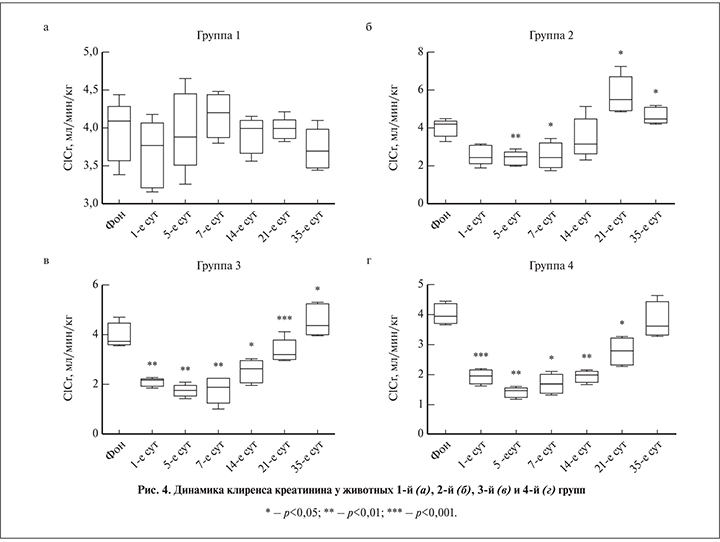
Оценка функционального состояния по величине клиренса креатинина выявила признаки временного нарушения фильтрационной способности почек, выраженность которых зависела от характера вмешательства (рис. 4).
У ложнооперированных животных первой группы клиренс креатинина незначительно уменьшался только в первые 5–7 сут. после операции, что, вероятно, было связано с хирургическими манипуляциями как таковыми и ближайшими эффектами анестезии. При этом абсолютная величина показателя всегда оставалась выше 3,6 мл/мин. Статистически значимых различий показателей на всех сроках наблюдения выявлено не было (рис. 4, а).
У кроликов второй группы, перенесших 30-минутную тепловую ишемию и 60-минутную реперфузию, динамика клиренса креатинина имела s-образную форму с экстремумами на 1-й неделе после операции и на 21-е сутки мониторинга: в течение первых 7 дней показатель был статистически значимо снижен в 1,5–2,0 раза по отношению к фоновому значению, в конце 3-й недели имели место признаки гиперфильтрации. При этом абсолютное значение клиренса креатинина не снижалось менее 2 мл/мин в течение всего периода наблюдения (рис. 4, б).
У животных третьей группы после 60-минутного обескровливания и 60-минутной реперфузии отмечено более глубокое торможение клубочковой фильтрации с уменьшением клиренса креатинина менее 2 мл/мин на 5-е и 7-е сутки после вмешательства. Тенденция к восстановлению фильтрационной способности почек впервые отмечена в конце 2-й недели (рис. 4, в).
Максимально выраженное снижение клиренса креатинина отмечено в четвертой группе, где длительность тепловой ишемии и реперфузии составила 90 и 60 мин соответственно. Абсолютное значение показателя на 5-е сутки после операции было равно в среднем 1,5 мл/мин, на 7-е – не превышало 2 мл/мин. Один кролик погиб на 6-й день в результате эндогенной интоксикации. Фоновое значение клиренса креатинина составило 4,39 мл/мин, на 1-е и 5-е сутки – 1,38 и 1,12 мл/мин соответственно. Нормализация фильтрационной способности почек у оставшихся животных произошла только на 35-е сутки запланированного периода наблюдения (рис. 4, г).
Обсуждение полученных результатов. Интраоперационное тепловое обескровливание почки, применяемое при лапароскопической резекции пораженного участка ренальной паренхимы с целью минимизации потерь крови в процессе вмешательства, одновременно может стать запускающим фрагментом патогенеза острого почечного повреждения (ОПП) и связанного с этим снижения экскреторной функции почек [25]. Продолжительность тепловой ишемии является одним их важнейшим факторов, определяющих выраженность и объем нарушений, их обратимость или летальность, а также прогноз восстановления функциональной состоятельности почки.
В многочисленных исследованиях показано, что интраоперационное обескровливание почки, по длительности не превышающее 30 мин, способно вызывать только обратимые изменения структуры и функций ренальной ткани. Если же поступление крови к почке остановлено более чем на 60 мин, возникает летальная альтерация клеток-эффекторов нефрона [26, 27]. Однако в настоящее время отсутствует единое мнение исследователей о степени опасности тепловой ишемии с длительностью от 30 до 60 мин [28, 29].
В нашей работе были изучены в сравнении структурно-функциональные особенности ренальной ткани кроликов, перенесших экспериментальную тепловую ишемию почки в течение 30, 60 и 90 мин и последующую 60-минутную реперфузию.
Согласно результатам электронно-микроскопического исследования, интраоперационное обескровливание вызвало ряд ультраструктурных нарушений со стороны клеток эпителия клубочково-канальциевой системы, степень и масштабы которых коррелировали с продолжительностью окклюзии почечной артерии. Наибольшая чувствительность к повреждающему действию гипоксии и последующей реоксигенации отмечена у эпителиоцитов проксимальных канальцев.
Тридцатиминутное тепловое обескровливание и 60-минутная реперфузия вызывали обратимые изменения в эпителиоцитах проксимальных канальцев в виде набухания щеточной каймы, вакуолизации цитоплазмы, причудливых изменений конфигурации микроворсин, причем последний признак стал следствием именно реперфузии. При удлинении времени ишемии до 60 мин выраженность отмеченных ранее нарушений увеличивалась. Жизнеспособность клеток эпителия проксимальных канальцев в условиях 30- или 60-минутного обескровливания сохранялась. Эти результаты согласуются с ранее опубликованными сообщениями о микроморфологических проявлениях последствий тепловой ишемии и реперфузии ренальной ткани [30, 31].
Электронно-микроскопические признаки летальной альтерации и массовой гибели эпителиоцитов проксимальных канальцев выявлены после уменьшения кровенаполнения органа, длившегося не менее 90 мин.
Одним из последствий теплового обескровливания и последующей реперфузии стало изменение в крови и/или в моче подопытных животных уровня содержания биохимических маркеров ОПП – NGAL, цистатина-С, KIM-1, L-FABP, интерлейкина-18. В целом постоперационная динамика количества каждого из этих аналитов имела в своей основе единую схему: после резкого выраженного подъема на первые сутки сывороточная или мочевая концентрация индексируемого соединения начинала уменьшаться. Снижение показателя до конца первой послеоперационной недели происходило быстро, затем замедлялось, становилось постепенным. Затем в сериях с 30- и 60-минутной ишемией количество в сыворотке крови или в моче изучаемых биомаркеров восстанавливалось до исходного. Это происходило тем раньше, чем менее продолжительным было время обескровливания. После тепловой ишемии в течение 90 мин значения показателей оставались повышенными даже в конце периода наблюдения. Также следует отметить, что на каждом этапе мониторинга концентрация измеряемого аналита была минимальной при 30-минутном обескровливании, максимальной – при 90-минутном.
Результаты, полученные при измерениях в динамике содержания NGAL, цистатина-С, KIM-1, L-FABP, интерлейкина-18 в сыворотке крови и в моче, свидетельствовали о наличии прямой зависимости между длительностью тепловой ишемии и тяжестью повреждений гломерулярного аппарата и проксимальных канальцев.
При анализе закономерностей динамики клиренса креатинина установлено, что при экспериментальном моделировании тепловой ишемии и реперфузии возникали нарушения фильтрационной функции ренальной ткани, связанные с повреждающим действием гипоксии и реоксигенации и не зависящие от хирургических манипуляций при получении доступа к почке. Биохимические признаки торможения клубочковой фильтрации появлялись в первые 24 ч после вмешательства. Выраженность и продолжительность нарушений фильтрационной функции ассоциировались с длительностью тепловой ишемии и возрастали по мере увеличения времени пережатия почечной артерии.
Выводы. Тепловая ишемия с последующей реперфузией ренальной паренхимы, выполняемая в процессе лапароскопической резекции почки, служит самостоятельным фактором альтерации почечной ткани. Нарушения структуры эффекторных нефроцитов сопровождаются снижением фильтрационной способности почки. При этом клетки эпителиального слоя проксимальных канальцев нефрона отличаются наименьшей резистентностью к повреждающему действию гипоксии и реоксигенации.
Степень тяжести структурных изменений эпителия проксимальных канальцев, а также прогноз восстановления нарушенных функций зависят от продолжительности интраоперационного обескровливания.
Данные, полученные при электронно-микроскопическом исследовании, а также результаты измерения в динамике сывороточных и мочевых концентраций биохимических маркеров острого почечного повреждения позволяют с высокой вероятностью предположить, что структурно-функциональные изменения в эпителиальном слое проксимальных канальцев, возникающие после тепловой ишемии почки продолжительностью не более 30–60 мин, имеют обратимый характер с сохранением жизнеспособности эпителиоцитов-эффекторов. Летальные повреждения клеток с массовой их гибелью возникают, только когда время интраоперационного обескровливания увеличивается до 60–90 мин.



