Введение. По прогнозам ВОЗ, в ближайшие десятилетия возможны значительные изменения в возрастном составе человеческой популяции. Так, количество людей в возрасте 60 лет и старше практически удвоится с 2015 по 2050 г. Уже сейчас, например, в Японии указанная возрастная категория составляет не менее 30% населения. Аналогичная ситуация ожидается и в Российской Федерации к середине XXI в. [1]. В связи с этим лечение заболеваний, ассоциированных с пожилым возрастом, будет оставаться актуальной проблемой для системы здравоохранения любой страны. Одним из таких заболеваний является аденома (доброкачественная гиперплазия) предстательной железы. Открытые методики хирургического лечения ДГПЖ больших размеров эффективнее трансуретральных способов за счет большего объема удаляемой ткани. Однако сопряжены с высокой морбидностью. Трансуретральная лазерная энуклеация и вапоризация характеризуются более низким уровнем осложнений по сравнению с традиционной хирургией, но требуют специального дорогостоящего оборудования. Трансуретральная резекция простаты (ТУРП) служит методом выбора при объеме простаты 30–80 см3, при этом с увеличением объема резецируемой железы растет число осложнений [2].
Активное внедрение лапароскопии в урологическую практику не оставило без внимания и доброкачественную гиперплазию предстательной железы (ДГПЖ). Первые 60 пациентов были оперированы с 1999 по 2005 г. [3]. По аналогии с открытой хирургией описаны трансвезикальный (операция Фрейера) и транскапсулярный (операция Миллина) доступы к узлам аденомы, только лапароскопический или с роботической ассистенцией [4, 5]. В качестве рабочего пространства может быть использована брюшная полость, также оно может быть сформировано внебрюшинно. За разнообразием хирургических технологий следуют и различные варианты названия операции: минимально инвазивная простая простатэктомия (наиболее распространенный термин в зарубежной литературе), лапароскопическая экстраперитонеальная простая простатэктомия, лапароскопическая позадилонная простая простатэктомия, экстраперитонеальная лапароскопическая аденомэктомия, лапароскопическая аденомэктомия и др. [5–9]. По нашему мнению, прост в употреблении и понятен для отечественной урологии термин «экстраперитонеоскопическая аденомэктомия» (ЭА), которая выполняется с помощью стандартных лапароскопических инструментов.
Таким образом, оперативное лечение ДГПЖ больших размеров (объемом более 80 см3) может быть проведено с использованием разнообразных оперативных пособий. Однако вопрос о роли лапароскопических технологий остается открытым.
Цель исследования: оценить роль лапароскопической техники в оперативном лечении ДГПЖ объемом более 80 см3.
Материалы и методы. Проведен ретроспективный анализ результатов лечения пациентов, оперированных по поводу ДГПЖ в урологическом отделении Федерального клинического центра высоких медицинских технологий ФМБА России с 2011 по 2016 г. Показания к операции и анестезиологический риск определялись стандартными методами.

Всего за анализируемый период оперированы 797 пациентов с ДГПЖ, из них 79 (10%) перенесли ЭА. Средний возраст пациентов составил 68 (53–84) лет. Средний объем предстательной железы – 134 (80–300) см3. Цистостома была у 16 (20,2%) пациентов. Средний балл IPSS до операции составил 24,8, максимальная скорость мочеиспускания (Qmax) – 4 мл/с, объем остаточной мочи (Vres) – 147 мл.
Техника ЭА. Операция осуществлена бригадой из трех урологов. Вид анестезии, положение пациента на операционном столе, расположение урологов и оборудования, а также формирование доступа и расположение троакаров аналогичны таковым при выполнении лапароскопической радикальной простатэктомии внебрюшинным доступом.
Ключевые моменты операции:
- после катетеризации мочевого пузыря доступ к передней поверхности простаты;
- рассечение ее капсулы в поперечном направлении между шейкой мочевого пузыря и дорсальным венозным комплексом;
- формирование пространства между капсулой простаты и аденоматозными тканями;
- поэтапная энуклеация узлов аденомы;
- фиксация задней полуокружности шейки мочевого пузыря в ложе удаленной аденомы (тригонизация);
- ушивание капсулы;
- дренирование паравезикальной клетчатки (при необходимости).
Уретральный катетер Фолея или не удалялся, или устанавливался вновь. Использовались как двух-, так и трехходовые катетеры, что определялось оперирующим урологом. Рассечение тканей и гемостаз осуществлены любым доступным на момент операции видом энергии (ультразвуковая, моно- или биполярная электрохирургия и др.). Прошивание как средство гемостаз использовалось только на этапе освоения операции и в дальнейшем рутинно не применялось. При технической возможности сохраняли простатический отдел уретры или ее заднюю полуокружность – в таких случаях выполнения тригонизации не требовалось. Так называемая средняя доля отсекалась вместе со слизистой мочевого пузыря под строгим контролем за устьями мочеточников. При симультанной цистолитотомии камни из мочевого пузыря удалены через отдельный разрез мочевого пузыря или его шейку. Симультанная пластика паховых грыж проведена сетчатым аллотрансплантатом с фиксацией его герниостеплером.
Для оценки кривой обучения ЭА проанализирован предшествовавший хирургический опыт и уровень мануальных навыков урологов с позиций количества лапароскопических и экстраперитонеоскопических радикальных простатэктомий, выполненных каждым урологом с 2006 по 2011 г. Анализ осложнений проведен на основании системы Clavien–Dindo [10]. Для статистической обработки полученная информация формализована с помощью разработанного кодификатора и внесена в базу данных, созданную на основе электронных таблиц Excel.
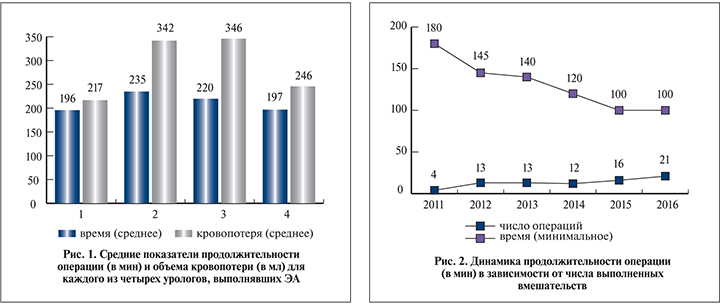
Результаты. Среднее время операции составило 206 (100–450) мин при средней кровопотере 256 (30–1200) мл. Максимальная кровопотеря отмечена при максимальном объеме предстательной железы. Тридцати пяти (44%) пациентам выполнены симультанные операции (табл. 1).
Средняя оценка по шкале IPSS после операции составила 6,5 баллов (в среднем снизилась на 18,3 балла), среднее значение Qmax – 16 мл/с (в среднем выросло на 12 мл/с), Vres – 28 мл.
Подавляющее большинство (77) операций проведено из экстраперитонеоскопического доступа. В двух случаях для уретеролитотомии и резекции крупного дивертикула мочевого пузыря потребовался перевод в истинно лапароскопический вариант. Имело место одно интраоперационное осложнение в виде повреждения ветви дорсального венозного комплекса, что потребовало его прошивания. В послеоперационном периоде тому же пациенту выполнена трансфузия тромбоцитарной массы в связи с исходной тромбоцитопенией и внутрипузырным кровотечением. Наблюдение этого пациента в течение 6 мес. нарушений эректильной функции и появления симптомов нижних мочевых путей не выявило. Случаев конверсии в открытую операцию и летальных исходов в ближайшем послеоперационном периоде не было. В одном случае обнаружен инцидентальный рак предстательной железы (сумма Глисона 5).
Послеоперационные осложнения наблюдались у 10 (12,6 %) пациентов (табл. 2). За период наблюдения с января 2012 по март 2017 г. повторно по поводу симптомов нижних мочевых путей не был оперирован ни один пациент, перенесший ЭА.
Кривая обучения ЭА оценена с позиций хирургического опыта, имевшегося перед освоением методики (учитывали опыт открытой аденомэктомии и лапароскопической [экстраперитонеоскопической] радикальной простатэктомии), среднего времени операции и количества осложнений. Операцию освоили четыре уролога с различным исходным опытом лапароскопических и открытых операций (табл. 3). Длительность операции и кровопотеря были меньшими у более опытного уролога (рис. 1). Накопление опыта сопровождалось значительным снижением минимального времени операции (рис. 2).
Обсуждение. С момента первой ЭА прошло 18 лет (с 1999 г.). В доступных источниках литературы самый крупный мета-анализ [11] включает 27 наблюдательных исследований с участием 764 пациентов. Средние показатели предоперационного объема простаты, времени операции и объема кровопотери составили 113,5 см3, 141 мин и 284 см3 соответственно, Qmax после вмешательства выросла в среднем на 14,3 мл/с, оценка по шкале IPSS снизилась на 17,2 балла. Послеоперационные осложнения наблюдались в 13,6% наблюдений. По сравнению с открытой аденомэктомией ЭА характеризовалась большей продолжительностью, при меньших показателях кровопотери, времени катетеризации мочевого пузыря и сроках госпитализации [11]. В целом наши данные коррелируют с большинством работ, оценивающих результаты ЭА.
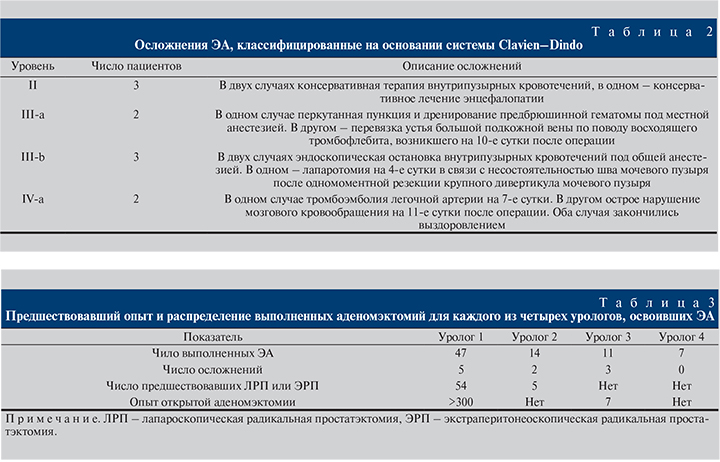
В одном сравнительном исследовании показано преимущество ЭА в лечении ДГПЖ объемом более 80 см3 перед биполярной трансуретральной резекцией по объему удаляемой ткани, кровопотере, времени катетеризации мочевого пузыря и поздним осложнениям при сроке наблюдения 3 года [7].
В другом сравнительном исследовании ЭА с роботической ассистенцией и гольмиевой энуклеации получены схожие результаты [12]. Сравнений с монополярной ТУРП, лазерной вапоризацией, а также гольмиевой энуклеацией с ЭА не найдено.
В нашем исследовании продемонстрированы возможности лапароскопической технологии в симультанном лечении заболеваний, которые могут сопутствовать или представляют собой осложнения гиперплазии простаты (камни и крупные дивертикулы мочевого пузыря, паховые грыжи) с приемлемой продолжительностью операции, уровнем кровопотери и послеоперационных осложнений. На основании собственного опыта считаем оптимальным доступом для проведения операции внебрюшинно через капсулу простаты. Одним из преимуществ подобной методики считается возможность сохранения простатического отдела уретры, что позволяет избегать недержания мочи и ретроградной эякуляции [13].
Заключение. Экстраперитонеоскопическая аденомэктомия – эффективная, относительно безопасная и воспроизводимая операция, которая вполне может заменить открытое вмешательство. Требуется дальнейшее накопление доказательной базы для объективного определения оптимального выбора между различными малоинвазивными способами лечения ДГПЖ. На современном этапе применение лапароскопических технологий более оправданно при наличии сопутствующих заболеваний, которые могут быть симультанно скорректированы.



