Введение. В структуре заболеваемости злокачественными новообразованиями мужского населения России рак предстательной железы (РПЖ) занимает второе место (14,4%) после рака легкого (17,8%), в группе мужчин старше 60 лет – первое место (18,3%). Ежегодно в России выявляют около 28 тыс. новых случаев РПЖ. За период с 2005 по 2015 г. абсолютное число больных с впервые установленным диагнозом РПЖ выросло с 16 861 до 38 812. Несмотря на совершенствование методов лечения, данное заболевание остается на третьем месте в структуре смертности от онкологических заболеваний у мужчин после рака легкого и желудка [1, 2].
Ацинарная аденокарцинома составляет 95% злокачественных новообразований предстательной железы [3]. Это инвазивная карцинома, состоящая из эпителиальных клеток с секреторной дифференцировкой, имеющих множество гистологических вариантов строения. В ацинарной аденокарциноме клетки базального слоя отсутствуют. Гистологическая картина ацинарной аденокарциномы обычно вариабельна. Наиболее частый вариант – мелкие ацинарные структуры, растущие среди предсуществующих нормальных ацинарных и протоковых структур предстательной железы, с признаками ядерной атипии и крупными ядрышками в ядрах. Железы в опухоли могут быть различного размера и формы, могут сливаться, формировать крибриформные и гломерулоподобные структуры; иногда ацинарная аденокарцинома представлена тяжами, отдельно лежащими клетками или солидными скоплениями опухолевых клеток.
Существуют редкие гистологические варианты ацинарной аденокарциномы: атрофический, псевдогиперпластический, муцинозный (коллоидный), ацинарная аденокарцинома перстневидно-клеточного типа (signet ring-like cell), аденокарцинома из пенистых клеток (foamy gland) и саркоматоидный. В новую классификацию ВОЗ (2016) добавлено еще два новых варианта ацинарной аденокарциномы: микрокистозная и плеоморфная гигантоклеточная [4].
Уже более 50 лет для определения тактики лечения и прогноза карциномы предстательной железы применяется система градации, разработанная доктором Дональдом Глисоном в 1960 г. и носящая его имя. Система градации Глисона основана на признаках архитектоники опухоли: отражает плотность расположения желез, характер инфильтрирующего роста и степень дифференцировки опухоли. Выбранные Глисоном характерные участки строения опухоли были разделены на пять уровней (grade) дифференцировки, каждому из которых было присвоено определенное число – от 1 до 5, которое отражало степень дифференцировки опухолевых желез и связь с прогнозом. Другие характеристики, такие как степень ядерного плеоморфизма, частота митозов и т.д., при оценке градации по Глисону не учитываются. Уникальность этой системы состоит в том, что в ней оцениваются и суммируются два преобладающих, т.е. наиболее характерных для конкретной опухоли предстательной железы, структурных уровня, формируя суммарный индекс Глисона. Первая цифра индекса (суммы) Глисона присваивается преобладающему в количественном отношении структурному компоненту опухоли, второй цифрой индекса Глисона обозначается следующий, менее распространенный по объему структурный компонент опухоли.
Сумма этих двух показателей определяет индекс градации Глисона (Gleason grading system), позволяющий наиболее полно представлять гетерогенность опухоли, служит важным параметром, используемым в прогностических номограммах Партина и Катана, и выступает независимым фактором прогноза биохимического рецидива, коррелируя с клинической стадией заболевания [5–12]. Исключение составляют степень градации Глисона биопсии 1–2 и индекс (сумма) по шкале Глисона менее 6 в связи с низкой воспроизводимостью и плохой корреляцией с морфологическими результатами после радикальной простатэктомии. Высокая степень градации по Глисону является важным предиктором развития биохимического и локального рецидивов, а также исхода заболевания [13].
В то же время система градации Глисона неоднократно претерпевала изменения (в 2005 и 2011 гг.). В 2014 г. Международным обществом уропатологов (International Society of Urological Pathology, ISUP) система градации Глисона была повторно модифицирована [4, 14]. Новая система градации и терминологии групп градации 1–5 была одобрена Всемирной организацией здравоохранения (ВОЗ) в 2016 г.
Согласно новой классификации ВОЗ (2016), крибриформный вариант ацинарной аденокарциномы, вариант с гломерулоидными и сосочковыми структурами или плохо сформированными раздутыми железами без комедонекроза стали относить к 4-му уровню шкалы Глисона (Gleason pattern 4). Крибриформный вариант строения опухоли протекает наиболее агрессивно, является независимым фактором прогноза биохимического рецидива [15–25]. Муцинозный (коллоидный) вариант ацинарной аденокарциномы по новой классификации может быть охарактеризован как соответствующий 3-му или 4-му уровням шкалы Глисона (Gleason pattern 3;4). Участкам аденокарциномы со значением 3 (Gleason pattern 3) соответствуют хорошо сформированные дискретно расположенные железы разного размера. Участки 5 (Gleason pattern 5) представлены тяжами опухоли, отдельными клетками, гнездами, трабекулами, структурами с очагами комедонекроза.
J.I. Epstein et al. проанализировали результаты лечения более 20 тыс. пациентов РПЖ после простатэктомии [6, 14, 15]. На основании полученных результатов консенсусом ISUP (2014) выделено 5 прогностичеких групп, коррелирующих с 5-летней биохимической безрецидивной выживаемостью, которые можно обобщить в виде следующей таблицы (табл. 1). Авторами отмечено, что разделение больных на группы поможет осуществлять точный прогноз заболевания и определять тактику лечения больных РПЖ [7, 8, 14–17, 26–30].

Цель: изучить значимость новой системы гистологической градации ацинарной аденокарциномы предстательной железы, согласно новой классификации ВОЗ 2016 г. в оценке риска прогрессирования после конформной дистанционной лучевой терапии, брахитерапии источниками 125I и андрогенной депривационной терапии больных ацинарной аденокарциномой предстательной железы.
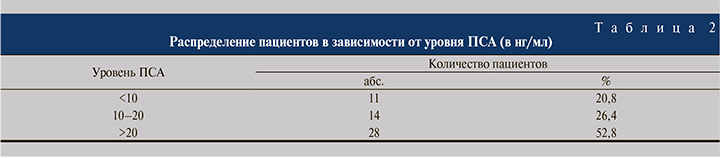
Материалы и методы. Проведена сочетанная лучевая терапия (конформная дистанционная лучевая терапия, брахитерапия источниками 125I) на фоне длительной андрогенной депривационной терапии аналогами лютеинизирующего рилизинг-гормона (ЛГРГ) 53 больным ацинарной аденокарциномой предстательной железы. Возраст больных варьировался от 54 лет до 81 года (средний возраст – 68,11±4,7 года). У большинства пациентов диагностирована стадия Т3N0M0 – 42 (79,3%), у остальных 11 (20,7%) – Т2N0M0. В 50 (94,3%) наблюдениях опухоль локализовалась в периферической зоне предстательной железы. У 85% пациентов опухоли имели мультифокальный тип роста. Объем предстательной железы варьировался от 18 до 103 см3 (44,6±2,48 см3), объем опухоли – от 0,5 до 3,2 см3 (1,54±0,09 см3). Показатели сывороточной концентрации простатспецифического антигена (ПСА) составили 5,5–311 нг/мл (39,7±7,9 нг/мл). У большинства (52,8%) мужчин уровень ПСА был выше 20 нг/мл (табл. 2).
Всем больным выполняли биопсию предстательной железы под визуальным контролем (трансректальное УЗИ). Для морфологического исследования материала осуществляли забор не менее 10–12 биоптатов, которые размещали в отдельные контейнеры и подвергали маркировке (картирование биопсии ПЖ). Биоптаты фиксировали в 10%-ном растворе формалина и заливали в парафин. Градацию по системе Глисона проводили с учетом новой классификации ВОЗ (2016) опухолей предстательной железы.
Все пациенты получали сочетанную лучевую терапию. Дистанционную лучевую терапию выполняли на линейном ускорителе электронов Clinac 1323, 1333 (Varian, США) 5 раз в неделю (разовая доза – 2 Гр, суммарная [23 сеанса] – 46 Гр) с использованием технологии VMAT (лучевая терапия объемной модулированной интенсивностью арками). Облучению подлежали предстательная железа с парапростатической клетчаткой, семенные пузырьки, зоны регионарного метастазирования (общие, внутренние и наружные подвздошные, пресакральные и запирательные лимфатические узлы). Имплантацию источников 125I в предстательную железу осуществляли под УЗ-контролем с использованием планирующей системы PSID в режиме онлайн-планирования. Суммарная доза составила 110 Гр. Гормональную терапию получали все больные в неоадъювантном (2–4 мес.) и адъювантном (3 года) режимах и на фоне лучевой терапии аналогами ЛГРГ.
Для оценки эффективности проводимого лечения применяли критерии RECIST 1.1. Продолжительность жизни оценивали с первого дня лечения до последнего дня наблюдения или смерти. Биохимическим рецидивом считали увеличение уровня ПСА на 2 нг/мл по сравнению с минимальным достигнутым значением маркера (надиром).
Для оценки отдаленных результатов использовали интервальный метод построения таблиц дожития Life table, рекомендованный к применению Международным противораковым союзом (UICC). Выживаемость больных высчитывали по состоянию на 1.05.2019 методом Каплана–Мейера. Для сравнения таблиц выживаемости использовали тесты Wilcoxon (Breslouw) и Mantel-Cox. Корреляционный анализ проводили с использованием программного обеспечения MedCalc Statistical 10 (USA). Достоверность выявленных различий рассчитывали по критерию Стьюдента. Статистически значимым считали различие с вероятностью ошибки менее 5% (p<0,05).
Результаты. У всех больных диагностирована мелкоацинарная аденокарцинома. Прорастание капсулы, инвазия в семенные пузырьки, периневральная, ангиолимфатическая инвазия выявлены у 28 (52,8%), 8 (15,1%) и 26 (49,1%) больных соответственно.
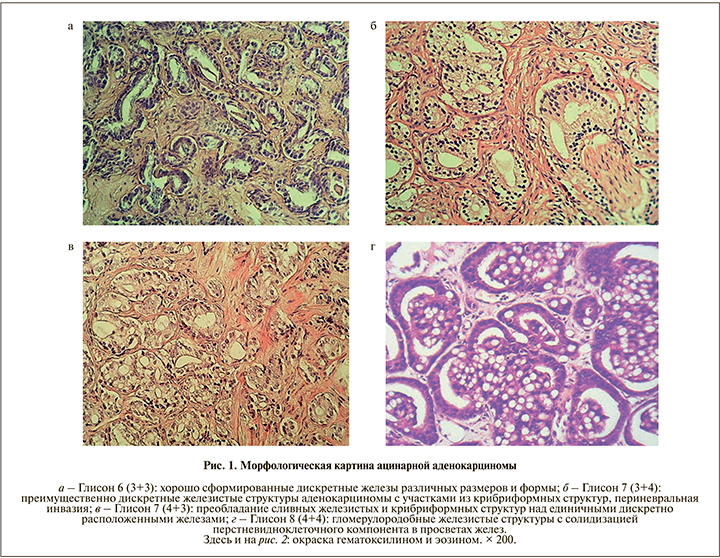
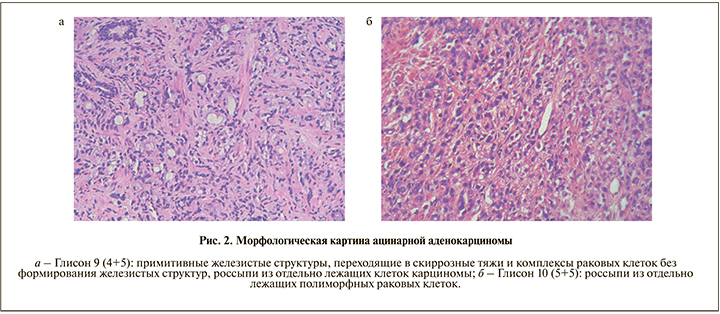
В исследуемых нами образцах отсутствовали участки, соответствовавшие градации 1 и 2 по Глисону. У 11 (20,7%) больных ацинарная аденокарцинома соответствовала индексу (сумме) Глисона 6 (3+3); рис. 1а), у 13 (24,5%) – 7 (3+4); рис. 1б), у 15 (28,3%) – 7 (4+3); рис. 1в), у 10 (18,9%) – 8 (4+4); рис. 1г), у 3 (5,7%) – 9 (4+5); рис. 2а) и только у 1 (1,9%) – 10 (5+5); рис. 2б).
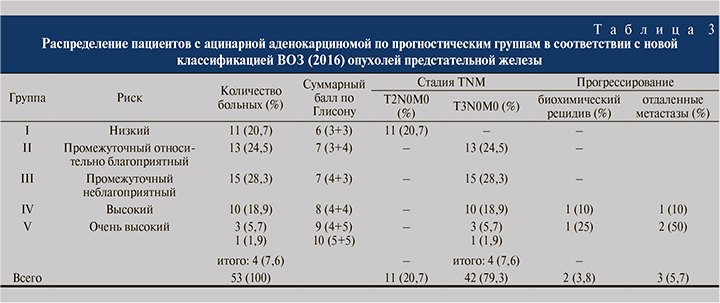
Все 53 пациента были распределены нами на 5 прогностических групп согласно новой классификации ВОЗ. На основе анализа данных литературы нами была обнаружена закономерность, согласно которой риск прогрессирования ацинарной аденокарциномы повышается по мере возрастания индекса (суммы) Глисона. На основе этого анализа и обнаруженной нами закономерности мы выделили пять групп риска прогрессирования ацинарной аденокарциномы: с низким риком, промежуточным относительно благоприятным, промежуточным неблагоприятным, высоким и очень высоким (табл. 3).
Кроме того, нами отмечена корреляция между уровнем сывороточного ПСА и выделенными нами группами риска (р=0,096). В группе низкого риска (I группа) медиана концентрации сывороточного ПСА была равна 32,4 нг/мл, в группе промежуточного риска (II и III группы) – 41,3, в группе высокого риска (IV и V группы) – 51,3 нг/мл.
После неоадьювантной гормональной терапии отмечена положительная динамика: уменьшение объема предстательной железы до 14–65 см3 (29,7±1,61 см3), снижение уровня сывороточного ПСА до 1,6–9,04 нг/мл (1,61±0,32 нг/мл). После завершения сочетанной лучевой терапии у всех больных констатировали полный регресс первичной опухоли. Курс лучевой терапии реализован в полном объеме в отношении всех пациентов.
Результаты лечения прослежены в сроки от 24 до 86 мес. (42±2 мес.), медиана наблюдения составила 38 мес. У 5 (9,4%) пациентов наблюдалось прогрессирование заболевания через 20–67 мес. (37,9±7,4 мес.) после завершения лучевой терапии. Медиана до прогрессирования заболевания составила 29,85 мес. В двух наблюдениях имели место биохимические рецидивы, у троих пациентов выявлены отдаленные метастазы, которые локализовались в парааортальных лимфатических узлах, легких и костях. Все пациенты с прогрессированием были из групп высокого и очень высокого рисков (IV и V группы). Четверо (7,5%) больных с прогрессированием заболевания живы и находятся под наблюдением. Один (1,9%) пациент с биохимическим рецидивом умер от острого инфаркта миокарда.
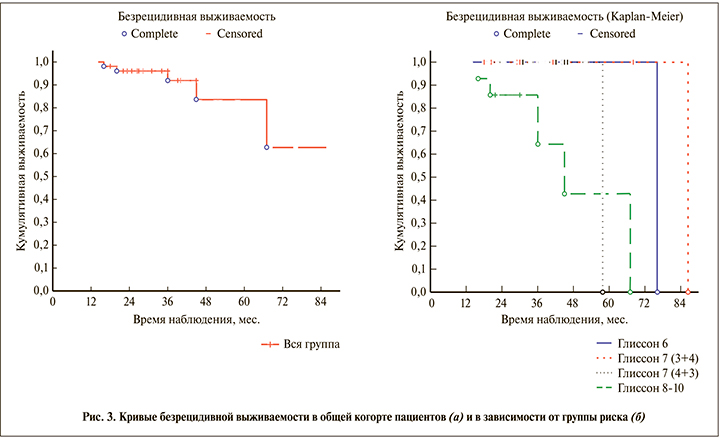
Пятилетняя безрецидивная выживаемость больных в общей когорте пациентов составила 83,5±9,1% (рис. 3). Пятилетняя безрецидивная выживаемость больных в группах высокого и крайне высокого рисков прогрессирования (IV и V группы) составила 44,4%, больных I–III групп – 100% (р<0,05).
Обсуждение. На конгрессе международного общества уропатологов, состоявшемся в 2014 г. в Чикаго, было принято соглашение об изменении положений, касающихся системы градации Глисона и о выделении пяти прогностических групп. Распределение пациентов РПЖ по прогностическим группам основано на результатах крупного мультицентрового клинического исследования [14–15, 27]. Оно показало, что выделение прогностических групп служит единственным мощным фактором прогноза безрецидивной выживаемости больных ацинарной аденокарциномой предстательной железы после радикальной простатэктомии [14–15].
Главные заключения, сделанные на основании многих рандомизированных исследований, которые внесли основной вклад в модификацию классификации Глисона 2016 г., заключались в необходимости указывать процентное отношение участков с 4-й градацией при индексе Глисона 7 и в переносе крибриформного варианта ацинарной аденокарциномы без комедонекрозов с гломерулоидными и сосочковыми структурами из 3-го уровня градации в 4-й [14–16, 27].
В предыдущей классификации ВОЗ-2004 крибриформный вариант ацинарной аденокарциномы расценивался как 3-я градация. Однако на основании клинических исследований показано, что крибриформная аденокарцинома служит неблагоприятным фактором прогноза относительно биохимического рецидива и безрецидивной выживаемости больных раком предстательной железы после радикальной простатэктомии [18–20, 27]. Таким образом, произошло перемещение больных раком предстательной железы, имевших индекс Глисона 6 в группу пациентов с индексом Глисона 7, имевших более агрессивное течение заболевания. Пациенты РПЖ с индексом Глисона 7 отличаются прогнозом в зависимости от преобладающего в количественном отношении структурного компонента опухоли.
В мультицентровом исследовании, опубликованном J.I. Epstein et al. в 2015 г., показано, что пациенты, относившиеся к первой прогностической группе (Глисон 6, ВОЗ-2016), имели благоприятный прогноз, высокий показатель 5-летней безрецидивной выживаемости, равный 95%. На прогноз заболевания у данных пациентов не влияли даже такие морфологические факторы, как экстрапростатическое распространение опухоли и положительные края резекции после простатэктомии. Больные V и VI групп имели неблагоприятный прогноз, высокий риск прогрессирования, что отражалось на 5-летних показателях безрецидивной выживаемости (48 и 26% соответственно).
В ранее проведенных исследованиях сравнительный анализ показателей безрецидивной выживаемости в зависимости от примененного метода лечения (хирургического или лучевой терапии) не проводился [14, 15, 27].
Наше исследование продемонстрировало, что все 5 больных с прогрессированием заболевания были из IV и V прогностических групп. Двое пациентов с прогрессированием заболевания были из IV (Глисон 4+4) прогностической группы и 3 – из V (Глисон 4+5 и 5+5). Безрецидивная 5-летняя выживаемость больных IV и V прогностических групп составила 44,4%. Ни у одного пациента I (Глисон 3+3), II (Глисон 3+4) и III (Глисон 4+3) прогностических групп не отмечено прогрессирования заболевания. Показатель 5-летней безрецидивной выживаемости у этих больных был равен 100%. Отмечены достоверные различия в показателях безрецидивной выживаемости больных I, II, III и IV, V прогностических групп (р<0,05).
Заключение. Рак предстательной железы обладает значительной гетерогенностью. Более глубокое понимание морфологии, иммуногистохимии и связей с клиническими признаками сподвигло Международное общество уропатологов пересмотреть классификацию опухолей предстательной железы. Внесены изменения в систему градации Глисона. С появлением новой классификации опухолей предстательной железы (ВОЗ-2016), основанной на выделении пяти прогностических групп, появилась возможность оценки риска прогрессирования РПЖ. Данная информация поможет не только осуществлять прогноз заболевания, но и определять тактику лечения больных РПЖ.
У всех (53) больных, вошедших в наше исследование, диагностирована аденокарцинома предстательной железы. В первую прогностическую группу вошли 11 (20,7%) пациентов РПЖ, во вторую – 13 (24,5%), в третью – 15 (28,3%), в четвертую – 10 (18,9%) и в пятую – 4 (7,6%).
Анализ закономерностей исхода заболевания свидетельствует о благоприятном прогнозе больных аденокарциномой предстательной железы (Глисон 6 [3+3], 7 [3+4]и 7 [4+3] I–III прогностических групп (ВОЗ-2016) после сочетанной лучевой терапии на фоне длительной депривационной гормональной терапии.
Неблагоприятный прогноз отмечен у больных IV (Глисон 8 (4+4) и V (Глисон 9 [4+5] и 10 [5+5] прогностических групп (ВОЗ-2016). Несмотря на подведение высокой дозы в предстательную железу больным IV и V прогностических групп, у 2 (14,3%) пациентов выявлены ПСА-рецидивы.
Таким образом, наше исследование продемонстрировало, что прогностические группы, выделенные в новой классификации ВОЗ 4-го пересмотра 2016 г., могут использоваться для прогнозирования безрецидивной выживаемости не только после хирургического лечения, но и после сочетанной лучевой терапии на фоне длительной депривационной гормональной терапии больных ацинарной аденокарциномой предстательной железы.



