Введение. Восстановление проходимости верхних мочевыводящих путей (МВП) при их обширных повреждениях, стриктурах и облитерациях остается одним из самых сложных разделов оперативной урологии. Значительные дефекты мочеточников образуются после их ятрогенных повреждений при операциях на органах малого таза и брюшной полости, осложнений открытых и эндокопических операций на верхних МВП, вследствие применения лучевой терапии, а также при мочекаменной болезни, туберкулезе, ретроперитонеальном фиброзе, новообразованиях и др. [1–3]. Данной категории больных требуется полное или частичное замещение мочеточников с использованием аутотрансплантатов. Как показало время, не увенчались успехом попытки уретеропластики синтетическими материалами, свободными лиофилизированными артериями, аутовенами, фаллопиевыми трубами, участками твердой мозговой оболочки, брюшиной, слизистой из внутренней поверхности щеки и др. Использование всех этих трансплантатов и тканей не имеет перспектив для реконструкции мочеточника, так как, в отличие от него, они не способны к сократительным движениям и их включение в мочевой тракт неизменно приводит к гидронефрозу. В результате длительного пути, пройденного экспериментаторами и клиницистами в поисках материала для замещения МВП, наиболее подходящими оказались сегменты желудочно-кишечного тракта, прежде всего тонкая кишка, наиболее близкая к мочеточнику по строению стенки и способная к сократительной деятельности [4–7].
Считается, что первую кишечную пластику мочеточника выполнил J. Schoemaker, который в самом начале прошлого века неоднократно оперировал больную, страдавшую микроцистисом. Стараясь избавить ее от мучительных частых мочеиспусканий, он вывел ей мочеточник единственной почки на кожу, при этом используя изолированный сегмент тонкой кишки, т.е. выполнил уретероилеокутанеостомию. Спустя некоторое время, уже стремясь устранить мочевой свищ, он пересадил дистальный конец кишечного сегмента с кожной поверхности в мочевой пузырь (МП), в результате тазовый отдел мочеточника стал представлен участком подвздошной кишки. Впервые же целенаправленно заместил нижнюю половину левого мочеточника сегментом подвздошной кишки R. Nissen в 1932 г. у больного с двусторонним уретеролитиазом, стриктурами и мочеточниково-кожным свищом. И только через 8 лет (в 1940 г.), убедившись в хороших функциональных результатах такого подхода, он опубликовал это наблюдение. В дальнейшем наибольший вклад в развитие кишечной пластики мочеточников внесли W. E. Goodwin, R. Küss, J. Kucera, Ф. А. Клепиков, В. С. Карпенко, А. П. Фрумкин и Д. В. Кан [1].
Одной из редких операций считается реконструкция мочеточника червеобразным отростком. Впервые в 1959 г. ее выполнил R. Küss. С тех пор в мировой литературе описано несколько десятков единичных наблюдений подобного использования аппендикса [8].
За последние годы тонкокишечную и аппендикулярную пластику мочеточников по возможности стали проводить эндовидеохирургическим методом [9, 10]. Тем не менее эти операции при всех способах их выполнения не получили широкого распространения и за более чем столетний период только две клиники в мире, имея опыт 131 и 155 илеоуретеропластик, приблизились к нашим показателям количества выполненных таких оперативных вмешательств [11, 12].
Цель исследования: представить технические особенности и результаты кишечной и аппендикулярной пластики мочеточников.
 Материалы и методы. С 1998 по 2020 г. в нашей клинике кишечная и аппендикулярная пластика мочеточников была выполнена 196 пациентам в возврате от 18 до 77 лет (средний возраст – 49,5±1,2 года). Мужчин было 73 (37,2%), женщин – 123 (62,8%). Показаниями к операциям оказались протяженные дефекты, сужения и облитерации мочеточников, наиболее частыми причинами возникновения которых стали осложнения открытых и эндоскопических операций на мочеточниках (34,7%), последствия лучевой терапии (26,0%) и их ятрогенные травмы при гинекологических и хирургических операциях (20,9%). Реже показаниями служили обструктивный мегауретер (6,1%), болезнь Ормонда (6,1%), осложнения ортотопической цистопластики (3,6%) и прочие (2,6%).
Материалы и методы. С 1998 по 2020 г. в нашей клинике кишечная и аппендикулярная пластика мочеточников была выполнена 196 пациентам в возврате от 18 до 77 лет (средний возраст – 49,5±1,2 года). Мужчин было 73 (37,2%), женщин – 123 (62,8%). Показаниями к операциям оказались протяженные дефекты, сужения и облитерации мочеточников, наиболее частыми причинами возникновения которых стали осложнения открытых и эндоскопических операций на мочеточниках (34,7%), последствия лучевой терапии (26,0%) и их ятрогенные травмы при гинекологических и хирургических операциях (20,9%). Реже показаниями служили обструктивный мегауретер (6,1%), болезнь Ормонда (6,1%), осложнения ортотопической цистопластики (3,6%) и прочие (2,6%).
Замещение мочеточников 165 (84,2%) больным проведено сегментами подвздошной кишки, 4 (2,0%) – сегментами толстой кишки и 27 (13,8%) – червеобразным отростком. Эти данные представлены в таблице. В большинстве случаев для уретеропластики использовали подвздошную кишку. Илеотрансплантаты всегда располагали внутрибрюшинно, как правило, изоперистальтически (95,8%) и лишь в 4,2% случаев антиперистальтически. Длина взятого кишечного участка варьировалась от 3 см при пластике по Yang–Monti до 100 см при тотальном замещении обоих мочеточника и МП. Односторонняя илеоуретеропластика проведена 131 (79,4%) пациентам, из них 66 – слева; двусторонняя – 34 (26,6%) пациентам.
Частичное замещение мочеточников при односторонней пластике осуществлено в 107 (81,7%) случаях, полное – в 24 (18,3%). При тотальной уретеропластике 21 пациенту проксимальный анастомоз выполнен с лоханкой, 3 – с нижней чашечкой (рис. 1). При этих объемных операциях использовали разработанный нами комбинированный доступ (патент на изобретение № 2511086 от 06.02.2014) [1].
В случаях полного замещения мочеточника следует учитывать особенность анатомического строения тонкого кишечника, т.е. несоответствие ширины брыжейки длине извитой кишечной трубки. И чем больше размер сегмента кишки, тем больше это несоответствие. В связи с этим при взятии длинного илеотрансплантата для полного замещения мочеточника надо прежде всего ориентироваться на его брыжейку. Необходимо выкроить последнюю так, чтобы противоположные края ее без натяжения располагались рядом с лоханкой вверху и МП внизу. Однако в такой брыжеечный сегмент попадает соответствующий ему участок кишки, не прямой, а дугообразный и извилистый, а потому имеющий длину, большую, чем необходимо для тотальной илеоуретеропластики. Включение такого кишечного сегмента в мочевой тракт чревато застоем слизи и мочи, а также увеличивает площадь их возможной резорбции с развитием метаболических нарушений. Для укорочения и выпрямления кишечного трансплантата мы резецировали 10–15 см его длины в центральной части с межкишечным анастомозом «конец в конец», оставив брыжейку интактной. Недостатком данного метода являются взятие кишечного трансплантата большей длины, резекция его в центральной части и дополнительный межкишечный анастомоз, что увеличивало травматичность и продолжительность операции. В связи с этим нами разработана более простая техника выпрямления кишечной трубки (заявка на изобретение № 2020121706 от 25.06.2020). Она заключается в нанесении 7–10 продольных насечек длиной 1–1,5 см на брыжейку в ее межсосудистых зонах. В результате брыжейка растягивается, высота ее уменьшается, а ширина увеличивается, приближаясь к длине кишечной трубки.
Тонкокишечная реконструкция мочеточников реконфигурированными сегментами по Yang–Monti проведена 12 (7,3%) больным, в том числе 4 (33,3%) – двумя кишечными сегментами, что позволило увеличить длину трансплантата до 10–12 см. Важной технической особенностью такой илеоуретеропластики является правильное сшивание детубуляризированных и развернутых на 90° навстречу друг другу кишечных участков. Связано это с тем, что после поворота в области их соединения возникает избыток кишечной ткани, а короткие брыжейки создают натяжение и не позволяют расправить получившуюся длинную кишечную полоску. Если ретубуляризировать ее в таком виде, то в зоне анастомоза возникает гофрирование и перегиб вновь сформированной кишечной трубки, что на фоне избытка ткани и отека приводит к обструкции трансплантата.
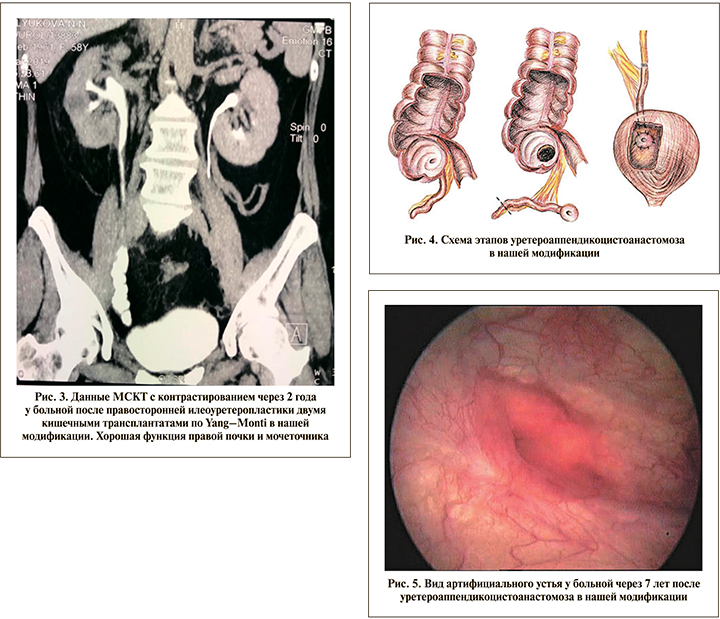
В связи с этим нами разработана более надежная техника операции (патент на изобретение № 2681106 от 24.11.2017), которая заключается в следующем. Выкраивают сегмент подвздошной кишки длиной 10–11 см. Затем резецируют в его центральной части участок размером 4 см с неглубоким клиновидным иссечением оставшейся и уже не нужной в этом месте брыжейки (рис. 2a). В результате между двумя образовавшимися кишечными трансплантатами создается необходимое пространство для правильного положения их после реконфигурации. Далее оба коротких илеотрансплантата рассекают по антибрыжеечным краям, поворачивают на 90° навстречу друг другу и сшивают узловыми викриловыми швами 3/0 в единую продольную кишечную площадку длиной 12–13 см и шириной 3–3,5 см (рис. 2b). В центральной части удлиненные и развернутые концы трансплантатов занимают место удаленного ранее кишечного участка. Поэтому в зоне их соединения не возникает натяжения брыжеек и перегиба трансплантата, связанного с избытком кишечной ткани. При следующей за этим ретубуляризации на интубаторе образуется ровная с хорошим просветом кишечная трубка (рис. 2c), которой замещают дефект мочеточника (рис. 2d). На рис. 3 представлены данные МСКТ с контрастированием через 2 года после пластики тазового отдела правого мочеточника по выше-описанному методу.

Двусторонняя тонкокишечная реконструкция мочеточников проведена 34 (20,6%) больным. Наиболее часто, в 21 (61,8%) случае, выполнялась U-образная илеоуретеропластика, реже – более сложные реконструкции: J-образная – в 2 (5,9%), 7- или Г-образная – в 6 (17,6%), двумя раздельными илеотрансплантатами – в 5 (14,7%) случаях.
Толстую кишку для замещения мочеточников использовали только в отношении 4 (2,0%) пациентов, которым было невозможно выполнить илеоуретеропластику.
В одном случае короткий участок ободочной кишки был взят для реконструкции верхней трети левого мочеточника по Yang–Monti, в трех остальных для замещения различных отделов мочеточников использована сигмовидная кишка.
В 27 (13,8%) наблюдениях проходимость мочеточника восстановлена за счет червеобразного отростка. Двадцати трем (85,2%) пациентам операция выполнена в тазовом отделе в виде уретероаппендикоцистоанастомоза, в том числе четырем слева. В отношении 22 (81,5%) из них использована наша модификация (патент на изобретение № 2308893 от 27.10.2007). Она заключается в выкраивании вместе с червеобразным отростком округлой площадки из слепой кишки, что обеспечивает более широкий и надежный анастомоз аппендикотрансплантата с МП (рис.4, 5).
У 4 (14,8%) пациентов червеобразным отростком была замещена часть мочеточника в его поясничном отделе посредством пиело- или уретероаппендикоуретероанастомозов.
Лапароскопическим методом тонкокишечная пластика мочеточников проведена 39 (23,6%) пациентам, робот-ассистированным – 2 (1,2%). Частичное замещение мочеточников выполнено в 30 случаях, полное – в 5, реконфигурированными кишечными сегментами – в 4. Эндовидеохирургическая аппендикоуретеропластика осуществлена 4 (14,8%) из 27 пациентов.
Оценку функционального состояния почек и МВП в ближайшем и отдаленном послеоперационном периодах осуществляли на основании данных комплексного обследования, включившего клинические и биохимические анализы, ультрасонографию, лучевые методы диагностики, комплексное уродинамическое исследование, при необходимости цисто- и уретероскопию. Срок наблюдения варьировался от 3 мес. до 21 года, составив в среднем 9,2±0,8 года.
Результаты. Ранние послеоперационные осложнения отмечены у 17 (8,7%) пациентов. Они имели место только среди больных, перенесших тонкокишечную пластику мочеточников. Наиболее тяжелыми из них был перитонит в результате острой кишечной непроходимости, несостоятельности мочекишечных анастомозов и некроза илеотрансплантата – 8 (4,1%) пациентов. Кровотечение из лоханки и вновь созданных мочевых путей возникло у 2 (1,0%) больных. Все эти 10 пациентов были повторно оперированы с благоприятным исходом. Еще у 1 (0,5%) больного развился инфаркт миокарда и у 6 (3,1%) – обострение хронического пиелонефрита, в том числе на фоне обструкции мочеточниковых анастомозов в результате отека, купированного консервативными методами. Летальных исходов не было.
В отличие от ранних, поздние послеоперационные осложнения наблюдались как среди пациентов, которым была проведена кишечная пластика, так и в группе больных, перенесших аппендикулярную реконструкцию мочеточников. Они развились у 24 (14,3%) из 168 больных, обследованных в отдаленном послеоперационном периоде. Наиболее частыми оказались стриктуры уретероилео- и уретероаппендикоанастомозов, т.е. проксимальных соустьев, которые имели место у 8 (4,8%) больных. Все они были повторно оперированы. В 2 случаях проведены реуретероанастомозы, у 6 пациентов стриктуры были ликвидированы эндоуретеротомией и стентированием мочеточников. Соединение трансплантата с МП, являясь достаточно широким, не было подвержено стриктурообразованию, однако ассоциировано с таким осложнением, как пузырно-мочеточниковый рефлюкс, который наблюдали у 5 (3,0%) пациентов. Однако он оказался клинически не значимым, так как не сопровождался гидроуретеронефрозом или атаками пиелонефрита.
Обострение хронического пиелонефрита в тяжелой форме, возникшее у 3 (1,8%) пациентов, удалось купировать консервативно. Еще у 8 (4,8%) больных после двустороннего замещения обоих мочеточников кишечными сегментами развились гиперхлоремический метаболический ацидоз и электролитные нарушения, купированные консервативно. Наиболее выраженными они были у двух пациентов после тотального двустороннего замещения обоих мочеточников раздельными трансплантатами, у одного – после полного замещения МВП. В данных случаях причиной развития осложнений считаем большую внутреннюю поверхность илеотрансплантатов.
Обсуждение. Кишечная и аппендикулярная пластика при протяженных стриктурах мочеточников – единственная возможность избавить пациентов от мочевых свищей, сохранить почку и восстановить мочеиспускание естественным путем.
Изолированный сегмент подвздошной кишки является лучшим и универсальным пластическим материалом для замещения любого дефекта мочеточника, в том числе с обеих сторон и/или в сочетании с ортотопической илеоцистопластикой. Червеобразный отросток и участок толстой кишки следует расценивать как альтернативный пластический материал.
В ближайшем послеоперационном периоде у данных больных наиболее часто встречаются такие осложнения, как несостоятельность анастомозов и острая кишечная непроходимость, а в отдаленном – стриктуры и облитерации проксимальных анастомозов. Их частота при кишечной пластике мочеточников во многом определяется правильностью техники выполнения оперативного вмешательства. Некоторые ее этапы имеют важные особенности и заслуживают отдельного обсуждения. Так, после взятия кишечного трансплантата должно быть определено, как располагать его: внутрибрюшинно или внебрюшинно, изо- или антиперистальтически и как выполнять мочеточниково-кишечные и кишечно-пузырные анастомозы? Считаем, что, располагая кишечный участок забрюшинно, мы помещаем его в условия, не свойственные данному органу, поэтому кишечные трансплантаты и мочекишечные анастомозы практически всегда оставляли в брюшной полости. При решении вопроса о расположении трансплантата всегда следует стремиться к изоперистальтическому положению кишечного участка, что было выполнено нами в отношении 95,8% больных.
Считаем возможным проведение пластики реконфигурированными кишечными участками по Yang–Monti, в том числе двумя илеотрансплантатами в нашей модификации. К преимуществам этого метода можно отнести возможность замещения дефектов любых отделов мочеточника от 6 до 12 см и соответствие таким образом сформированного трасплантата диаметру мочеточника. При небольшой внутренней поверхности значительно уменьшаются слизеобразование и вероятность метаболического ацидоза. Так, M. Esmat et al. [13] выполнили операцию Yang–Monti 16 пациентам. Для замещения дефектов мочеточников во всех случаях авторы использовали сегмент подвздошной кишки. У 13 (81,3%) больных отмечено улучшение функции почек по данным лучевых и радиоизотопных методов диагностики. R. Ordorica et al. [14] провели илеоуретеропластику по методике Yang–Monti 7 пациентам и также констатировали хорошие результаты операции в большинстве (6 (85,0%) наблюдений.
Однако эту операцию, несмотря на ее изящество, следует применять с осторожностью. Во-первых, рассечение кишечной трубки по антибрыжеечному краю сопровождается пересечением сосудов, в том числе внутристеночных возвратных артерий, тесно анастомозирующих между собой. Во-вторых, повреждаются также и нейромышечные образования, что неминуемо сказывается на сократительной способности трансплантата. Ретубуляризация в другом направлении достигается узловыми швами, каждый из которых ложится перпендикулярно проходящим внутристеночным сосудам. В условиях сниженного кровообращения концов трансплантата выполняются и мочеточниково-кишечные анастомозы, слабым звеном которых является место сшивания трех поверхностей.
В связи с этим за более чем десятилетний период данная операция не получила распространения, о чем свидетельствуют единичные публикации о ней в виде отдельных клинических наблюдений [1, 13, 14]. В отечественной литературе отсутствуют сообщения о применении операции по методу Yang–Monti. Наш относительно небольшой опыт 12 подобных оперативных вмешательств пока не позволяет рекомендовать ее внедрение в широкую клиническую практику.
Двусторонние илео- и колоноуретеропластики – более сложные и травматичные оперативные вмешательства. Наиболее часто необходимость в них возникает при лучевых поражениях МВП [1, 2]. Частичное или полное замещение обоих мочеточников можно выполнить одновременно или поэтапно, используя один или два раздельных участка кишки. Этапность операции зависит от тяжести состояния больного и степени выраженности деструктивных изменений МВП. Двусторонняя илеоуретеропластика усложняется по мере увеличения протяженности требующих замены участков мочеточников. Это связано, во-первых, с широким и травматичным хирургическим доступом; во-вторых, необходимостью выключения из тонкого кишечника более протяженного сегмента; в-третьих, с включением длинного извитого участка (или участков) кишки в мочевую систему, что увеличивает площадь резорбции и риск метаболических нарушений, в-четвертых, непростыми особенностями пластики правого мочеточника в изоперистальтическом положении.
В настоящее время в мире никто не обладает достаточным клиническим материалом, позволяющим объективно судить о преимуществах и недостатках замещения мочеточника аппендиксом. Наш опыт 27 аппендикоуретеропластик дает такую возможность [8]. Достаточные длина и диаметр, мобильность за счет длинной брыжейки с питающими сосудами позволяют использовать аппендикс в реконструктивной хирургии верхних МВП. По нашему мнению, преимуществом данного метода уретеропластики служит применение аутогенного органа соответствующего мочеточнику диаметра с аналогичным строением стенки и низкой резорбцией, так как площадь соприкосновения с мочой невелика. Аппендикс также характеризуется направленными в сторону его основания сокращениями, за счет чего при изоперистальтическом расположении обеспечивается хороший пассаж мочи и достигается антирефлюксный эффект.
Перспективной модификацией этих операций считаем сшивание червеобразного отростка с МП с использованием выкроенной из слепой кишки округлой площадки. Подобная техника позволяет увеличивать функциональную длину червеобразного отростка и создавать широкий анастомоз с МП. Немаловажным является сохранность целостности анатомического жома отростка, что в известной степени препятствует развитию пузырно-мочеточникового рефлюкса. Такое усовершенствование увеличивает надежность аппендиковезикального анастомоза и позволяет улучшать отдаленные результаты оперативного вмешательства. Положительной стороной аппендикоуретеропластики служит следующее: поврежденному во время предшествовавших операций МП наносится минимальная травма. При этом риск развития его дисфункции в результате образования окружающих рубцов, деформации стенки и нейроваскулярных расстройств минимален. Основными факторам успеха операции считаем достаточную мобилизацию илеоцекального отдела кишечника и наличие необходимой для создания анастомоза без натяжения длины червеобразного отростка и его брыжейки. Немаловажным условием выполнения широкого мочеточниково-аппендикулярного соустья, менее подверженного сужению, является резекция каудальной части червеобразного отростка, которую мы производим на расстоянии 2–3 см от конца.
Червеобразный отросток, как правило, используют при дефектах нижней и средней трети правого мочеточника, что обусловлено анатомической близостью данных отделов мочевой системы. Более труднодоступными, но возможными отделами для подобной пластики являются верхняя треть правого мочеточника и тазовый отдел левого мочеточника. Заместительную пластику их червеобразным отростком можно отнести к эксклюзивным операциям. Они технически более сложные и далеко не всегда выполнимы, так как требуют не только соответствующих хирургических навыков, но и наличия определенных анатомо-топографических условий. В отличие от расположенных рядом со слепой кишкой отделов мочеточника, для восстановления которых достаточно отсечения основания аппендикса с выделением его на брыжейке, для замещения более отдаленных участков мочеточников требуется прежде всего достаточная мобилизация илеоцекального угла кишечника и смещение его в необходимом направлении. Более протяженные дефекты мочеточника у взрослых могут быть компенсированы комбинацией аппендикоуретеропластики с операцией Боари или Psoas-hitch [1]. Следует подчеркнуть, что нам при наличии большого опыта реконструктивной хирургии, в том числе замещения мочевых путей различными отделами желудочно-кишечного тракта, включающих почти три десятка успешных аппендикоуретеропластик, уже в процессе выполнения еще нескольких таких операций не удалось завершить их в соответствии с намеченным планом и пришлось использовать другой метод уретеропластики.
Использование эндовидеохирургии и робототехники при выполнении кишечной и аппендикулярной пластики мочеточников позволяет снижать травматичность операции и уменьшать сроки пребывания больного в стационаре.
Заключение. В настоящее время наша клиника располагает наибольшим опытом по кишечной и аппендикулярной реконструкции мочеточников в мировой урологической практике. Высокие требования, предъявляемые к этим операциям, и всесторонний анализ их результатов позволили разработать новые тактические и технические решения, подкрепленные пятью патентами на изобретения. Минимальное число послеоперационных осложнений, отсутствие летальных исходов и хорошие отдаленные результаты операций за более чем 20-летний период мотивируют на продолжение этой работы и позволяют рекомендовать данные виды оперативных вмешательств в клиническую практику.


