Введение. В современном мире бесплодие занимает важное место среди актуальных проблем в медицине. Отсутствие беременности в течение 1 года заставляет 15% супружеских пар обращаться к специалистам [1, 2].
В среднем у 50% бездетных пар бесплодие связано с «мужским фактором» и зачастую ассоциировано с неблагоприятными внешними факторами среды, повышением частоты воспалительных процессов половых органов мужчин и аномалиями развития [3–7]. До 25% случаев из числа всех обследованных мужчин составляют идиопатические формы с неуточненной причиной бесплодия, тяжело поддающиеся лечению [1, 8, 9].
В обеспечении мужской фертильности важную роль может играть протеом (совокупность белков и пептидов) семенников. По разным оценкам и исследованиям, в семенниках обнаружено до 6000 пептидных соединений, каждое из которых участвует в регуляции сперматогенеза [10]. Любое изменение в протеоме спермы или семенной плазмы может оказать неблагоприятное влияние на нормальную физиологическую функцию сперматозоидов. Ряд исследований выявили изменения в протеоме спермы и семенной плазмы, ассоциированные с такими факторами мужского бесплодия, как варикоцеле [11–16], идиопатическое бесплодие [17–19], необъяснимое бесплодие [20–23], повышенный окислительный стресс [24–26] и рак яичек [27, 28].
Важная роль в синтезе белков и пептидов, то есть в создании протеомной среды, принадлежит клеткам Сертоли. Они участвуют в поддержании процесса сперматогенеза, в том числе выделяют транспортные и железо-связывающие белки, например трансферрин и церулоплазмин; адгезивные белки; обеспечивают транспортировку питательных микроэлементов, необходимых для развития сперматозоидов, через гематотестикулярный барьер. В семенниках млекопитающих сперматогониальные стволовые клетки находятся в тесном контакте с клетками Сертоли. Клетки Сертоли являются важным участником сперматогенеза, секретируя компоненты базальной мембраны и обеспечивая паракринную, юкстакриновую передачу сигналов [29, 30]. При расщеплении белков, синтезируемых клетками Сертоли, образуются регуляторные пептиды [31].
Регуляторные пептиды осуществляют перенос между клетками информации, закодированной с помощью последовательности аминокислот и конформационных модификаций, благодаря чему влияют на пролиферацию, дифференцировку и межклеточные взаимодействия, обеспечивая тонкую настройку сперматогенеза. За счет участия в регуляции экспрессии генов и синтеза белков регуляторные пептиды предотвращают повреждения ДНК и усиливают течение репаративных процессов [32–35].
PPR-001 представляет собой лекарственный препарат, состоящий из комплекса регуляторных пептидов с молекулярной массой не более 10 кДа.
Препарат прошел полный комплекс доклинических исследований, которые свидетельствуют об отсутствии острой и хронической токсичности, канцерогенных, эмбриотоксических, мутагенных, иммунотоксических и тератогенных свойств, а также местнораздражающего и аллергизирующего действий [36, 37].
Было изучено тканеспецифическое действие препарата PPR-001, показано достоверное увеличение зоны роста эксплантатов семенников (суммарно 800 эксплантатов) и отсутствие влияния на органотипические культуры других органов [36].
PPR-001 восстанавливал нарушенный сперматогенез, достоверно увеличивал количество сперматозоидов и повышал оплодотворяющую способность в экспериментальной модели радиационного старения крыс [39].
Проведенные клинические исследования I фазы с участием здоровых мужчин-добровольцев и исследования II фазы с участием пациентов с нарушениями сперматогенеза подтвердили благоприятный профиль безопасности и эффективность PPR-001 в отношении влияния на концентрацию и подвижность сперматозоидов [40, 41], что позволило получить разрешение на проведение регистрационных клинических исследований III фазы лекарственного препарата.
Полученные на сегодняшний день данные позволяют предположить, что благодаря тканеспецифическому воздействию на структуры яичка и нормализации их функциональной активности PPR-001 может быть эффективным в лечебной программе пациентов с различными формами бесплодия, связанными с недостаточной выработкой нормальных сперматозоидов. Такие больные, по нашему мнению, составляют до 20% контингента наблюдаемых урологами мужчин.
Материалы и методы. В настоящей работе представлены данные рандомизированного двойного слепого плацебо-контролируемого проспективного многоцентрового исследования в параллельных группах, проведенного в соответствии с принципами GCP (good clinical practice – надлежащая клиническая практика), номер протокола – TST-06-2019. Цель данного исследования – оценка эффективности и безопасности препарата PPR-001 по сравнению с плацебо у мужчин с нарушениями сперматогенеза.
Исследование состояло из трех этапов:
- Период скрининга – продолжительностью до 14 дней;
- Период оценки эффективности терапии – 90±5 дней;
- Период наблюдения – 14 дней±2 дня.
Лабораторное обследование включило спермограмму, МАР-тест, определение содержания в крови HbA1c, общего тестостерона, фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), глобулина, связывающего половые гормоны (ГСПС), ингибина В, пролактина, простатического сывороточного антигена (ПСА), выявление возбудителей инфекций, передаваемых половым путем (ИППП), в уретральном соскобе эпителиальных клеток методом полимеразной цепной реакции (ПЦР), серологическое исследование крови (HbsAg, Anti-HCV, ВИЧ), бактериологический посев мочи и эякулята с антибиотикограммой, УЗИ органов малого таза, клинический и биохимический анализы крови, общий анализ мочи.
Пациенты, прошедшие скрининг во время Визита 0 и удовлетворяющие критериям включения/исключения, были рандомизированы в соотношении 1:1 в 2 группы: в группу PPR-001 (n=50) вошли пациенты, которые получали исследуемый препарат внутримышечно в дозе 5 мг 1 раз в неделю на протяжении 10 недель; в группу плацебо (n=50) – пациенты, которые получали плацебо внутримышечно 1 раз в неделю на протяжении 10 недель.
На последующих Визитах (2, 3, 4) проводились физикальный осмотр с оценкой артериального давления (АД), частоты сердечных сокращений (ЧСС), температуры тела, регистрации электрокардиограмы (ЭКГ), клинический и биохимический анализы крови с исследованием уровня половых гормонов в крови (общий тестостерон, ФСГ, ЛГ), общий анализ мочи, оценка нежелательных явлений (НЯ).
Оценку стандартных параметров эякулята проводили на визитах 0 (скрининг), 3 (70±5 дней от начала терапии) и 4 (через 20±5 дней после окончания 70-дневного курса терапии).
На рис. 1 схематично представлен дизайн данного исследования.

Полный курс терапии и 3 визита прошли 100 пациентов. Завершили исследование по протоколу (популяция PP) 96 рандомизированных пациентов (1 пациент из группы PPR-001 и 3 пациента из группы плацебо выбыли в период наблюдения на визитах 4, 5).
В исследование были включены пациенты мужского пола в возрасте от 18 до 65 лет, соответствовавшие критериям включения: с наличием олиго- и астеноспермии (cперматологическая диагностика осуществлялась в соответствии с рекомендациями ВОЗ, 2010 [42]), а также с уровнем ФСГ не выше 11,1 мЕД/мл, ЛГ не выше 8,6 мМЕ/мл и общего тестостерона не выше 30 нМ/л.
К критериям невключения относились отягощенный аллергологический анамнез; гиперчувствительность к любому из компонентов, входящих в состав препарата, PPR-001 и белкам животного происхождения; наличие анамнестического элемента экскреторного бесплодия, азоо- или аспермия в случае ретроградной эякуляции; наличие признаков инфекции мочевыводящих путей, хронического воспаления простаты, придатка яичка или самого яичка; варикоцеле III степени (по классификации ВОЗ, 1997); пиоспермия; врожденные аномалии развития мочеполовых органов; перенесенные оперативные вмешательства в области уретры, шейки мочевого пузыря, предстательной железы, малого таза, мошонки и полового члена; нейрогенная дисфункция мочевого пузыря, недержание мочи, склероз/стриктура шейки мочевого пузыря или уретры, симптомы нижних мочевыводящих путей, камень/камни мочевого пузыря, рак мочевого пузыря или простаты, дивертикулы мочевого пузыря на момент включения в исследование, а также другие заболевания мочеполовых органов, требующие проведения специализированного лечения; любое злокачественное новообразование в анамнезе; применение любой заместительной гормональной терапии с использованием половых гормонов; первичный или вторичный гипогонадизм, обусловленный хромосомными заболеваниями или генной аномалией; гиперпролактинемия; неудовлетворительный гликемический контроль (HbA1c ≥8%) при сахарном диабете; наличие неконтролируемой инфекции в результате воздействия вируса иммунодефицита человека (ВИЧ) и/или активного гепатита; наличие наркотической или алкогольной зависимости в анамнезе в течение последних 5 лет; а также любое клинически значимое состояние, из-за которого, по мнению исследователя, пациент не может принимать участие в исследовании; участие пациента в клиническом исследовании лекарственных средств менее чем за 6 месяцев до начала исследования.
В данном исследовании на всем его протяжении пациентам было запрещено применение некоторых препаратов (антибиотиков, гормонов, цитостатиков и любых биологически активных добавок), влияющих на сперматогенез/функцию сперматозоидов.
В качестве первичного критерия эффективности определяли долю пациентов, у которых наблюдался терапевтический ответ на Визите 3.
В рамках настоящего исследования под терапевтическим ответом подразумевалось не менее чем 20%-ное увеличение значения хотя бы одного из следующих показателей: концентрация (млн/мл) или прогрессивная подвижность (PR [или А+В], %) сперматозоидов в эякуляте по сравнению с исходным уровнем (20% – граница превосходящей эффективности, предварительно установленная с помощью статистических методов).
Вторичные критерии эффективности:
- доля пациентов, у которых наблюдался терапевтический ответ на Визите 4;
- среднее изменение на Визитах 3 и 4 по сравнению с исходным уровнем значений по концентрации и общей подвижности сперматозоидов в эякуляте.
Анализ безопасности проводили на основании данных о регистрации НЯ и серьезных НЯ (СНЯ), результатов лабораторных анализов и инструментальных методов исследования (ЭКГ), данных физикального осмотра и оценки изменений жизненно важных показателей.
Статистический анализ
Показатели эффективности проанализированы с использованием методов параметрической статистики (t-критерий Стьюдента, ANOVA) и/или непараметрической статистики (точный критерий Фишера, критерий Манна–Уитни, критерий Уилкоксона) в зависимости от результатов оценки нормальности распределения выборки.
Для анализа различий первичной переменной эффективности использован дисперсионный анализ для независимых групп с повторными измерениями (ANOVA mixed model). Расчет 95% доверительного интервала для разности долей (%) пациентов с достигнутым первичным критерием оценки эффективности в группах и сравнение нижней границы проведены с предварительно установленной границей превосходящей эффективности (20%). Статистический анализ осуществлен в соответствии с руководством «Two Proportions –
Non-Inferiority, Superiority, Equivalence, and Two-Sided Tests vs. a Margin» программного обеспечения NCSS 11.0.
Определение мощности исследования планировалось для тестирования гипотезы о превосходящей эффективности исследуемого препарата по сравнению с плацебо.
Размер выборки был рассчитан на основании следующих параметров:
1. Критический уровень значимости при тестировании нулевой гипотезы – α=0,25;
2. Мощность исследования – не менее 80%;
3. Граница превосходящей эффективности – 20%.
Результаты. В результате проведенного исследования установлено, что препарат при применении по схеме 1 раз в неделю на протяжении 10 недель в дозе 5 мг обладает клинической эффективностью и оказывает положительное влияние на концентрацию сперматозоидов в эякуляте, процент прогрессивно подвижных форм и морфологию сперматозоидов.
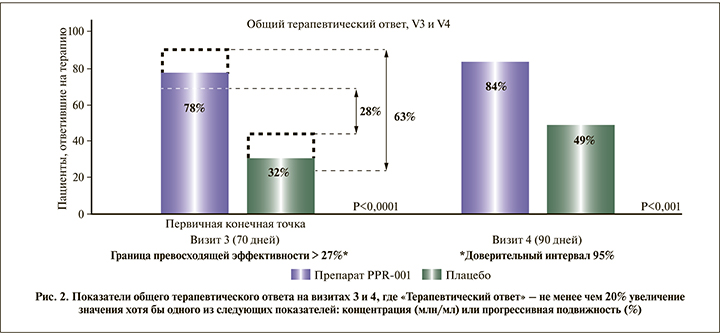
На Визите 3 удалось достичь терапевтического ответа в 78% (39 из 50) случаев в группе PPR-001 и 32% (16 из 50) случаев в группе Плацебо.
При расчете превосходящей эффективности данные, полученные на ограниченном количестве пациентов взятых выборок, проецируются на всю популяцию пациентов. Было продемонстрировано, что с вероятностью 95 % истинная разница между эффектами группы Плацебо и группы PPR-001 лежит в диапазоне 28–63%. Таким образом, с высокой степенью достоверности (p=0,0235) нижняя граница превосходящей эффективности составила более 27% (Two Proportions – Superiority Tests Report, P1 – P2> 0,2700).
Был сделан вывод о превосходящей эффективности препарата PPR-001 по сравнению с плацебо в отношении не менее чем 20% увеличения значения хотя бы одного из следующих показателей: концентрация (млн/мл) или прогрессивная подвижность (PR (или А+В), %) сперматозоидов в эякуляте по сравнению с исходным уровнем.
Обобщенные данные о терапевтическом ответе в группах представлены в табл. 1, рис. 2.
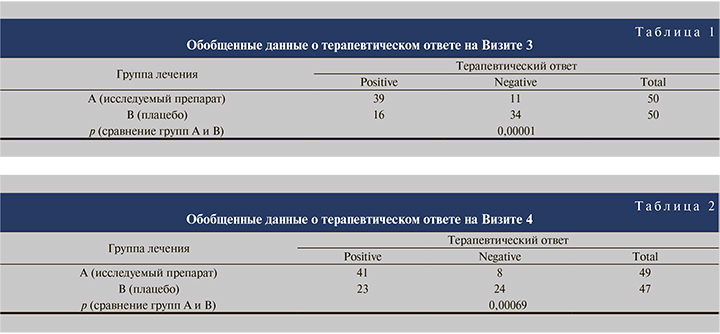
Оценка терапевтического ответа в группах на Визите 4 (через 20±5 дней после окончания 70(±5)-дневного курса терапии проводилась в качестве одного из вторичных критериев оценки эффективности (табл. 2, рис. 2).
Были выявлены статистически значимые различия между группами по доле пациентов с терапевтическим ответом на Визите 4 (p=0,00069), при этом удалось достичь терапевтического ответа в 83,7% (41 из 49) случаев в группе PPR-001 и 48,9% (23 из 47) случаев в группе Плацебо.
Показатели общего терапевтического ответа на Визитах 3 и 4, где «Терапевтический ответ» – не менее чем 20%-ное увеличение значения хотя бы одного из следующих показателей: концентрация (млн/мл) или прогрессивная подвижность (%).
Среднее изменение концентрации сперматозоидов в эякуляте на Визитах 3 и 4 по сравнению с исходным уровнем рассматривалось в качестве вторичного критерия эффективности (рис. 2). В результате проведенного дисперсионного анализа повторных измерений (ANOVA repeated measured) выявлено статистически значимое (p=0,026778) увеличение концентрации сперматозоидов в группе PPR-001 по сравнению с Плацебо через 70 дней (Визит 3), которое сохранялось на Визите 4 в периоде наблюдения до 90 дней (p=0,000099).
Исходные значения концентрации сперматозоидов составили в группе PPR-001 11,06±3,27 млн/мл, в группе Плацебо 11,57±2,86.
Через 70 дней (Визит 3) наблюдалась 5-кратная разница в эффектах между группами PPR-001 и Плацебо: среднее изменение относительных индивидуальных параметров концентрации сперматозоидов в эякуляте по сравнению с исходным уровнем составило 254,47% после окончания курса терапии в группе PPR-001 и лишь 54,27% в группе Плацебо, рис. 3.
Был проведен анализ среднего изменения показателей общей подвижности сперматозоидов в эякуляте по сравнению с исходным уровнем на Визитах 3 и 4, которые выявили статистически значимые различия между группами пациентов, получавших препарат PPR-001 и Плацебо «Визит 3–Исходно», p=0,036097.
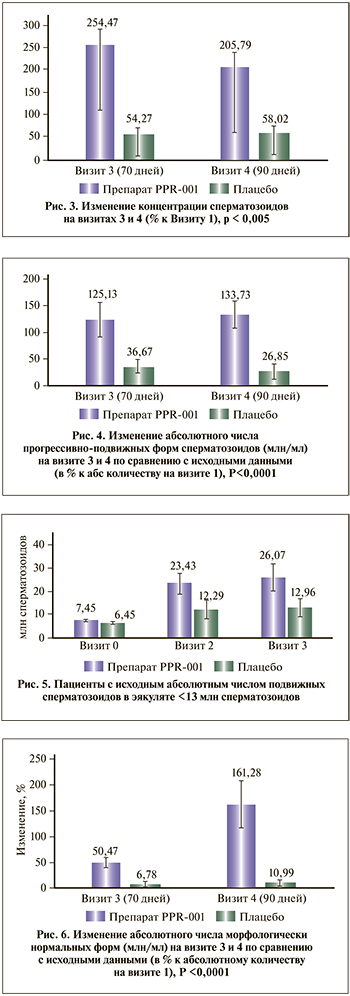
При пересчете число прогрессивно подвижных форм сперматозоидов на Визитах 1, 3, 4 в абсолютные цифры (в млн/мл) выявлены статистически значимые различия между группами PPR-001 и Плацебо. Абсолютное число прогрессивно подвижных форм в группе PPR-001 увеличилось на 125,12% через 70 дней (Визит 3) от начала терапии и на 133,72% через 90 дней (Визит 4) по сравнению с исходными значениями, т.е. отмечен дальнейший рост абсолютного числа прогрессивно подвижных форм даже после прекращения курса терапии. В группе Плацебо изменения не превышали 36,7% от исходных значений, ожидаемо снижаясь в период наблюдения (рис. 4). Таким образом, прирост числа прогрессивно подвижных форм в группе PPR-001 более чем в 4 раза превысил прирост в группе Плацебо.
При анализе динамики количества прогрессивно подвижных форм сперматозоидов у пациентов с исходным уровнем менее 13 млн сперматозоидов в эякуляте (рис. 5) отмечалась выраженная положительная динамика в группе PPR-001 через 35 дней, Визит 2 (увеличение в 3,28 раза по сравнению с исходным показателем, р=0,08) с тенденцией к дальнейшему росту в период наблюдения до 70 дней (Визит 3), разница с группой Плацебо достоверна (p=0,09).
Дополнительно с целью оценки всего спектра влияния препарата на показатели спермограммы проведена оценка динамики числа сперматозоидов с нормальной морфологией.
Показана превосходящая эффективность препарата PPR-001 над плацебо в отношении увеличения на 20% количества морфологически нормальных форм сперматозоидов, граница превосходящей эффективности – 9% (p=0,0225).
При пересчете числа сперматозоидов с нормальной морфологией на Визитах 1, 3, 4 в абсолютные цифры (в млн/мл) были выявлены статистически значимые различия между группами пациентов, получавших PPR-001 и Плацебо, при этом абсолютное количество сперматозоидов с нормальной морфологией в группе PPR-001 увеличилось на 50,47% через 70 дней от начала терапии (к Визиту 3) и на 161,28% через 90 дней к Визиту 4 по сравнению с исходными значениями. В группе Плацебо изменения не превышали 11% от исходных значений и не были статистически достоверными (рис. 6).
НЯ были выявлены у 65 пациентов (у 34 пациентов в группе приема PPR-001 и у 31 пациента в группе Плацебо). При оценке числа пациентов, у которых были зарегистрированы НЯ, статистически значимых различий между группами выявлено не было (критерий хи-квадрат Пирсона). Все выявленные НЯ имели легкую степень тяжести, за время исследования случаев развития СНЯ зарегистрировано не было. Не обнаружено отрицательной динамики по результатам оценки жизненных функций, биохимического и клинического анализов крови, клинического анализа мочи, показателей ЭКГ. Выявленные отклонения от нормальных значений лабораторных показателей были расценены врачами-исследователями как клинически незначимые.
Обсуждение. В ходе работы были достигнуты цели исследования, а именно проведена оценка эффективности и безопасности препарата PPR-001. Применение данного лекарственного препарата планируется с целью лечения таких нарушений сперматогенеза, как олиго- и астеноспермия.
Одним из главных результатов исследования является сохранение терапевтического эффекта после завершения курса лечения. Однократное введение регуляторного пептида может вызывать отсроченные эффекты продолжительностью 1–3 недели, то есть когда существование первично введенного пептидного биорегулятора уже исключено [32–34]. Сохранение терапевтического эффекта может быть обусловлено механизмом действия регуляторных пептидов, которые запускают каскад реакций и сигнальных процессов, продолжающихся после окончания курса терапии.
Важно, что период терапии охватывает весь цикл сперматогенеза, что в настоящем исследовании было осуществлено при выборе продолжительности курса. Курсовое введение пептидного комплекса PPR-001 в течение 70 сут. позволяло влиять на различные стадии сперматогенеза, что выражается в повышении концентрации, увеличении числа прогрессивно подвижных форм и морфологически нормальных форм сперматозоидов. В качестве положительного аспекта терапии PPR-001, имеющего важное значение для восстановления мужской фертильности, отмечено отсутствие препарат-индуцированной полиспермии и преодоление референтного барьера ВОЗ 2010 [42], по абсолютному количеству подвижных сперматозоидов в эякуляте (13 млн сперматозоидов).
Также невозможно переоценить важность состава протеома семенников в регуляции процесса сперматогенеза. PPR-001 нормализует деятельность секретирующих клеток яичка (клеток Лейдига), участвующих в синтезе тестостерона при стимулирующем действии ЛГ, а также структур интерстициального пространства яичка (клеток Сертоли), деятельность которых способствует созреванию сперматозоидов и выработке андроген-связывающего пептида под воздействием ФСГ. В том числе препарат, вероятно, оказывает свое действие на параметры мужской фертильности за счет восстановления протеомной среды и поддерживающего влияния на функцию клеток Сертоли, обеспечивая тонкую настройку сперматогенеза. Данное предположение требует дальнейшего подробного изучения.
Хорошая переносимость курса лечения и низкое количество нежелательных явлений, продемонстрированные в данном исследовании, свидетельствуют о высоком профиле безопасности исследуемого препарата, что будет способствовать активному его применению и интересу со стороны врачебного сообщества.
Заключение. По результатам рандомизированного двойного слепого плацебо-контролируемого проспективного многоцентрового клинического исследования эффективности и безопасности лекарственного препарата PPR-001 (лиофилизат для приготовления раствора для внутримышечного введения, содержащий в качестве активного компонента регуляторные пептиды семенников) у мужчин с нарушениями сперматогенеза был сделан вывод о превосходящей эффективности PPR-001 по сравнению с плацебо в отношении не менее чем 20%-ного увеличения значения показателей концентрации (млн/мл) и/или процента прогрессивно подвижных форм сперматозоидов в эякуляте. Данный показатель эффективности препарата превосходит более чем в 2 раза результаты плацебо.
Применение PPR-001 приводит к 3-кратному увеличению концентрации сперматозоидов, с 5-кратной разницей в эффектах между группами PPR-001 и Плацебо по средним относительным изменениям концентрации сперматозоидов в эякуляте. Были выявлены статистически значимые различия с плацебо в отношении абсолютного числа прогрессивно подвижных форм сперматозоидов (млн/мл) и достоверное увеличение количества морфологически нормальных форм сперматозоидов в группе PPR-001.
Препарат PPR-001 (регуляторные пептиды семенников) имеет благоприятный профиль безопасности, статистически значимых различий между группами PPR-001 и Плацебо в отношении показателей безопасности, оцениваемых в исследовании, выявлено не было.



