Введение. Реконструктивная пластика больших дефектов стенки мочевого пузыря с помощью местных тканей в условиях их выраженного дефицита на практике часто становится серьезной проблемой. При выполнении широко распространенных в настоящее время реконструктивно-пластических операций по поводу местнораспространенного рака мочевого пузыря в качестве материала используют элементы толстого кишечника на сосудистой ножке, что позволяет восстанавливать объемообразующую и собирательную функцию мочевого пузыря. Однако игнорирование состояния уротелия создает определенные сложности в выхаживании пациентов данной группы в условиях постоянного дренирования резервуара от некротических масс и элементов функциональной жизнедеятельности кишечного эпителия [1–5].
Заместительная цистопластика является актуальной для операций не только по поводу онкологических заболеваний мочевого пузыря, но и при обширных его повреждениях вследствие бытовых и огнестрельных травм, осложненных мочепузырно-кишечными свищами, а также некоторых инфекционно-воспалительных заболеваниях, требующих оперативного лечения, направленного на восстановление целостности мочевого пузыря, его объема и функции [6–8].
Немаловажным фактором является то, что перемещенная в мочевую систему часть желудочно-кишечного тракта, исходно не предназначенная для выведения азотистых шлаков из организма и лишенная защитного гликозаминогликанового слоя, который в мочевом пузыре препятствует в норме влиянию агрессивных агентов, часто не справляется с ролью, возложенной на мочевой резервуар. В связи с этим кишечная пластика мочевого пузыря сопряжена помимо чисто хирургических осложнений (несостоятельность анастомозов, спаечная непроходимость, инфекционные осложнения и др.) с риском развития выраженных метаболических нарушений (гипо- и/или гиперхлоремический ацидоз, В12-дефицитное состояние, нарушение обмена кальция с вторичным камнеобразованием в мочевыводящих путях и др.) [9–12].
В качестве альтернативных вариантов пластических материалов для кишечной пластики мочевого пузыря могут использоваться другие неваскуляризированные или васкуляризированные ткани.
Например, мышечно-апоневротический лоскут брюшной стенки, фрагменты большого сальника на
сосудистой ножке, аллотрансплантат мочевого или желчного пузыря, сегмент брюшины, лиофилизированный трансплантат твердой мозговой оболочки или синтетические полиэтиленовые протезы, в том числе состоящие из искусственно обработанных биологических материалов, таких как коллагеновый матрикс [13, 14]. Положительные качества синтетических материалов заключаются в доступности, легкости изготовления, прочности, простоте стерилизации, относительной биологической инертности [15–17]. Тем не менее в литературе встречаются сообщения о формировании специфических гранулем, абсцедировании, развитии стойкой дизурии на фоне их использования [18].
В эксперименте на 22 собаках изучали свойства лиофилизированного аллотрансплантата стенки
мочевого пузыря и формировали из него искусственный мочевой резервуар [13]. В результате операции более половины животных погибло в послеоперационном периоде. В. П. Аратский и соавт. [20] в качестве пластического материала использовали консервированный желчный пузырь, но итоги вмешательства с применением данной методики оказались неудовлетворительными, так как ткань желчного пузыря впоследствии атрофировалась.
В ряде работ авторы пришли к выводу, что пластика больших дефектов мочевого пузыря сальником или брюшиной с формированием его на эндопротезе способствует улучшению кровоснабжения и постепенному восстановлению уротелия. При этом для пластики мочевого пузыря к собакам применялся большой сальник. К сожалению, в послеоперационном периоде у животных наблюдались многочисленные осложнения, такие как флегмона таза, расхождение краев раны, формирование костной ткани в сальниковой части пузыря после операции. Тем не менее авторы рекомендуют использование аллотрансплантата из мышечно-апоневротического лоскута брюшной стенки в качестве пластического материала для замещения мочевого пузыря, при этом последний постепенно замещается соединительной тканью [21, 22].
Поиск новых материалов для заместительной пластики мочевого пузыря в настоящее время является
актуальной задачей, особенно беспокоящей врачей, которые в своей повседневной практике часто сталкиваются с дефицитом материала и отсутствием резервов для обеспечения достаточного объема мочевого пузыря в ходе выполняемых реконструктивно-пластических операций на этом органе. Одним из трансплантационных искусственных материалов является коллаген. Современные технологии позволяют получать коллагеновые матриксы из стенки мочевого пузыря (бесклеточный коллагеновый матрикс или коллагеновый матрикс подслизистого слоя мочевого пузыря) или тонкой кишки (подслизистая тонкой кишки), по предварительным данным, перспективные для использования при цистопластиках [23].
В последние годы отечественной медицинской промышленностью получено множество новых коллагеновых материалов, таких как раневые покрытия “Коллахит-Ш” и “Коллахит-ФА”, “Гелевин”, коллагеновая антимикробная повязка “Дигиспон”, остеопластический материал “Алломатрикс” и мн. др.
[4, 5]. Перспективным для использования в урологической практике представляется препарат
“Коллост”, производящийся с 2001 г. компанией ЗАО “БиоФАРМАХОЛДИНГ”. Из зарубежных аналогов можно отметить материал “Pelvicol”.
Цель настоящего исследования – изучение возможностей, биореактивности и безопасности коллагенового биополимера “Коллост” в качестве материала для замещения дефектов стенки мочевого пузыря.
Материалы и методы. Эксперементальное исследование проведено на 24 кроликах обоего пола породы шиншилла массой от 3,1 до 4,2 (3,6±0,3) кг. Животным выполняли резекцию мочевого пузыря
с последующим замещением дефекта коллагеновой мембраной “Коллост”. Разрезом длиной 5–7 см по
средней линии в нижней части живота рассекали кожу, подкожную клетчатку и апоневроз, обнажали
переднюю стенку мочевого пузыря, создавали дефект овальной формы. Коллагеновую мембрану вырезали в форме овала размером 15–20 мм по длиннику (площадью 2,0–2,5 см2) и вшивали в дефект мочевого пузыря непрерывным обвивным швом атравматической нитью “Викрил” 4/0. Мочевой пузырь
не дренировали. Рану брюшной полости послойно ушивали нитью “Викрил” 2/0.
Функциональное состояние мочевого пузыря оценивали методом инфузионной цистоманометрии во
время повторных оперативных вмешательств через 7, 14 дней, 1, 3, 6 мес. и 1 и 1,5 года. На каждом сроке оперировали по три животных. Контрольную группу составили три кролика с интактным мочевым пузырем.
Все животные нормально перенесли операцию, однако 1 кролик умер на 6-й день от мочевого перитонита, развившегося в результате несостоятельности швов между имплантатом и стенкой мочевого пузыря.
Развиваемым детрузорным давлением считали разницу между максимальным и минимальным детрузорным давлением в мочевом пузыре при скорости инфузии 1,2–2,0 мл/мин. Тканевую реакцию оценивали по результатам морфологического исследования фрагментов ткани стенки мочевого пузыря в зоне анастомоза, полученных с помощью биопсии и подготовленных к исследованию методом парафиновых блоков.
Статистическую обработку данных проводили с помощью программы Statistics версия 6.0.
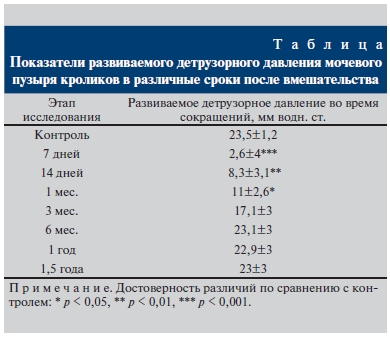
Результаты. Как видно из таблицы, результаты динамики внутрипузырного давления при постепенном наполнении мочевого пузыря в ранние сроки после операции (7–14 дней) свидетельствовали об уменьшении его функциональной емкости, более быстром росте давления и более раннем мочеиспускании при меньшем заполнении мочевого пузыря. Это мы связываем с операционной травмой и так называемым послеоперационным циститом.
На 7-е сутки после расширяющей цистопластики в биоптатах была выявлена обширная зона, содержащая коллагеновый матрикс, с небольшими лимфогистиоцитарными скоплениями. Через 2 нед. отмечено уменьшение интенсивности лейкоцитарной инфильтрации на фоне значительного отека подслизистого слоя с признаками сосудистой реакции. При этом сосуды микроциркуляторного русла были значительно расширены и полнокровны. Через 1 мес. после операции имплантат полностью замещался молодой соединительной тканью с отдельными пучками гладкомышечных волокон, причем их количество и размеры превышали таковые, выявляемые через 2 нед. после операции. Люминальная поверхность имплантата была полностью выстлана многорядным эпителием, имеющим типичное строение. В подслизистом слое отмечено наличие множества крупных сосудов, имеющих извитой ход.
Местная реакция стенки мочевого пузыря характеризовалась следующими особенностями. На некотором отдалении от места оперативного вмешательства имели место контрактильные изменения гладкомышечных волокон и выраженные их дистрофические изменения на фоне мощного отека, причем эти явления имели место в течение 1 мес. после операции.
Спустя 3 мес. произошла практически полная стабилизация морфологических изменений. Мышечная
оболочка имела слоистое строение, при этом мышечные волокна были фрагментированы и разделены
массивными прослойками соединительной ткани. Кровеносные сосуды были настолько хорошо развиты, что некоторые из них выходили на поверхность слизистой оболочки. Это рассматривается как своеобразный компенсаторно-приспособительный процесс, стимулирующий эпителизацию. Зона
послеоперационного рубца была выстлана не многорядным эпителием, характерным для интактных
мочевыводящих путей и большей части имплантата, а однорядным и существенно уплощенным. Под
эпителиальной выстилкой хорошо прослеживались массивные поля соединительной ткани. Остальные
участки новообразованной стенки мочевого пузыря выглядели так же, как и в препаратах 3-месячного
контроля.
Обсуждение. Коллаген представляет собой фибриллярный белок, являющийся компонентом внеклеточного матрикса соединительных тканей [24, 25]. В организме наиболее распространен коллаген I типа [26].
Коллагены состоят из родственных молекул с некоторыми отличительными свойствами. Основная
единица – тропоколлагеновая молекула и включает три полипептидные цепи. Для первичной структуры молекулы коллагена характерно чередование неполярных и полярных участков. Строение неполярных участков однородно. Это последовательность гли-про-Х, где X – любая аминокислота, чаще всего пролин и оксипролин. Полярные области, локализованные на N-терминальных участках каждой цепи, обладают глобулярной конформацией и чувствительны к атаке общих протеаз [19, 27, 28].
В связи с хорошей биосовместимостью, высокими механическими свойствами и способностью стимулировать регенерацию гладкомышечных клеток коллаген обеспечивает условия для формирования полноценной в функциональном отношении стенки мочевого пузыря.
Пластина “Коллост” представляет собой искусственную матрицу, волокна которой, образуя решетку,
создают основу для формирования новой ткани. Коллаген I типа, выступающий в роли внеклеточного матрикса, обеспечивает направляемый контакт эпителиальных клеток и фибробластов, создавая их оптимальную миграцию и ориентацию, тем самым связывает клетки для формирования новой
ткани. Фибробласты, кровеносные и лимфатические сосуды, нервные волокна из окружающей здоровой ткани, внедряясь в коллагеновую матрицу, распространяются строго по ней.
В более отдаленный период, уже через 3 мес., резервуарная функция мочевого пузыря восстанавливалась и практически соответствовала норме. Отмечено снижение максимального давления детрузора, развиваемого во время стационарной фазы реакции на инфузию, в связи с уменьшением сократительной способности мочевого пузыря за счет аугментации участка стенки динамически неактивной коллагеновой мембраной.
Развиваемое детрузорное давление во время сокращения снижалось в первые недели исследования
более чем в 10 раз, что обусловлено реакцией оперированного пузыря на травму, соответствовало
уровню субкомпенсации спустя 3 мес. и восстанавливалось к 6-му. В сроки 1,0 и 1,5 года отмечено увеличение накопительной функции мочевого пузыря при сохраненных параметрах детрузорного
давления. Данный эффект, по-видимому, достигался за счет как частичной регенерации мышечных
элементов в пересаженном коллагеновом материале, так и адаптогенной компенсаторной гипертрофии незамещенной части мышечной стенки мочевого пузыря.
Результаты гистологического исследования выявили хорошую эпителизацию большей части поверхности имплантата уже через 2 нед. после операции, хотя даже в отдаленные сроки (через 3 и 6 мес., 1 и 1,5 года) обнаруживались отдельные участки, покрытые однослойным атрофичным эпителием. Кроме того, мы выявили регенерацию мышечных элементов, происходящую скорее всего за счет проникновения лейомиоцитов из окружающих тканей, причем к 3-месячному сроку мышечные клетки формировали выраженные пучки волокон, что свидетельствует о возможности частичного восстановления сократительной функции этих участков новообразованной стенки мочевого пузыря.
Важными положительными моментами, выявленными нами, стали слабовыраженная воспалительная
реакция в ответ на имплантат, а т акже быстрая и активная реваскуляризация имплантата, что создает благоприятные условия для регенерационных процессов.
Заключение. Полученные результаты свидетельствуют о том, что расширяющая цистопластика с
использованием биополимера “Коллост” обеспечивает хорошие функциональные результаты в отдаленном периоде: близкие к нормальным значениям показатели эвакуаторной и резервуарной функций реконструированного мочевого пузыря при увеличенной функциональной емкости.
Коллагеновая мембрана обеспечивает надежное восстановление анатомической целостности резецированного мочевого пузыря. Резервуарная и сократительная функции мочевого пузыря после
расширяющей пластики коллагеновой мембраной I типа соответствуют таковым в контрольной группе.
Постепенная эпителизация имплантата, врастание гладкомышечных клеток, фибробластов и кровеносных сосудов в коллагеновую матрицу способствуют полноценной регенерации компонентов стенки мочевого пузыря, приближая ее строение к норме. Морфологические изменения в стенке реконструированного мочевого пузыря соответствуют динамичному восстановлению его функциональных параметров.



