Введение. Проблема поверхностного рака мочевого пузыря (РМП) не перестает волновать ученых всего мира. Сложность этиологии, патогенеза, большая вариабельность клинической картины, разнообразность морфологических форм, наличие тяжелых осложнений, которые нередко приводят к инвалидности, а иногда и к летальному исходу, дают основание считать эту проблему актуальной и до конца нерешенной [1–5].
Наличие различных взглядов на подходы к лечению поверхностного РМП (ПРМП), разнообразие противоопухолевых препаратов, различное трактование их лечебного эффекта и применение по своей методике способствовали разработке множества методов лечения и применения их на разных стадиях развития ПРМП [6, 7].
Однако усилия в поиске новых путей введения лекарственных препаратов при ПРМП с целью профилактики рецидива заболевания привели к проведению ряда исследований, которые, однако, не внесли ясности в решение данной проблемы [8].
Митомицин-С является одним из химиопрепаратов, которые чаще всего используются в лечении рака мочевого пузыря (РМП), особенно его поверхностных форм. В доступной литературе мы не нашли данных о реакции уроэпителия в ответ на контакт с митомицином-С. Также отсутствуют данные об изменениях в подслизистой оболочке и в мышечном слое.
 Цель исследования — определить реакцию тканей мочевого пузыря (МП) на подслизистое введение раствора митомицина-С в разных концентрациях.
Цель исследования — определить реакцию тканей мочевого пузыря (МП) на подслизистое введение раствора митомицина-С в разных концентрациях.
Материалы и методы. Опыты были проведены на 12 половозрелых собаках разного пола массой тела 10–15 кг. Оперативное вмешательство проводили в условиях асептики и антисептики под внутриплевральным тиопенталовым наркозом (30–40 мг/кг) через 30 мин после премедикации 1%-ным раствором димедрола (3–5 мл) и 25%-ным раствором аминазина (1–2 мл) подкожно. Нижнесрединным доступом вскрывали брюшинную полость. После вскрытия мочевого пузыря раствор митомицина-С концентрации 0,1, 0,05, 0,025 и 0,0125% вводили в подслизистую основу МП с экспозицией 1, 2 и 3 ч, а также на 7-е, 14 и 30-е сутки. Использование различных концентраций митомицина-С дало возможность сравнить реакцию тканей мочевого пузыря в зависимости от сроков от начала его введения.
Животных в указанные сроки передозировкой наркоза выводили из эксперимента. После макроскопического изучения слизистой оболочки МП кусочки его стенки размерами 0,5х0,5 см помещали для фиксации в 10%-ный раствор нейтрального формалина. В дальнейшем после обезвоживания в спиртах заливали в парафин. Гистологические препараты окрашивали гематоксилином и эозином и по методу Ван–Гизона.
Результаты. Реакцию тканей МП на введение раствора митомицина-С в подслизистую основу мы оценивали не только в первые часы, но и в значительно отдаленные сроки.
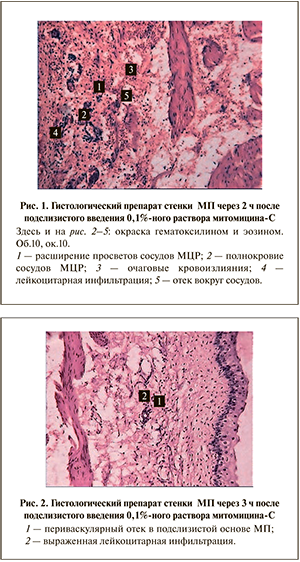
Гистологическое исследование реакции тканей МП на введение митомицина-С начали с концентрации 0,1%. Установлено, что через 1 ч после введения митомицина-С в подслизистой основе МП просветы кровеносных сосудов микроциркуляторного русла (МЦР) были расширены, полнокровны, с незначительным отеком вокруг них, имели место также лейкоцитарная инфильтрация и выраженный отек тканей вокруг сосудов. В просветах венул наблюдали скопление и краевое стояние лейкоцитов с их диапедезом. В прослойках соединительной ткани, разграничивающей пучки гладких миоцитов, отмечали незначительный отек и единичные лейкоциты в периваскулярных пространствах.
Спустя 2 ч после введения 0,1%-ного раствора митомицина-С в подслизистой основе наблюдали те же изменения, что и через 1 ч, однако определялись более выраженная лейкоцитарная инфильтрация и увеличение количества очагов кровоизлияния. Изменения, которые возникли в мышечной оболочке через 2 ч, соответствовали тем же, что через 1 ч от начала введения, однако просветы сосудов МЦР были более расширены, полнокровны, с незначительным периваскулярным отеком (рис. 1). Через 3 ч констатировали полнокровие сосудов МЦР, расширение просвета с периваскулярным отеком и выраженной лейкоцитарной инфильтрацией. В мышечной оболочке наблюдалась незначительная инфильтрация лейкоцитами соединительной ткани (рис. 2).
Через 1 ч после подслизистого введения раствора митомицина-С в концентрации 0,05% гистологические изменения проявились расширением просвета и полнокровием сосудов МЦР, но в меньшей степени – через 1 ч после введения 0,1%-ного раствора. В слизистой оболочке отметили наличие лейкоцитов. В мышечной оболочке гистологические изменения были не выражены и соответствовали таковым при введении 0,1%-ного раствора.
Подобные гистологические изменения мы наблюдали и через 2 ч, однако их интенсивность была значительно меньше по сравнению с таковой через 1 ч. Мы отмечали незначительный отек и лейкоцитарную инфильтрацию вокруг сосудов интерстиция. Как и в предыдущих наблюдениях, просветы лимфатических сосудов были расширенными. В мышечной оболочке отек соединительной ткани был незначительным. Невыраженным также было расширение просвета кровеносных сосудов МЦР. Через 3 ч вокруг кровеносных сосудов МЦР наблюдали незначительный периваскулярный отек, лейкоцитарную инфильтрацию, расширение и полнокровие сосудов слизистой оболочки. Клетки уротелия оставались неизмененными, однако присутствовала миграция лейкоцитов через эпителиальный слой. Незначительная лейкоцитарная инфильтрация вокруг сосудов соединительной ткани отмечена между пучками миоцитов. Увеличение численности лимфоцитов в эпителиальном слое слизистой оболочки стенки МП указывает на усиление клеточного иммунитета.
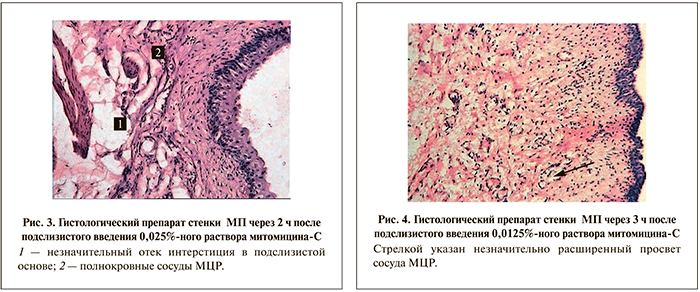
Через 1 ч после введения 0,025%-ного раствора в подслизистой основе наблюдалось хотя и незначительное, но расширение просветов сосудов МЦР с лейкоцитарной инфильтрацией вокруг них. Полнокровие и отек были также незначительными. Через 2 ч отмеченные выше явления вокруг сосудов МЦР сохранялись, но их выраженность была значительно меньше (рис. 3).
Через 3 ч изменения в подслизистой основе были подобны таковым, имевшим место на предыдущих сроках исследования, однако их интенсивность постепенно уменьшалась. Мышечная оболочка практически не отличалась от мышечной оболочки здоровых животных. Также мы заметили более выраженную лейкоцитарную инфильтрацию эпителиального слоя с преобладанием лимфоцитов и гипертрофией фибробластов.
Введение митомицина-С в концентрации 0,0125% обусловило появление минимального отека интерстиция подслизистой основы с последующим его уменьшением через 3 ч от начала исследования.
Аналогичная картина отмечена в динамике изменений лейкоцитарной инфильтрации в подслизистой основе. По истечении 3 ч констатировано незначительное расширение просвета сосудов их МЦР.
Гистологическое исследование тканей МП показало, что наименее пагубное воздействие оказывает подслизистое введение 0,0125%-ного раствора митомицина-С (рис. 4), поэтому для определения реакции тканей МП в отдаленные сроки (7-е, 14 и 30-е сутки) мы использовали данную концентрацию препарата.
На вскрытии животных, выведенных из эксперимента через 7 сут, макроскопическая картина слизистой оболочки МП на всем протяжении была аналогичной таковой у интактных животных (рис. 5).
Микроскопическое исследование участков МП позволило установить отсутствие изменений в поверхностном, промежуточном и базальном слоях уротелия. В подслизистой основе, в отличие от 3-часового срока, отсутствовали тромбы в мелких сосудах, воспалительная инфильтрация и отек. Местами вокруг сосудов была отмечена гистиолейкоцитарная инфильтрация за счет макрофагов, моноцитов, лимфоцитов. Отмечали незначительное полнокровие сосудов микроциркуляторного русла подслизистой основы и мышечной оболочки.
У животных, которые были выведены из опыта через 14 дней, при вскрытии макроскопических изменений в серозной оболочке МП не обнаружено. Слизистая оболочка была обычного цвета, без дефектов с хорошо выраженными складками. При микроскопическом исследовании изменений уротелия не обнаружено. В подслизистой основе, в отличие от предыдущего срока наблюдения, гистиоцитарная инфильтрация и отек вокруг сосудов были значительно меньше.
В отдаленных местах от введения лекарственного вещества вышеуказанные явления отсутствовали. Также следует особо отметить уменьшение количества сосудов по сравнению с предыдущим сроком наблюдения, незначительную пролиферацию фибробластов и отсутствие изменений в нервных окончаниях данной оболочки. Мышечная оболочка МП была подобна таковой у интактных животных.
Отдаленным сроком исследования после подслизистого введения 0,0125%-ного раствора митомицина-С были 30-е сутки. Так, у выведенных из опыта животных на вскрытии макроскопически МП был без изменений. Гистологически слизистая оболочка не отличалась от слизистой оболочки здоровых животных. В подслизистой основе, в отличие от предыдущего срока, кое-где наблюдали незначительную диффузную лимфогистиоцитарную инфильтрацию. Подслизистая основа в основном сохраняла свое привычное строение.
Мышечная оболочка МП имела строение, подобное таковой у интактной группы животных. Между волокнами рыхлой соединительной ткани перимизия наблюдали уменьшение количества сосудов и уменьшение пролиферации фибробластов.
Следует отметить, что подслизистое введение противоопухолевого препарата не влияет на общее состояние животных, на что указывало нормальное количество лейкоцитов и эритроцитов в плазме крови.
Обсуждение. В ходе проведенного исследования было установлено, что при подслизистом введении митомицина-С любой концентрации — от 0,1 до 0,0125% – изменений в клетках слизистой оболочки не происходит. Воспалительная реакция в основном наблюдалась в подслизистой основе МП.
Максимально выраженная воспалительная реакция в подслизистой основе (отек, очаги лимфогистиоцитарной инфильтрации, расширение просветов сосудов МЦР, диффузная лейкоцитарная инфильтрация вокруг сосудов соединительной ткани между мышечными волокнами) развивалась в первые часы в ответ на введение 0,1%-ного раствора исследуемого препарата, минимальной она была спустя 3 ч после применения 0,0125%-ного раствора.
Дальнейшие гистологические исследования позволили установить, что после введения 0,0125%-ного раствора реакция тканей МП на 7-е сутки сохраняется, а к 30-м суткам практически сходит на нет.
В местах, свободных от введения химиопрепарата, изменений в тканях МП не установлено.
Сохранение воспалительной реакции на введенный раствор митомицина-С позволяет косвенно судить о наличии лекарственного вещества в подслизистой основе МП.
Выводы
- Полученные данные свидетельствуют о том, что 0,0125%-ный раствор митомицина-С является наиболее безопасным при его подслизистом введении в стенку МП.
- Митомицин-С в виде 0,0125%-ного раствора можно использовать в лечении больных ПРМП.
- Необходимо проводить дальнейшие экспериментальные исследования новых противоопухолевых препаратов для внутрипузыного применения при ПРМП.



