Введение. Накопленный в мировой практике опыт изменил взгляды урологов на вопросы, касающиеся наблюдения и лечения пациентов с аденомой предстательной железы (АПЖ). Последние научные
разработки свидетельствуют о том, что во многих случаях достаточно сложно установить непосредственную связь между симптомами заболевания и гиперплазией простаты [1]. Клинические проявления АПЖ ассоциированы с увеличением железы, наличием инфравезикальной обструкции, проявляются обструктивными и ирритативными симптомами, как правило, являющимися поводом для
обращения к врачу и назначения медикаментозной терапии. Согласно последним клиническим
рекомендациям Европейской ассоциации урологов (2011), для лечения ненейрогенных расстройств
мочеиспускания и симптомов, связанных с АПЖ, используются как традиционные, так и новые методы терапии. Необходимость назначения больным АПЖ лекарственных средств на длительный срок
ставит вопросы безопасности и переносимости лечения на первый план, в связи с чем приоритетным
направлением медицины становятся разработка и клиническое испытание используемых препаратов.
В 2001 г. в нашей стране зарегистрирован и разрешен к применению отечественный препарат афала,
созданный на основе антител к простатспецифическому антигену (анти-ПСА). В течение 10 лет
проводились клинические исследования его эффективности и безопасности [2–12], одно из которых
проходило на базе урологической клиники РНИМУ им. Н.И. Пирогова (2008–2010). Целью двойного слепого плацебо-контролируемого рандомизированного клинического исследования (КИ) была
оценка влияния афалы на выраженность симптомов заболевания, показатели урологического обследования, качество жизни пациентов, уровень ПСА и половых гормонов в процессе 6-месячного курса терапии.
Материалы и методы. В КИ приняли участие 94 пациента с верифицированным на основании результатов клинико-инструментального обследования диагнозом АПЖ I (компенсированная) и II (субкомпенсированная) стадии согласно клинической классификации этого заболевания [13]. Все пациенты соответствовали следующим критериям включения: возраст от 45 до 75 лет; суммарный балл выраженности симптоматики АПЖ в соответствии с Международной системой оценки заболеваний простаты (International Prostate Symptom Score – IPSS) от 10 до 20; максимальная скорость потока мочи (Qmax) по результатам урофлоуметрии от 5 до 15 мл/с; объем предстательной железы по данным трансректального ультразвукового исследования (ТРУЗИ) – более 30 см3, объем остаточной мочи – не более 150 мл. В исследование не включали пациентов с острыми инфекционными заболеваниями мочеполовой системы, новообразованиями, декомпенсированными заболеваниями, предшествовавшими оперативными вмешательствами на предстательной железе или мочевом пузыре, наличием показаний к оперативному лечению.
После включения в КИ пациентов рандомизировали в группу приема афалы (n=61) или плацебо (n=33) по 2 таблетки 4 раза в день вне связи с приемом пищи. Продолжительность лечения составила 6 мес., последующего наблюдения – 3 мес. В течение всего КИ пациент мог получать терапию сопутствующих заболеваний, за исключением препаратов, оказывающих влияние на функцию предстательной железы и/или мочевого пузыря.
Первичной конечной точкой исследования было уменьшение выраженности симптоматики заболевания по данным суммарного балла по шкале IPSS к окончанию курса лечения. Вторичные конечные
точки – влияние терапии на максимальную скорость мочеиспускания, качество жизни, сексуальную активность пациентов, уровень различных форм ПСА и гормонов (тестостерона, дигидротестостерона, пролактина) в сыворотке крови.
Исследуемые группы были сопоставимыми по исходным социально-демографическим и клиническим характеристикам. Средний возраст пациентов группы афалы составил 66,2±6,9 года (от 46 до 75
лет), группы плацебо – 65,8±6,7 (от 51 года до 75 лет); давность заболевания – 7,4±4,34 и 7,7±5,15 года соответственно. Все пациенты имели характерные обструктивные и ирритативные симптомы заболевания. Большинство больных предъявляли жалобы на прерывистость струи мочи (63%; n=53), ощущение неполного опорожнения мочевого пузыря (66%; n=55), повышенную частоту мочеиспускания (69%; n=58), невозможность быстро начать мочеиспускание (71%; n=60), учащенное мочеиспускание ночью (79%; n=66); почти все пациенты отмечали ослабление струи мочи (98%; n=82). Среди сопутствующих заболеваний в исследуемых группах отмечены артериальная гипертензия (70%), ишемическая болезнь сердца (69%); сахарный диабет (10%); бронхиальная астма (5%), гастрит (5%). Предшествовашая терапия АПЖ 50% пациентов включала α-адреноблокаторы (омник, зоксон, сетегис, артезин), 43% – средства, влияющие на обмен веществ в предстательной железе (витапрост, тыквеол, простамол).
В процессе лечения пациенты наносили врачу по 6 ежемесячных плановых визитов, в ходе которых
выполнялись клинико-инструментальные и лабораторные исследования, оценивалась эффективность и
безопасность терапии. Через 3 мес. после окончания лечения на визите follow-up проведено отсроченное обследование.
Шесть пациентов группы афалы и четыре – группы плацебо были досрочно исключены из исследования из-за их нежелания продолжать участие в нем. В окончательный анализ вошли результаты наблюдения 84 пациентов, завершивших участие в КИ согласно протоколу; в анализ по оценке безопасности – данные всех 94 включенных в КИ пациентов. Обработка результатов исследования проведена с использованием статистического пакета SAS-9.2. Применялись методы параметрической (для непрерывных и интервальных переменных) и непараметрической (частотный анализ по категориальным переменным) статистики.
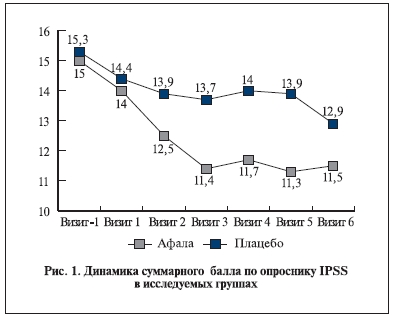
Результаты. Изменение выраженности симптоматики заболевания по данным суммарного балла
опросника IPSS в процессе лечения (визиты 1–6) по сравнению с исходным состоянием (визит -1) представлено на рис. 1. Если первоначальное среднее значение по шкале IPSS в сравниваемых группах было одинаковым (15,0±3,3 и 15,3±4,2 балла в группе афалы и плацебо соответственно), то последующие оценки по шкале IPSS свидетельствовали о более выраженной положительной динамике показателя в группе активного препарата. В течение 6-месячного курса лечения суммарный балл по шкале IPSS в группе афалы снизился до 11,5±5,4 (против 12,9±6,4 в группе плацебо). Ковариационный дисперсионный анализ ANCOVA ежемесячных оценок выраженности симптомов по шкале IPSS с включением факторов Визит и Препарат свидетельствовал о значимости их взаимодействия: показатели групп афалы и плацебо достоверно различались в процессе лечения (F5/405=2,52; p=0,047). Оценка относительного снижения суммарного балла по шкале IPSS в исследуемых группах с помощью двуфакторного дисперсионного анализа ANOVA, учитывавшего факторы Визит и Препарат, также продемонстрировала статистическую значимость обоих исследуемых факторов, что свидетельствовало о более выраженной клинической эффективности афалы по сравнению с плацебо (Препарат: F1=14,0; p=0,0002; Визит: F5=3,2; p=0,008).
Рисунок 2. Доля пациентов с величиной сумарного балла по шкале IPSS не менее 8 в динамике наблюдения.
На каждом этапе лечения в исследуемых группах рассчитывалась доля пациентов, у которых тяжесть
симптомов заболевания достигала минимальной степени, что подтверждалось снижением суммарного балла по шкале IPSS ниже 8 (рис. 2). Сравнение показателя в обеих группах в динамике 6 визитов по
критерию Cochran–Mantel–Haenszel выявило значимое превосходство афалы по сравнению с плацебо
(χ2(1)=5,1; p=0,025), которое проявлялось уже спустя месяц лечения: удельный вес пациентов со слабовыраженными симптомами болезни составил 15 и 10% соответственно. К окончанию курса терапии это соотношение увеличилось до 24 и 14% соответственно. Более того, результаты последующего наблюдения с оценкой обструктивной и ирритативной симптоматики свидетельствовали о стойком последействии проведенного лечения: на визите followup; доля участников исследования, имевших легкую степень симптоматики заболевания, в группе афалы сохранилась практически на прежнем уровне (22%), в то время как в группе плацебо этот показатель снизился в 2 раза и составил всего 7% (рис. 2).
Прием афалы способствовал снижению степени тяжести субъективных и объективных симптомов
АПЖ в процессе лечения. Наиболее значимыми были изменения выраженности ирритативной симптоматики. Результаты анализа с применением критерия χ2 в модификации Cochran–Mantel–Haenszel демонстрировали, что афала статистически значимо превосходила плацебо по влиянию на такие симптомы, как “повышенная частота мочеиспусканий” (χ2(1)=4,3; p<0,04), “учащенное мочеиспускание ночью” (χ2(1)=8,1; p<0,005), “болезненное мочеиспускание” (χ2(1)=12,9; p<0,001), “подтекание мочи каплями” (χ2(1)=6,3; p<0,012). Терапия исследуемым препаратом способствовала значимому уменьшению доли пациентов, отмечающих “невозможность быстро начать мочеиспускание” (χ2(1)=20,5; p<0,001), “чувство неотложности мочеиспускания” (χ2(1)=11,8;
p<0,001). Кроме того, статистически значимые отличия были получены в отношении обструктивной
симптоматики: “ослабление струи мочи” (χ2(1)=21,9; p<0,001) – по сравнению с исходным состоянием, “ощущение неполного опорожнения мочевого пузыря” (χ2(1)=14,7; p<0,001) – при сравнении с плацебо-терапией. Следствием снижения степени выраженности дизурии было значимое улучшение ночного сна к окончанию терапии (χ2(1)=9,8; p<0,002).
По истечении 3 мес. приема афалы параллельно с уменьшением выраженности симптомов АПЖ
повышалась максимальная скорость мочеиспускания (+2,9 мл/с; +30,2%), за 6 мес. лечения среднее
значение Qmax возросло от исходных 9,3±2,9 мл/с до 14,1±5,7 мл/с (+4,8 мл/с; +51,6%) (табл. 1). Однако значимых различий (из-за малочисленности выборки пациентов) по сравнению с группой плацебо к окончанию курса терапии зарегистрировать не удалось. При оценке изменений среднего объема остаточной мочи и индекса качества жизни (QоL) была получена аналогичная, но статистически незначимая динамика: к концу периода терапии до 18,9% снизился удельный вес пациентов, у которых по результатам ТРУЗИ определялась остаточная моча; индекс QоL возрос более чем на 20%.
Таблица 1. Динамика показателей Qmax, QoL и ICSex в процессе лечения.
Установлено, что афала не оказывала негативного влияния на состояние сексуальной функции
пациентов. Напротив, оценка ответов на вопросы опросника International Sexual Function Questionnarie (ICSex) [14] в группе активного препарата имели слабоположительную динамику, которая не достигала статистически значимых отличий от результатов плацебо-терапии (табл. 1).
Лабораторный мониторинг, проводимый 1 раз в 3 мес, свидетельствовал об отсутствии влияния приема афалы на содержание различных форм ПСА (общего, свободного и комплексного) в течение всего периода лечения. Концентрация общего и свободного тестостерона, дегидротестостерона и пролактина сыворотки крови колебалась в пределах нормальных значений (табл. 2).
Таблица 2. Содержание различных форм ПСА и гормонов в сыворотке крови на фоне терапии.
В ходе исследования не было зарегистрировано нежелательных эффектов либо отклонений биохимических показателей, изменений в клинических анализах крови и мочи, связанных с проводимой
терапией, что наряду с показателями уровней ПСА и гормонов подтверждало безопасность проводимой в течение 6 мес. терапии.
Обсуждение. Результаты исследования демонстрируют, что лечение афалой в дозировке 2 таблетки
4 раза в день в течение 6 мес. эффективно и безопасно для пациентов с АПЖ I–II стадий.
Эффективность терапии афалой проявилась в значимом снижении степени выраженности нарушений мочеиспускания по отношению к исходному показателю и по сравнению с плацебо-терапией. Уменьшая выраженность дизурии, прием афалы приводил к увеличению доли пациентов со слабой выраженностью симптомов АПЖ (суммарный балл по шкале IPSS<8) к окончанию периода лечения. Наиболее выраженные терапевтические эффекты препарата зарегистрированы в отношении ирритативной симптоматики АПЖ.
Максимальная скорость мочеиспускания по данным урофлоуметрии через 6 мес. лечения афалой
возрастала более чем на 50% (+4,8 мл/с). Из-за малочисленности выборки пациентов, участвовавших в данном исследовании, значимых различий по сравнению с группой плацебо выявить не удалось.
Однако стоит отметить, что аналогичные результаты дает терапия α-адреноблокторами. Для сравнения: 4-месячный прием тамсулозина приводит к увеличению Qmax на 4,9–5,2 мл/с [15], а 6 мес. лечения теразозином – на 2,6–2,9 мл/с [16].
Проведенное исследование показало, что курс лечения афалой имеет стойкое последействие:
результаты отсроченного обследования свидетельствовали о надежном восстановлении функциональных нарушений со стороны нижних мочевыводящих путей. Значимая клиническая эффективность препарата, зарегистрированная на первом после начала терапии визите, сохранялась не только на протяжении всего 6-месячного курса терапии, но и спустя 3 мес. после его окончания.
Отмеченные эффекты терапии, очевидно, являются следствием модулирующего воздействия антиПСА на функциональную активность молекулымишени – калликреина 3 (KLK3) – компонента калликреин-кининовой системы, играющего важную роль в регуляции различных процессов на клеточном, тканевом и органном уровнях [17]. Показано влияние KLK3 на внутрисосудистую коагуляцию, формирование эндотелиоцитов, тканевую перфузию, оксигенацию клеток, функции инсулиноподобных факторов роста (IGF-I, IGF-II) и связывающих их белков (IGFBP-II, IGFBP-III), пролиферацию Т-лимфоцитов и созревание дендритных клеток, секрецию γ-интерферона NK-клетками и др. [18–24]. Положительное влияние препарата на пациентов с АПЖ связано прежде всего с улучшением гемоциркуляции и трофических процессов в предстательной железе и нижних отделах мочевыводящих путей [2, 4, 10], что опосредованно сказывается на клинических проявлениях заболевания.
Позитивная динамика в симптоматике АПЖ сопровождалась улучшением качества жизни пациентов (увеличением индекса QоL на 23% за полгода), нормализацией ночного сна. Длительный прием афалы, по мнению пациентов (опросник ICSex), не имел негативных последствий и не влиял на их сексуальную функцию.
Важным моментом исследования была оценка влияния 6-месячной терапии афалой на показатели ПСА
и гормонального профиля. Содержание общего, свободного и комплексного ПСА в крови оставалось в
пределах нормы в течение всего периода лечения, что является значимым показателем безопасности
терапии. Отсутствие изменений концентрации ПСА на фоне длительного приема афалы позволяет проводить динамическое наблюдение пациентов с АПЖ и мониторинг уровня ПСА с целью ранней диагностики рака простаты по общепринятым стандартам в отличие, например, от терапии ингибиторами 5α-редуктазы [25, 26]. Шестимесячный прием афалы не оказывал клинически значимого негативного
влияния на гормональный статус пациентов, включая уровни тестостерона (общего и свободного),
дигидротестостерона, пролактина, что также является показателем безопасности терапии.
Заключение. Таким образом, апробированная в ходе данного исследования схема лечения может
быть рекомендована для применения в клинической практике. Постепенное развитие клинического
эффекта обусловливает целесообразность длительного курсового приема афалы, а стойкое последействие свидетельствует о значимом корригирующем влиянии препарата на уродинамику нижних мочевыводящих путей. Результаты исследования подтвердили, что афала является эффективным, безопасным и надежным лекарственным средством в лечении пациентов с АПЖ I–II стадий.



