Введение α1-Адреноблокаторы (α1-АБ) применяются для коррекции расстройств мочеиспускания более трех десятилетий [1–4]. К началу третьего тысячелетия консервативная терапия аденомы предстательной железы (АПЖ) стала подразумевать использование минимум двух групп препаратов, а именно α1-АБ и ингибиторов 5α-редуктазы (5ИАР) [5]. Вместе с этим следует отметить, что назначение α1-АБ или 5ИАР в качестве монотерапии в действительности трудно назвать высокоэффективным. Снижение выраженности клинической симптоматики на 6 баллов по шкале IPSS, как было продемонстрировано в известном исследовании COMBAT, по эффективности уступает комбинированной терапии α1-адреноблокатором альфузозином в комбинации с пикамилоном (снижение на 7 и более баллов всего за три месяца). В более ранних исследованиях с назначением доксазозина снижение выраженности симптомов происходило при более коротком назначении как в виде монотерапии, так и в комбинации с витаминами [6, 7]. Появление нового α1-АБ силодозина, с нашей точки зрения, позволяет лучше использовать уроселективные свойства этого лекарственного средства [8], особенно в комбинированной терапии с препаратами, меняющими обменные процессы как самого детрузора, так и управляющих структур поясничного утолщения спинного мозга, контролирующих его функцию [3, 6].
Нейрофизиологическая модель патогенеза тазовых нарушений позволяет совершенно иначе рассматривать причины появления расстройств мочеиспускания [9]. Вместе с этим на основе нейрофизиологической модели можно создавать принципиально различные варианты терапии расстройств мочеиспускания, поскольку, согласно предлагаемой концепции, причины их формирования наиболее часто располагаются «вне интересов предстательной железы».
Целью исследования было изучение эффективности применения урорека (силодозин) в комбинированной терапии с пикамилоном и карнитоном больных аденомой предстательной железы.
Материалы и методы. Под нашим наблюдением находились 17 пациентов с АПЖ. Средний возраст больных составил 61±1,7 года. Критерии включения в исследование учитывались согласно рекомендациям Совета экспертов по лечению АПЖ [5] и определялись понятием «стандартный больной».
Возраст более 50 лет, при обследовании не обнаружен рак простаты. Включенным в группу наблюдения ранее не проводилась терапия в связи с АПЖ. У пациентов не выявлены сахарный диабета и диабетическая нейропатия, резистентные к терапии. Помимо этого в группу наблюдения не включены пациенты, имевшие неврологические заболевания, или пациенты, ранее оперированные в связи с АПЖ.
 Увеличение простаты было верифицировано с помощью УЗИ, все замеры проведены в одном кабинете одним специалистом. Выраженность расстройств мочеиспускания оценивали по шкале IPSS. Было установлено, что корреляция между размерами простаты и выраженностью симптомов незначима (коэффициент корреляции – 0,34). Объем предстательной железы исходно составил 75 см3 при уровне простатспецифического антигена 3,08 нг/мл.
Увеличение простаты было верифицировано с помощью УЗИ, все замеры проведены в одном кабинете одним специалистом. Выраженность расстройств мочеиспускания оценивали по шкале IPSS. Было установлено, что корреляция между размерами простаты и выраженностью симптомов незначима (коэффициент корреляции – 0,34). Объем предстательной железы исходно составил 75 см3 при уровне простатспецифического антигена 3,08 нг/мл.
Исследование акта мочеиспускания осуществлено в естественных домашних условиях с помощью автономного урофлоуметра уродинамической системы УроВест СУРД-02. Полученные данные обработаны с применением программного обеспечения, входившего в комплект уродинамической диагностической системы и пакета MS OFFICE 7. Кроме этого проведены стандартные лабораторные исследования (анализы мочи, крови, определение уровня простатспецифического антигена в крови).
Все пациенты получали консервативную комбинированную терапию, включившую α1-АБ (силодозин 8 мг в сутки), L-карнитин (карнитон), витамины группы В и пикамилон. Длительность терапии составила в среднем 4,5 мес (от 8 до 37 нед). При снижении уровня симптоматики по шкале IPSS ниже уровня 7 единиц пациентам терапия отменялась.
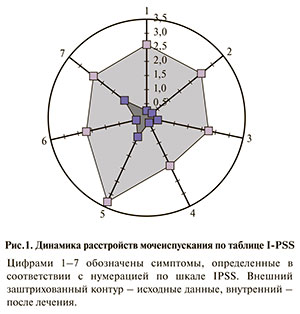
Результаты. Исходное состояние по шкале IPSS оценивалось в 17±1,53 балла. После назначения лечения и затем в ходе ее проведения нами было отмечено снижение уровня клинической симптоматики до 3,00±0,75 балла (т.е. в среднем на 14 баллов). Примечательно, что при этом никакой терапии, направленной на уменьшение размеров предстательной железы, не проводилось. Исходно соотношение обструктивной и ирритативной симптоматики выглядело как 8,1 к 8,9 балла. После терапии изменилось и стало 1,2 к 1,8. Можно предположить, что назначение силодозина в комбинации с карнитоном и пикамилоном приводит к улучшению функции детрузора, росту среднеэффективного объема, как следствие – к росту потока мочи. В результате такой терапии вполне закономерно ожидать исчезновения не только ирритативной, но и обструктивных симптоматики.
Как видно из рис. 1, изменения коснулись как ирритативной, так и обструктивной группы симптомов.
Как известно, шкала IPSS не идеальна, и хотя достоверность результатов оценки по табличному методу в нашем исследовании достаточно высока (p<0,01), сама шкала не может не вызывать сомнений в своей исходной концепции измерения разнородных симптомов. Дело в том, что с позиции математики IPSS не является интервальной шкалой, а поэтому выполнение арифметических операций над ее индексами не совсем корректно.
Уменьшение выраженности расстройств мочеиспускания, оцененные по вышеприведенной шкале, следует рассматривать как результат увеличения функциональной емкости мочевого пузыря, а не как следствие устранения инфравезикальной обструкции (ИВО). Речь может идти об изменении сенсорности детрузора при увеличении его функциональной емкости и нивелировании императивных позывов на мочеиспускание. Следствием этих изменений можно признать уменьшение поллакиурии с 2,5 до 0,3 и ноктурии с 2,4 до 1,0. Результатом стало также вполне закономерное улучшение качества жизни, о чем свидетельствовало снижение балла по шкале QоL с 3,9 до 1,6 (p<0,01).
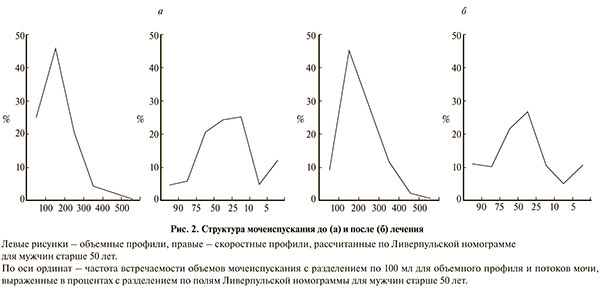
Не менее интересны изменения уродинамики нижних мочевыводящих путей, зафиксированные методом домашней урофлоуметрии (рис. 2). В результате терапии восстановились объемный и скоростной профили, увеличились показатели среднеэффективной емкости мочевого пузыря. Как видно из диаграммы, более чем вдвое уменьшилась частота встречаемости выпущенных объемов до 100 мл и также вдвое чаще стали регистрировать объемы более 300 мл. Считаем особо важным отметить, что удельный вес значений объемов и потоков с разбивкой на диапазоны и выраженный, соответственно, в процентах лучше отражает происходящие на фоне терапии изменения, чем отдельные усредненные показатели среднеэффективного объема мочевого пузыря. Совокупно объемный и скоростной профили составляют структуру мочеиспускания как интегральную характеристику опорожнения мочевого пузыря. Следствием изменения объемного профиля, возможно, стали изменения и скоростей опорожнения мочевого пузыря. Комбинация L-картнитина и силодозина в этом плане демонстрирует взаимодополняющий эффект, поскольку происходит улучшение не только накопительной способности мочевого пузыря, но и сократительной функции его детрузора. Результат – улучшение уродинамики нижних мочевыводящих путей. Динамика симптомов по шкале IPSS косвенно (в силу своей субъективности) это подтверждает.
Отмечен рост усредненного значения максимального потока мочи с 12,7 до 16,9 мл/с (р<0,01), что соотносится с фактом увеличения среднеэффективных объемов со 162 до 203 мл (p<0,05). Обращает на себя внимание, что рост потоков привел к изменению профиля скоростей опорожнения. В нижних центилях, в частности до линии 10-й центили Ливерпульской номограммы, отмечено уменьшение встречаемости значений потоков, следовательно, в целом можно уверенно говорить об улучшении опорожнения мочевого пузыря. Скоростной профиль в этом плане более показателен, чем просто констатация факта прироста величины максимальной скорости потока мочи. Кроме того, усредненный рост на 4,2 мл/с при назначении силодозина в комбинации с L-карнитином является более значимым, чем было показано ранее в исследованиях при назначении силодозина в монотерапии [10], когда рост показателей урофлоуметрии составил всего 2,8 мл/с против 1,5 при назначении плацебо.
Обсуждение. Если причиной расстройств мочеиспускания считать исключительно ИВО, вызванную увеличением размеров предстательной железы, то назначение предложенной комбинированной терапии и полученные результаты не имеют под собой основы и объяснения. Нам удалось достичь положительной динамики как по ирритативной, так и по обструктивной группе симптомов. Исходная концепция терапии основывалась на том, что расстройства мочеиспускания могут иметь совершенно различные причины возникновения и вообще могут быть никак не связанными с простатой. Любое уменьшение функциональной емкости мочевого пузыря, возникающее в связи с гипоксией или ишемией органа, приводит к появлению расстройств мочеиспускания [7]. Известно, что назначением терапии с точкой приложения в обменных процессах (детрузор не является исключением) удается нивелировать клиническую симптоматику практически полностью.
Выбор L-карнитина в данном случае обусловлен тем, что все препараты этой группы обладают свойствами, крайне полезными при ведении пациентов зрелого и пожилого возраста. Поскольку карнитин улучшает энергообмен в мышечных клетках и нейронах, его назначение повышает работоспособность и закономерно должно улучшать контроль над мочевым пузырем, а также сократительную способность детрузора при длительном приеме. Следует также учесть, что в подавляющем большинстве случаев у пожилых людей содержание L-карнитина в организме значительно снижено.
Таким образом, при длительном назначении комбинированной терапии силодозином и L-карнитином пациентов с АПЖ на практике наблюдается интересная картина. В результате воздействия на структуры нервной системы, управляющие функцией мочевого пузыря, расположенные в поясничном утолщении спинного мозга (α1-АБ имеют точку приложения в первую очередь именно на управляющие структуры), клиническое улучшение происходит быстрее, чем при комбинированном воздействии α1-АБ и 5ИАР на простату. Такой вывод напрашивается сам собой, если посмотреть результаты исследования COMBAT. Помимо этого с помощью α1-АБ и L-карнитина устраняется или нивелируется важный фактор, обусловливающий уменьшение среднеэффективной емкости мочевого пузыря. Увеличение этого показателя, естественно, должно сопровождаться уменьшением поллакиурии, числа императивных позывов на мочеиспускание в сутки, увеличением скорости опорожнения мочевого пузыря. Как показали ранее проведенные исследования Е. Л. Вишневского [4,7], только в том случае, когда ИВО будет носить характер стабильной «органической» обструкции, значимо не будет меняться показатель потока мочи. На этом основаны фармакоуродинамические пробы с α1-АБ [7].
В результате расстройства мочеиспускания нивелируются или смягчаются раньше, чем происходит улучшение уродинамики. В нашем исследовании этот эффект также имел место. Как известно, ни α1-АБ, ни L-карнитин не способны оказать влияние на ИВО. Тем не менее этот и подобные эффекты легко объяснимы с позиции нейрофизиологической модели патогенеза расстройств мочеиспускания, представленной в 2010 г. В. В. Даниловым и соавт. [9].
Нейрофизиологическая модель патогенеза расстройств мочеиспускания позволяет совершенно иначе взглянуть на эту проблему больных АПЖ. Во-первых, возраст и сосудистые заболевания должны оказывать существенное влияние на результаты терапии. Во-вторых, ишемия поясничного утолщения спинного мозга может иметь как обратимый, так и необратимый характер. Во втором случае, когда будет пройдена так называемая точка невозврата, терапия будет неэффективной вне зависимости от фактора, вызвавшего ИВО. Важно и другое: согласно концепции нейрофизиологической модели, терапия всегда должна включать не только лекарственные средства класса α1-АБ, но и препараты, улучшающие обменные процессы, например, карнитиновой группы и пикамилон, а также обязательно витамины группы В.
Это важно понимать, поскольку ИВО у больных АПЖ является далеко не единственной и главной проблемой расстройств мочеиспускания [7]. Как известно, расстройства мочеиспускания могут возникать задолго до роста аденоматозных узлов и существовать независимо от наличия АПЖ. Но снижение качества жизни больше определяется такими составляющими, как поллакиурия и императивные позывы на мочеиспускание, чем сниженным потоком мочи или затрудненным мочеиспусканием. Именно поэтому происходит постепенный отказ от оперативного лечения в пользу консервативной терапии. Как следует из концепции нейрофизиологической модели патогенеза расстройств мочеиспускания, на величину среднеэффективной емкости мочевого пузыря куда большее влияние должна оказывать ишемия поясничного утолщения спинного мозга, нежели сама простата. Помимо этого сам характер опорожнения мочевого пузыря определяется не только проходимостью простатического отдела уретры, но и возможностью управления раскрытием шейки мочевого пузыря и мышцами тазового дна. Другими словами, для поясничного утолщения тазовое дно является таким же исполнительным органом, как и детрузор, и шейка мочевого пузыря. Управление со стороны сегментов L1 и S2-S4 спинного мозга как раз и обеспечивает автоматику процесса опорожнения мочевого пузыря. Следовательно, принципиально любые повреждения нейронов передних рогов поясничного утолщения спинного мозга закономерно должны приводить к нарушениям уродинамики нижних мочевыводящих путей и формировать клиническую картину расстройств мочеиспускания вне зависимости от состояния предстательной железы. Разумеется, вариант нарушения и сами проявления дисфункции могут быть различными в зависимости от уровня сегмента нейрона и степени его поражения.
Помимо объяснения причин как ирритативной, так и обструктивной симптоматики с позиции нейрофизиологической модели их возникновения можно обосновать также и варианты их патогенетической терапии. Поскольку ИВО развивается отдельно и прямой связи между выраженностью расстройств мочеиспускания и проходимостью уретры нет, назначение терапии имеет целью восстановление уродинамики нижних мочевыводящих путей и нивелирование расстройств мочеиспускания. Для этого необходимо дополнить терапию α1-АБ средствами «тканевой» терапии, а также ноотропными препаратами и витаминами, чтобы обеспечить нормализацию функции детрузора и адекватный пассаж мочи.
При ведении пациентов с АПЖ комбинированная терапия с назначением аминокислот и α1-АБ может быть первым этапом лечения. После устранения расстройств мочеиспускания могут быть подключены лекарственные средства группы 5ИАР или предложено оперативное лечение при формировании не поддающейся консервативной терапии ИВО. Кроме этого клиническая эффективность такой терапии является своего рода индикатором прогноза динамики заболевания. При прохождении «точки невозврата» оперативное лечение будет обоснованным вариантом ведения, поскольку шансов на успех консервативной коррекции расстройств мочеиспускания будет крайне мало.
Помимо L-карнитиновой группы как наиболее оптимальной при ведении пациентов с нейрогенной дисфункцией мочевого пузыря необходимо назначать витамины, в частности В1, В6, а также пикамилон и другие средства «тканевой терапии».
Заключение. Комбинированная терапия с назначением α1-АБ и L-карнитина является безопасным и эффективным вариантом устранения расстройств мочеиспускания у больных АПЖ. Совместное назначение этих препаратов предусматривает улучшение обменных процессов в стенке мочевого пузыря и как следствие – восстановление контроля над ним со стороны нервной системы, что также приводит к улучшению сократительной способности самого детрузора.


