Рак предстательной железы (РПЖ) – одно из наиболее часто встречающихся злокачественных новообразований у мужчин среднего и пожилого возраста. С конца 1970-х до начала 1990-х гг. частота раковых заболеваний предстательной железы почти удвоилась. В 2007 г. в США зарегистрировано 230 тыс. новых случаев заболевания. В структуре онкологических заболеваний в США РПЖ занимает 3-е место после рака легкого и желудка и 8-е место в России [1–3]. Столь широкое распространение РПЖ ставит его в ряд наиболее важных социальных проблем современности. Болезнь практически не возникает у лиц моложе 40 лет и становится все более частым явлением с каждым последующим десятилетием жизни [4]. Определение простатспецифического антигена (ПСА) в рамках скрининговых программ способствовало увеличению выявляемости РПЖ во многих странах.
В настоящее время «золотым» стандартом диагностики РПЖ является гистологическая оценка биоптатов, полученных при трансректальной тонкоигольной мультифокальной биопсии простаты под контролем УЗИ. При этом множество опухолей выявляется на ранних стадиях (Т1с).
Важным моментом в адекватной интерпретации результатов патоморфологического исследования биоптатов предстательной железы служит правильное и последовательное приготовление гистологических препаратов.
Патоморфолог должен поставить правильный диагноз и предоставить в заключении прогностическую информацию даже при наличии небольшого количества опухолевой ткани в биоптатах. Биоптаты предстательной железы являются одним из самых сложных материалов для гистологической оценки. Морфологическая идентификация минимального фокуса аденокарциномы представляет значительную трудность в связи с необходимостью дифференциальной диагностики микрофокуса аденокарциномы с множеством доброкачественных состояний. Для исключения диагностических ошибок прежде всего необходимы микропрепараты высокого качества, окрашенные гематоксилином и эозином, в особенно сложных случаях показано проведение иммуногистохимического исследования (34ßЕ12, p63 и др.) [5].
Кроме того, патоморфологу важно обладать сведениями об анамнезе пациента: возрасте, уровне ПСА, результатах пальцевого ректального и ультразвукового исследований, о принимаемых лекарственных препаратах.
На смену широко распространенной ранее секстантной биопсии пришла биопсия из 10–14 точек [6, 7]. В редких случаях выполняется сатурационная биопсия, рекомендованная при выявлении в анамнезе пациента простатической интраэпителиальной неоплазии (ПИН) или атипической мелкоацинарной пролиферации (АМП).
Существуют различные стратегии маркировки биоптатов. В некоторых учреждениях биоптаты из левой и правой долей присылаются в двух отдельно маркированных контейнерах. Биоптаты из одной доли помещаются в один блок, поэтому на микропрепарате оказывается от 3 до 7 фрагментов ткани простаты, что приводит к множеству артефактов проводки. Мы придерживаемся методики картирования ткани простаты при биопсии. При этом каждый столбик имеет собственную маркировку и помещается в отдельный контейнер. Таким образом, каждый столбик помещается в отдельный блок и на микропрепарате оценивается отдельно. Это не только сводит к минимуму количество артефактов, но и помогает спланировать постановку игл при брахиотерапии, решить вопрос о целесообразноки мочевого пузыря при радикальной простатэктомии, предсказать вероятность и локализацию экстрапростатической инвазии и позитивных краев резекции, спланировать ход повторных биопсий с забором большего количества фрагментов из зон выявления ПИН высокой степени и АМП [8–11].
Одной из трудностей, с которыми сталкивается патоморфолог при оценке биоптатов простаты, является их фрагментация. Последняя может произойти во время забора материала или его транспортировки. Для исключения фрагментации при транспортировке каждый фрагмент помещают в отдельный большой контейнер. В лаборатории контейнеры открывают строго по очереди, каждый кусочек помещают в отдельный контейнер с определенным номером.
С целью исключения ошибок маркировки мы проверяем все биоптаты во время заливки, микротомиии и непосредственно перед гистологическим исследованием. Для получения высококачественных микропрепаратов в нашей лаборатории используется современное оборудование: автомат для проводки, станция для заливки парафином, микротом с подачей срезов на воду и станция для окраски. Однако наибольшее значение, несомненно, имеет квалификация лаборанта-гистолога.
Следующим этапом является макроскопическое описание столбиков тканей. Были выработаны критерии макроскопической оценки биоптатов простаты. Такая оценка необходима для установления корреляции между количеством ткани, полученной при биопсии и при гистологическом исследовании. Особенно важно описывать размеры и количество столбиков тканей или их фрагментов. Должен быть отмечен цвет столбиков. Ткани желтого цвета могут быть расценены как жировая ткань или опухоль.
Морфология биоптатов предстательной железы
Доброкачественная ткань простаты. В настоящее время при интерпретации биоптатов простаты не рекомендуется использовать термин «аденоматозная гиперплазия, или доброкачественная гиперплазия, простаты», так как биоптаты включают преимущественно периферическую зону простаты, а гиперплазия развивается в промежуточной и центральной зонах [12–14]. Таким образом, при гистологической оценке биоптатов мы используем термин «доброкачественная ткань простаты». Доброкачественные железы характеризуются отсутствием цитологической и тканевой атипии, наличием базального слоя и отсутствием видимых ядрышек.
Воспаление. Очень часто в биоптатах простаты встречаются участки хронического воспаления, при этом выраженность воспалительной инфильтрации далеко не всегда коррелирует с клиническими проявлениями простатита. Воспаление в простате может приводить к существенному повышению уровня ПСА. В исследовании MagiGalluzi показано, что средний уровень ПСА при воспалении составляет 7,4 нг/мл [15].
К доброкачественным состояниям, имитирующим аденокарциному простаты, относятся:
Атрофия. Для атрофии характерны дольковая архитектура, уменьшение долькового/железистого соотношения; часто секреторные клетки уплощаются; возможно частичное отсутствие базального слоя.

Светлоклеточная крибриформная гиперплазия представляет собой внутрипротоковую пролиферацию цитологически доброкачественных мелких клеток со светлой цитоплазмой без видимых ядрышек. Характеризуется наличием полноценного базального слоя. Вызывает сложности в гистологической диагностике в связи с крибриформным строением.
Ткань семенных пузырьков в биоптате может потребовать дифференциальной диагностики с аденокарциномой. Морфологически ветвящиеся железы семенных пузырьков мелкие, плотно расположены друг к другу, ядра клеток характеризуются гиперхромазией и наличием видимых ядрышек. Тем не менее дифференциальная диагностика между РПЖ и нормальной тканью семенных пузырьков у опытного патолога не вызывает трудностей, поскольку клетки семенных пузырьков содержат желто-коричневый пигмент [16].
Аденоз (атипическая аденоматозная гиперплазия). По данным J. Epstein [17], частота встречаемости склерозирующего аденоза в тканях после трансуретральной резекции составляет 1,6%, в биоптатах простаты – 0,8%. Аденоз не считается предраковым состоянием, однако есть мнения о возможности развития из аденоза высокодифференцированных опухолей переходной зоны. Микроскопически аденоз характеризуется пролиферацией мелких ацинусов в пределах дольки. Иногда в фокусе аденоза отмечается увеличение ядер и появление ядрышек, в этом случае диагностируется атипическая аденоматозная гиперплазия. Базальный слой может быть прерывистым. Клиническая значимость аденоза состоит в том, что маленькие участки аденоза, попадающие в биоптат, трудно отличить от аденокарциномы [17].
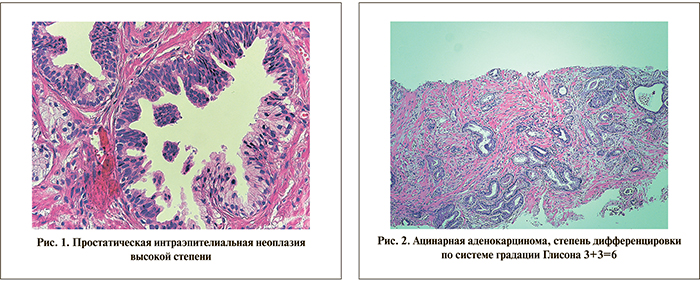
Простатическая интраэпителиальная неоплазия является предраковым заболеванием предстательной железы и требует выполнения повторной биопсии простаты. Чем больше выявляется желез с ПИН, тем больше вероятность выявления аденокарциномы простаты. По данным разных авторов, частота выявления ПИН в пункционных биопсиях, выполненных больным с подозрением на рак, варьируется в пределах от 8 до 50%, при этом РПЖ после повторных биопсий выявляется в 5–75% случаев [18–23]. Гистологически ПИН высокой степени характеризуется пролиферацией цитологически атипических клеток в пределах железы без выхода за базальную мембрану. Цитологическими критериями являются гиперхромазия ядер и появление видимых ядрышек. В настоящее время Всемирная организация здравоохранения отрицает возможность градации ПИН. Диагноз ПИН соответствует изменениям, характерным для ПИН только высокой степени (рис. 1).
Атипическая мелкоацинарная пролиферация – это чаще всего аденокарцинома простаты в объеме, не достаточном для постановки диагноза, т.е. термин, который патолог использует, когда фокус очень подозрительный на аденокарциному, но количество ацинусов или другие критерии не позволяют точно подтвердить диагноз. По результатам анализа данных гистологических исследований простаты нами было выделено четыре причины постановки диагноза АМП. Первая: присутствие в биоптате всего нескольких атипических желез, количество которых не позволяет морфологу поставить диагноз «аденокарцинома простаты». При этом эти ацинусы соответствуют всем морфологическим критериям аденокарциномы. По нашему мнению, диагноз «аденокарцинома простаты» не должен ставиться при количестве атипических ацинусов 5 и менее. Вторая причина: в биоптате присутствует несколько ацинусов, имеющих архитектурные критерии аденокарциномы, но не имеющих цитологических критериев, таких как увеличение ядра, гиперхромия ядра и цитоплазмы. Третья причина возникает при наличии нескольких мелких ацинусов с архитекторной атипией, но имеющих цитологическое искажение («смазанность» ядер, артефакты проводки), т.е. это изменения ткани, вызванные выполнением самой биопсии под воздействием физических сил, а также дефекты при работе с тканями. Также диагноз АМП может быть поставлен при наличии нескольких ацинусов с архитектурными и цитологическими критериями аденокарциномы, но ассоциированных с ПИН и невозможностью дифференцировать, являются ли эти мелкие ацинусы самостоятельными структурами, или «инвагинатами» желез с ПИН. Например, когда в препарате встречаются маленькие атипические железы и рядом большая железа с ПИН, в этом случае понять, самостоятельные это железы или «хвостики-инвагинаты» железы с ПИН невозможно. Чаще всего имеет место первая причина. По данным литературы, АМП встречается в 0,4–3,4% случаев, однако существует мнение, будто при правильной гистологической диагностике доля АМП не должна превышать 5–6% [24]. Для того чтобы исключить путаницу между различными гистологическими понятиями в случае АМП, предлагаем использовать общепринятую международную формулировку: атипическая мелкоацинарная пролиферация, очень подозрительная на аденокарциному предстательной железы, но критериев недостаточно для постановки диагноза «рак предстательной железы».
Аденокарцинома предстательной железы
В большинстве случаев злокачественные новообразования простаты представляют собой аденокарциному, редко встречаются первичный переходноклеточный рак и мезенхимальные опухоли простаты.
Оценка степени дифференцировки аденокарциномы производится согласно шкале Глисона, которая не потеряла своей актуальности и служит «золотым» стандартом стадирования аденокарциномы простаты, несмотря на то что была предложена американским патологом Дэвидом Глисоном еще в 1965 г.
Основным принципом использования данной шкалы является оценка биоптатов под малым (низким) увеличением (объективы 4х–10х), при этом в основном оценивается тканевая атипия [25, 26].
Изначально шкала Глисона включала 9 степеней дифференцировки, однако на протяжении более четырех десятилетий проводились ее видоизменения, приведшие к тому, что в настоящее время используется 4 степени градации.
- Градация 1: опухоль состоит из плотно расположенных друг к другу желез и имеет четкие границы. Согласно международному консенсусу, практически во всех случаях градация 1 представляет собой атипическую аденоматозную гиперплазию. Принято решение не использовать градацию 1 в диагностике РПЖ.
- Градация 2: опухоль состоит из скоплений желез, все еще разделенных стромой, расположенных друг от друга в среднем на расстоянии меньше диаметра одной железы. Железы становятся более вариабельными по форме. Определяется минимальная инвазия в строму. Эта градация при исследовании биопсий должна диагностироваться в исключительно редких случаях, так как из-за лимитированного количества ткани в столбике невозможно определить очерченность опухолевого узла.
- Градация 3: является наиболее распространенным типом роста предстательной железы. Представлена мелкими атипическими ацинусами, инфильтрирующими строму и доброкачественные дольки простаты (рис. 2).
- Градация 4: плохо дифференцированная опухоль, состоящая из цепочек атипичных клеток. Структура расположения клеток может быть микроацинарной по типу «взорвавшихся» желез, крибриформной или папиллярной (рис. 3).
- Градация 5: наиболее низко дифференцированный тип опухоли, имеет сходство с «комедо»-типом внутрипротоковой карциномы молочной железы, с гладкими, округлыми массами атипичных клеток. Характерно наличие в центре некротических масс, окруженных папиллярными, крибриформными или солидными структурами. Может представлять собой рассеянные участки анапластических клеток аденокарциномы. Эта опухоль настолько плохо дифференцирована, что ее очень трудно отличить от других плохо дифференцированных новообразований предстательной железы (рис. 4).
За редким исключением РПЖ имеет неоднородную структуру. Поэтому, для того чтобы подсчитать показатель Глисона при исследовании ткани простаты, суммируют две наиболее высоких градации с указанием их процентного соотношения. Полученное число баллов служит важным прогностическим критерием, позволяющим предположить более быстрое прогрессирование заболевания, метастазирование и снижение выживаемости.
При обнаружении ракового поражения оценивают следующие параметры: степень дифференцировки опухоли по шкале Глисона для каждого кусочка; число пораженных опухолью биоптатов; протяженность опухолевой ткани в биоптате; сторону и локализацию рака (согласно маркированному контейнеру); наличие или отсутствие периневральной инвазии (наличие периневральной инвазии не коррелирует с прогнозом, однако увеличивает риск наличия экстрапростатической инвазии).
Протяженность опухолевой ткани в биоптатах подсчитывается в процентах. Расчет заключается в делении общей протяженности пораженной ткани всех биоптатов на общую длину биоптатов, за исключением длины перипростатической ткани.
В биоптат может попасть перипростатическая ткань и ткань семенных пузырьков, что позволяет патологу диагностировать экстрапростическую инвазию и инвазию в семенные пузырьки.
Выводы
- При выявлении ПИН рекомендовано выполнять повторную биопсию через несколько месяцев, если площадь ПИН составляет более 20% ткани биоптатов, через год – во всех остальных случаях.
- При выявлении АМП всегда необходимо выполнять повторную биопсию.
- Сумма баллов по системе градации Глисона 2–4 всегда занижена и некорректна. Под этим диагнозом может скрываться аденокарцинома с суммой баллов 6 или аденоз (атипическая аденоматозная гиперплазия). Сумма баллов 5 практически всегда является заниженной, и в опухоли после радикальной простатэктомии сумма баллов будет выше.
- При нескольких позитивных биоптатах, в которых опухоль имеет разные степени дифференцировки по системе Глисона, общая сумма баллов складывается из двух наиболее высоких градаций.
- Микрофокус аденокарциномы в биоптате не является прогностическим признаком локализованной опухоли в предстательной железе.
- Наиболее прогностически важными критериями кроме градации Глисона являются число пораженных биоптатов и протяженность пораженной ткани в процентах.


