Введение. Заболеваемость раком предстательной железы (РПЖ) в России в 2012 г. составила 43,2 человека на 100 тыс. населения. Прирост абсолютного числа больных РПЖ с 2007 по 2012 г. составил 43,8%. В структуре онкологической заболеваемости мужского населения России РПЖ занимает 2-е место (12,1%). С каждым годом количество заболевших увеличивается примерно на 3%. Данное заболевание занимает 2-е место в мире по показателю смертности от всех видов рака среди мужчин. В США заболеваемость РПЖ составляет более 120 человек на 100 тыс. мужчин, а смертность – почти 20 человек на то же число мужского населения [1].
К основным методам лечения РПЖ при I и II стадииях относятся радикальная простатэктомия и лучевая терапия. Последняя может осуществляться двумя способами: дистанционным и внутритканевым (брахитерапия). Ранее брахитерапия применялась довольно широко из-за низкого риска облучения окружающих здоровых тканей, особенно передней стенки прямой кишки, уретры и шейки мочевого пузыря [2]. Однако технологические усовершенствования последних лет в области дистанционной лучевой терапии позволили решить многие проблемы, связанные с защитой критических органов от нежелательной лучевой нагрузки.
В настоящее время стереотаксическая лучевая терапия (SBRT) может быть методом выбора в лечении РПЖ. Прежде всего это неинвазивный способ лечения, который значительно снижает риски и стоимость проводимых процедур. Затраты на расходные материалы минимальны и значительно ниже таковых при брахитерапии [3–5]. Кроме того, наличие средств визуального контроля положения мишени и критических органов, гибкие системы расчета дозных полей, надежная верификация, сокращенное время процедуры и всего курса в целом дают неоспоримые преимущества в пользу дистанционной лучевой терапии при выборе метода высокодозного облучения [4].
Несмотря на это, информация, посвященная гипофракционному лечению РПЖ, практически отсутствует. В настоящее время несколько центров заявляют о проведении клинических исследований по данной тематике [2–6]. Согласно принятой радиобиологической модели, в которой α/β для простаты оценивается в диапазоне от 1,5 до 3 Гр, схема 5х7 Гр соответствует очаговой дозе 85–70 Гр при стандартном режиме облучения. При этом рабочие группы, проводящие исследования, не отмечают острых лучевых реакций, одновременно указывая на недостаточность данных о поздних осложнениях.
Цель исследования: оценить непосредственные результаты проведения лучевой терапии локального РПЖ в режиме гипофракционирования.
Материалы и методы. С 2012 г. лучевое лечение проведено 74 пациентам со злокачественным новообразованием предстательной железы. Возраст пациентов варьировался от 55 до 83 лет.

Оперативное лечение не проводилось из-за отказа пациентов или ввиду невозможности выполнения операции в связи с сопутствующей патологией и/или возрастными ограничениями. От всех пациентов было получено информированное согласие на проведение лучевого лечения.
Для оценки прогноза заболевания и эффективности лечения использовали показатель уровня простатспецифического антигена (ПСА), определяли морфологическую структуру опухоли по Глисону и стадию заболевания.
Критерии включения: РПЖ не выше стадии IIb (T1aN0M0–T2bN0M0), Глисон от 2 до 7 баллов, ПСА менее 20 нг/мл.

Критерии исключения:
- РПЖ не выше стадии IIb с уровнем ПСА выше 20 нг/мл;
- невозможность установки мочевого катетера для визуализации мочевого пузыря при проведении лечения;
- травмы и заболевания опорно-двигательного аппарата;
- отказ пациента от лечения.
В зависимости от способа лечения пациенты разделены на две группы (табл. 1–3). Основную группу составили 24 пациента (средний возраст – 67 лет), которым лучевое лечение проведено в режиме гипофракционирования. В группу сравнения вошли 50 пациентов (средний возраст – 66 лет), лечение которых осуществлено в режиме стандартного фракционирования (РОД 2 – 2,5 Гр, СОД на предстательную железу – 76–80 Гр, семенные пузырьки – 56 Гр).
Проведение облучения в режиме гипофракционирования согласовано с локальным этическим комитетом института. Как видно из табл. 1, в основной группе распределение пациентов по стадиям заболевания было равномерным, в то время как в группе сравнения преобладали пациенты со стадией заболевания T2aN0M0 и T2bN0M0. Согласно разработанному протоколу обследования и лечения РПЖ, перед началом лучевой терапии всем пациентам выполнили стандартное исследование общеклинических и биохимических показателей, параметров гемостаза; МСКТ органов грудной клетки; МСКТ или УЗИ органов брюшной полости; ЭКГ; УЗИ или трансректальное УЗИ предстательной железы; остеосцинтиграфию костей скелета; МРТ органов малого таза с контрастным усилением.
При МРТ-исследовании органов малого таза оценивали вовлеченность лимфатических узлов, распространение опухоли за пределы капсулы предстательной железы, «заинтересованность» семенных пузырьков в патологическом процессе.
О непосредственной эффективности лечения и прогнозе заболевания судили на основании показателей уровня ПСА. О безопасности проводимого лечения судили по наличию ранней и поздней лучевой реакции.
Динамическое наблюдение за пациентами, получившими лечение в режиме гипофракционирования, проводили 1 раз в 3 мес. в течение 8–16 мес; МРТ малого таза с контрастированием выполняли не реже 1 раза в год. Наблюдение за пациентами группы сравнения проводилось 1 раз в 3 мес в течение 3 лет.
 Методика облучения. Предлучевая подготовка включала топометрические МСКТ- и МРТ-исследования органов малого таза. Срезы толщиной 2 мм выполняли в аксиальной плоскости. После совмещения снимков МСКТ и МРТ проведено оконтуривание мишени на станции Focal Pro, критическими структурами считали мочевой пузырь, прямую кишку, простатическую часть уретры, тазобедренные суставы. В контуры GTV и CTV, согласно данным визуализации, вошла предстательная железа без семенных пузырьков. С учетом подвижности капсулы предстательной железы было принято решение об использовании трансректальной фиксации прямой кишки ватным тампоном и изготовлении индивидуальной абдоминальной термопластической маски, что снизило подвижность органов малого таза и позволило существенно сократить отступы при облучении мишени. Отступы PTV составили до 5 мм во все стороны и до 3 мм в сторону прямой кишки. Контрастирование мочевого пузыря позволило улучшить визуализацию предстательной железы и уменьшить отступы PTV.
Методика облучения. Предлучевая подготовка включала топометрические МСКТ- и МРТ-исследования органов малого таза. Срезы толщиной 2 мм выполняли в аксиальной плоскости. После совмещения снимков МСКТ и МРТ проведено оконтуривание мишени на станции Focal Pro, критическими структурами считали мочевой пузырь, прямую кишку, простатическую часть уретры, тазобедренные суставы. В контуры GTV и CTV, согласно данным визуализации, вошла предстательная железа без семенных пузырьков. С учетом подвижности капсулы предстательной железы было принято решение об использовании трансректальной фиксации прямой кишки ватным тампоном и изготовлении индивидуальной абдоминальной термопластической маски, что снизило подвижность органов малого таза и позволило существенно сократить отступы при облучении мишени. Отступы PTV составили до 5 мм во все стороны и до 3 мм в сторону прямой кишки. Контрастирование мочевого пузыря позволило улучшить визуализацию предстательной железы и уменьшить отступы PTV.
При помощи урологического катетера осуществлено опорожнение мочевого пузыря, затем в полость мочевого пузыря введено 199 мл физиологического раствора и 1 мл контрастного вещества.
Режим стандартного фракционирования осуществлен с использованием стандартных средств фиксации пациента.
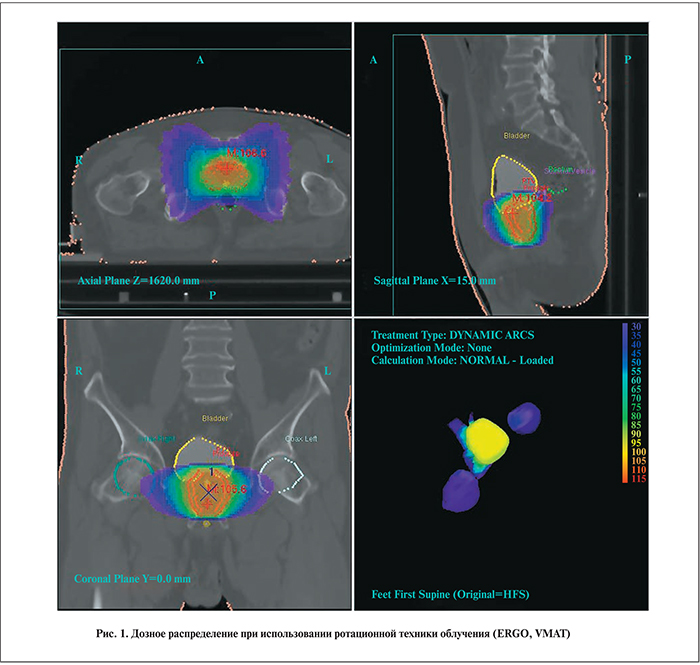
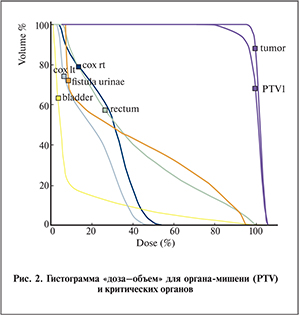
Облучение проведено на медицинском ускорителе Elekta Axesse с многолепестковым коллиматором. При составлении лечебного плана использована методика облучения мишени с модуляцией интенсивности (VMAT), при которой удается осуществлять конформное облучение с одновременной эффективной защитой окружающих здоровых тканей (рис. 1). Использование значительной фракционной дозы влечет за собой повышенные требования к позиционированию пациента. Положение мишени контролировали непосредственно перед сеансом облучения средствами самого ускорительного комплекса, в частности малодозной рентгеновской установкой, смонтированной на шасси ускорителя. Такая съемка позволяет совмещать фактическое и расчетное положение органов малого таза с высокой точностью. После облучения проведена повторная съемка для оценки точности используемого метода. Среднеквадратичная ошибка смещения мишени от первоначального положения составила 2 мм, что согласуется с выбранной при составлении лечебного плана моделью облучения. Дозиметрическая проверка плана на фантоме простаты не отличается от рутинно проводимой проверки планов облучения малого таза и демонстрирует согласие (расхождение составляет менее 2%) расчетного и приборного измеряемого значения дозы. При оптимизации плана использовали условия как на покрытие мишени (V95% > 99% на CTV (95% на PTV)), так и на минимизацию средней лучевой нагрузки (в процентах от очаговой дозы) на критические органы: D<40% для прямой кишки, D<20 d="" 20="" 2="" 3="" 7="" 5="" 37="" 5="" 76="" p="">
Оценка уровня качества жизни осуществлена при помощи импровизированного опросника, разработанного сотрудниками Центра онкологии и радиотерапии Новосибирского научно-исследовательского института патологии кровообращения им. академика Е. Н. Мешалкина. Пациентов просили оценить свое самочувствие на момент начала лечения и через 6 мес. после его окончания.
Статистическая обработка проведена непараметрическим методом с вычислением критерия χ2. В том случае если частота хотя бы в одной ячейке таблицы ожидаемых частот была меньше или равна 5, для сравнения частот качественного показателя в двух независимых группах использован точный критерий Фишера.
Результаты и обсуждение. По сравнению со стандартным курсом лучевой терапии, который требует от 7 до 9 нед. госпитализации, режим с увеличенной разовой дозой позволяет существенно сокращать сроки лечения и быстро доводить суммарную дозу до радикальных значений. Этот момент особенно важен при выстраивании тактики лечения пациентов с сопутствующими заболеваниями.
По рискам развития ранних и поздних лучевых реакций метод гипофракционирования можно отнести к промежуточному между брахитерапией предстательной железы и дистанционной лучевой терапией в стандартном режиме фракционирования. В нашем исследовании дизурия у пациентов в процессе проведения гипофракционирования оставалась на уровне ноктурии до 3 раз за ночь. В то же время у 19 пациентов, проходивших стандартное лучевое лечение, отмечено нарастание дизурии (ноктурия до 4–5 раз за ночь).
Ранние лучевые циститы были отмечены у пациентов на 1–3-й неделе после проведения курса терапии. По шкале токсичности RTOG они соответствовали G1 – 60 %, G от 2 до 5 – 0%, гематурии, стриктуры уретры; недержания мочи у пациентов основной группы выявлено не было. В группе сравнения гематурия отмечена у 3 пациентов, недержание мочи у 4. Сужений уретры отмечено не было.

При оценке постлучевых осложнений в группах пациентов выявлено, что ранних постлучевых осложнений у пациентов основной группы не было, в то время как 2 пациента группы сравнения страдали постлучевыми циститами. Оценка поздних постлучевых показала осложнения у 4 пациентов основной группы (у 2 – цистит, у 2 – ректит), и у 8 пациентов группы сравнения (у 4 – цистит, у 4 – ректит).
Динамика содержания общей фракции ПСА через 3 мес и через год после курса лечения представлена в табл. 4.
Согласно оценке качества жизни, большинство пациентов основной группы определили свое самочувствие как отличное и хорошее. Так, в основной группе отличное самочувствие отметили 9 пациентов, хорошее – 12 и удовлетворительное – 3. В группе сравнения отличное самочувствие подтвердили 4 пациента, хорошее – 21 и удовлетворительное – 23. Различия между группами статистически значимы в отношении отличного (ТКФ; р=0,0145) и удовлетворительного (ТКФ; р=0,03) самочувствия.
За год наблюдения в основной группе умерли 3 (12,5%) пациента, смерть двоих из них (8,33%) не была связана с основным заболеванием. В группе сравнения за год наблюдения умерли 11 (22%) пациентов (ТКФ; р=0,3163).
Заключение. Несмотря на небольшое число пациентов, которым проведено лучевое лечение с применением ускоренного гипофракционированного режима, можно сделать вывод о безопасности этого метода при соблюдении необходимых технических и клинических условий. Методика ускоренного гипофракционированного режима облучения может быть охарактеризована как высокоэффективная, не сопровождающаяся развитием ранних лучевых реакций, позволяющая значительно сокращать сроки пребывания пациента в стационаре. Данный метод прост в применении, но для оценки отдаленных результатов необходимо дальнейшее его изучение.



