Введение. Рак предстательной железы (РПЖ) с каждым годом становится все более распространенным заболеванием среди мужского населения как в РФ, так и в странах Европы и США [1].Отмечается прирост уровня заболеваемости РПЖ в мире в среднем на 3% в год, что позволяет прогнозировать удвоение показателей примерно к 2030 г. [2].
Ввиду высокой актуальности проблемы во всем мире идет активное изучение различных аспектов заболеваемости РПЖ. Разрабатываются и внедряются диагностические клинико-лабораторные и инструментальные методы исследований. Осваиваются новые хирургические, в том числе малоинвазивные, методы лечения, такие как высокоинтенсивный фокусированный ультразвук, криоаблация, где важна именно визуализация раковой опухоли в простате для выполнения фокального лечения [3]. Использование в диагностике простатического специфического антигена (ПСА), магнитно-резонансной томографии (МРТ) и гистосканирования, безусловно, увеличило выявляемость РПЖ, в том числе и на ранних стадиях. Однако ряд исследований показал, что при рутинной биопсии простаты остаются не выявленными до 25–30% опухолей, представляющих клиническую значимость (Глисон более 7, экстрапростатическое распространение, критерий Эпштейна) [4, 5].
 Таким образом, остается актуальной проблема раннего выявления РПЖ, идет разработка и освоение новых методов скрининга РПЖ, направленных на визуализацию опухоли и прицельное получение материала для морфологического исследования из подозрительных участков. Одним из таких новых методов является ультразвуковая эластометрия сдвиговой волной (УЗЭСВ) [6].
Таким образом, остается актуальной проблема раннего выявления РПЖ, идет разработка и освоение новых методов скрининга РПЖ, направленных на визуализацию опухоли и прицельное получение материала для морфологического исследования из подозрительных участков. Одним из таких новых методов является ультразвуковая эластометрия сдвиговой волной (УЗЭСВ) [6].
Метод практически сразу доказал свою эффективность в дифференциальной диагностике образований печени и щитовидной железы [7]. Первым устройством стал «Фиброскан» – аппарат УЗ-диагностики для исследований патологических состояний печени, а именно оценки ее жесткости при циррозе и раке. [8] При обзоре литературы, посвященной диагностике заболеваний предстательной железы с применением УЗЭСВ, за последние 3 года мы нашли всего 14 публикаций, одной из которых является работа по применению УЗЭСВ в диагностике рака предстательной железы. Исследование проведено в 2014 г. в США: по результатам обследования 184 мужчин с подозрением на РПЖ, которым выполнялось и патоморфологическое исследование; авторы получили так называемый порог значения жесткости в 35 кРа; у 96% обследованных с показателем выше этого значения диагностировали РПЖ [9]. Другое исследование проведено корейской компанией «J Radiol», в котором сдвиговую волну (SWE) использовали в диагностике РПЖ у 84 мужчин с уровнем ПСА выше 4 нг/мл. По результатам работы авторы получили нижнее пороговое значение жесткости при РПЖ, равное 43,9 кРа [10].
Таким образом, не определена информативность и специфичность метода УЗЭСВ в диагностике рака простаты, нет четких критериев оценки жесткости ткани при различных значениях ПСА и степени дифференцировки опухоли, а также гиперплазии простаты, простатите. Не определена роль УЗЭСВ в повышении информативности биопсии простаты при различных значениях ПСА.
Цель исследования: оценить информативность и специфичность УЗЭСВ, сравнить с другими методами диагностики.
Материалы и методы. В клинике урологии Первого МГМУ им. И. М. Сеченова УЗЭСВ применяется с октября 2015 г. За этот период с помощью данного метода были обследованы 302 пациента.
Исследования выполняли на ультразвуковой системе Aixplorer («Super Sonic Imagine»), в которой предусмотрено одномоментное выполнение как B-режима, так и режима УЗЭСВ в реальном времени.
Суть метода заключается в исследовании предстательной железы с помощью трансректального ультразвукового сканирования c одновременной генерацией сдвиговых волн и последующей качественной и количественной оценке жесткости ткани. Сдвиговые волны генерируются тем же УЗ-датчиком, которым проводится исследование. Распространение сдвиговой волны происходит перпендикулярно УЗ-волне (рис. 1). На экране при этом можно наблюдать как цветовое картирование, так и количественные показатели плотности ткани.
Исследование основывалось на трансректальных эхограммах путем 6 измерений, так называемых «Q-box», по 3 из каждой доли, по сегментам от основания до апекса. При количественной оценке система предоставляет 3 измерения жесткости в пределах одного Q-box (минимальное, среднее и макимальное). Единицей измерения было принято среднее значение (Емean), выраженное в kPa. Таким образом, мы получали 6 точек измерения жесткости в предстательной железе, совпадающих с местом пункционной биопсии простаты, что позволяло правильно оценивать полученные результаты.
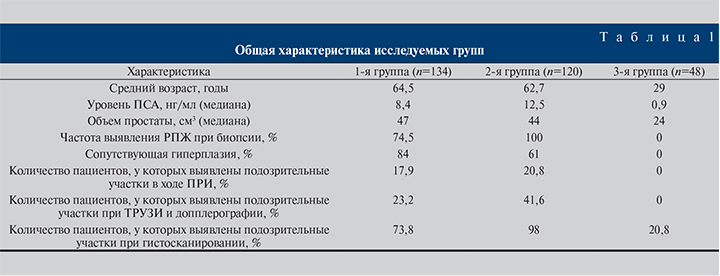
Все пациенты были разделены на 3 группы. Первая группа (проспективное исследование) включила 134 мужчины в возрасте от 47 лет до 81 года (средний возраст – 64,5 года) с подозрением на РПЖ, которым предстояло перенести первичную или повторную биопсию. Уровень ПСА у них варьировался от 4 до 24 нг/мл.
Вторую группу (ретроспективное исследование) составили 120 мужчин с верифицированным диагнозом РПЖ в возрасте от 45 до 75 лет (средний возраст – 62,7 года) с уровнем ПСА от 4 до 90 нг/мл.
Третья группа, контрольная, включала 48 мужчин в возрасте от 25 до 35 лет (средний возраст – 29 лет), у которых уровень ПСА не превышал 3 нг/мл. В эту группу входили только здоровые мужчины.
Всем пациентам 1-й и 2-й групп выполняли стандартное комплексное обследование, включившее определение уровня ПСА, пальцевое ректальное исследование (ПРИ), трансректальное УЗИ (ТРУЗИ) с цветовым допплеровским картированием (ЦДК), гистосканирование, МРТ с контрастированием при уровне ПСА более 10 нг/мл.

Пациентам 1-й группы с учетом данных о локализации участков патологической жесткости ткани согласно данным эластометрии в последующем выполнялась трансректальная биопсия простаты.
У 100 из 134 был выявлен РПЖ.
Двести семнадцати пациентам 1-й и 2-й групп выполнена простатэктомия по поводу РПЖ. У 28 из 217 человек оценивали совпадение локализации и степени дифференцировки раковой опухоли в удаленной простате с данными жесткости, полученными при эластометрии сдвиговой волной до операции.
Магнитно-резонансная томография с контрастированием органов малого таза была выполнена 63 пациентам 1-й и 2-й групп, у всех уровень ПСА был выше 10 нг/мл.
В группе здоровых мужчин помимо УЗЭСВ проводили только стандартные скрининговые методы исследования РПЖ (определение уровня ПСА, ТРУЗИ и ПРИ; табл. 1).
В 1-й группе по данным ТРУЗИ подозрительные на рак участки выявлены у 31 обследованного, во 2-й – у 50. В 3-й группе изменения, характерные для онкологического процесса, не установлены. При гистосканировании подозрительные на РПЖ участки в 1-й группе определены у 99 человек, во 2-й – у 118, в 3-й – у 10, что соответствует ложноположительным результатам при простатите. Для дальнейшей оценки специфичности и чувствительности метода была проведена статистическая обработка данных с учетом всех исследованных биоптатов.
По результатам ПРИ в 1-й группе подозрительные на рак участки выявлены у 24 (17,9%) пациентов, во 2-й – у 25 (20,8%)
Суммарное количество биоптатов, полученных для исследования, равно 3048. При выполнении УЗЭСВ мы использовали 6 точек Q-box, соответствующих периферическим зонам пункционной биопсии, следовательно, только 1524 биоптата исследования были информативными для оценки метода УЗЭСВ (табл. 2).
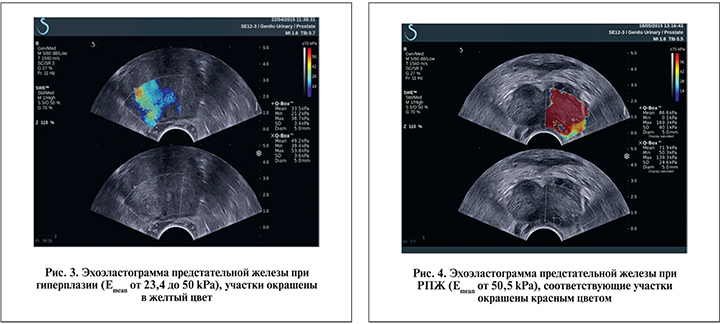
Результаты. Первоначально на основании данных биопсии и результатов обследования пациентов контрольной группы мы определили пороговые значения жесткости (Еmean), которые в норме варьируются от 0 до 23 кРа (рис. 2), при гиперплазии предстательной железы составляют от 23,4 до 50 кРа (рис. 3) и при РПЖ — от 50,5 kPa и выше, на мониторе эти зоны окрашены в красный цвет (рис. 4).
В 1-й группе 112 пациентов имели гиперплазию предстательной железы. При исследовании гиперплазии путем гистосканирования у 7 пациентов определялись участки, подозрительные на РПЖ, в то время как при УЗЭСВ подозрения на рак не возникало и значение жесткости ткани простаты не превышало 50 кРа.
У 100 из 134 пациентов 1-й группы верифицирован РПЖ. Значение жесткости в данной подгруппе в участках с выявленным раком составило от 51 до 196 кРа. У 120 пациентов 2-й группы послеоперационное морфологическое заключение подтвердило наличие рака в тех зонах, в которых жесткость ткани составила 50,5 kPa и выше (максимально в данной группе до 295 kPa).

В контрольной группе, в которую входили здоровые мужчины, значение жесткости ткани простаты не превышало 21,5 кРа.
Всего с верифицированным РПЖ было 220 пациентов 1-й и 2-й групп. При анализе обнаружено закономерное увеличение средней степени жесткости ткани в зависимости от степени дифференцировки опухоли, суммы баллов по Глисону и, следовательно, онкологического риска. Уровень ПСА также в большинстве наблюдений коррелировал со степенью дифференцировки опухоли и ее распространенностью (табл. 3). Максимальная жесткость ткани при низкодифференцированном раке клинической стадии Т4 (Глисон 10) составила 295 кРа.
По результатам исследования были рассчитаны показатели чувствительности (Se), специфичности (Sp), положительной предсказательной ценности (PPV), отрицательной предсказательной ценности (NPV) УЗЭСВ, пункционной биопсии с учетом 6 периферических точек, использованных при проведении эластометрии, а также результатов гистологического исследования поперечных срезов простаты посекстантно.
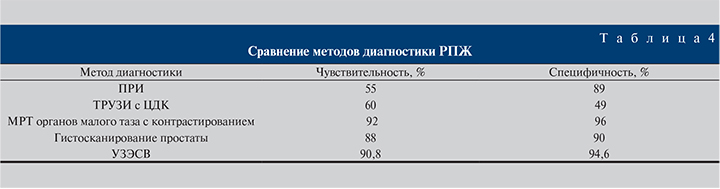
При сравнении с пункционной биопсией показатели Se, Sp, PPV, NPV УЗЭСВ составили 90,8, 94,6, 56,6 и 97,9 % соответственно (p<0,05).
По результатам анализа в 1-й группе выявлено 2 ложноположительных и 10 ложноотрицательных результатов, специфичность и чувствительность УЗЭСВ составили 90,8 и 94,6% соответственно. Показатели информативности УЗЭСВ значительно превосходили таковые для ПРИ, ТРУЗИ с ЦДК и оказались сопоставимыми с информативностью МРТ с контрастным усилением.
Заключение. Полученные в ходе настоящего исследования данные позволяют говорить о высокой информативности метода УЗЭСВ в выявлении РПЖ. Метод показал высокий процент совпадений результатов с данными МРТ с контрастированием и оказался более специфичным, чем гистосканирование и обычное ТРУЗИ в режиме серой шкалы с ЦДК. Включение метода в комплексную диагностику повышает выявляемость РПЖ, увеличивает информативность трансректальной биопсии простаты. Дальнейшее изучение метода позволит определить его место в комплексной диагностике РПЖ.



