Введение. Травма позвоночника, осложненная повреждением спинного мозга, относится к важнейшим проблемам современной медицины и более чем в 80% случаев является уделом лиц молодого трудоспособного возраста, а частота осложнений и инвалидности после нее достигает 100% [1–5]. При этом нарушения функций мочевыделительной системы, по данным разных авторов, регистрируют у 77–100% больных [6, 7].
Совокупность нейродистрофических воспалительных изменений в слизистой оболочке мочевыводящих путей, их инфицирование, застой и задержка мочи, ее реакция, обменные сдвиги, возникающие при повреждении спинного мозга, рефлюкс инфицированной мочи, гиподинамия и гипокинезия создают благоприятные условия для камнеобразования в мочевом пузыре, мочеточниках и лоханках [8–10]. Установлено, что после травмы в течение 1–45 лет у 7–69% пациентов образуются камни в почках [11–15], а у 16,6–85,0% – камни в мочевом пузыре [14, 16, 17]. К особенностям мочекаменной болезни у спинальных больных относится частое отсутствие боли даже при миграции камней в мочеточнике. Мочекаменная болезнь служит своеобразным провоцирующим фактором для обострения инфекционно-воспалительных заболеваний в почках.

В литературе относительно мало работ, посвященных исследованию формирования мочекаменной болезни у больных с позвоночно-спинномозговой травмой [15, 18, 20]. Нет четкого представления об этапах и факторах патогенеза данного заболевания.
Цель работы – исследовать потенциальные биохимические факторы формирования мочекаменной болезни у больных с позвоночно-спинномозговой травмой.
Материалы и методы. Объектом исследования стала сыворотка крови и суточная моча 55 больных с позвоночно-спинномозговой травмой. Возраст их составлял от 17 до 62 лет (в среднем 35,3±1,8 года). Подавляющее большинство – мужчины: 49 (89%) человек. В остром и раннем периодах травматическойболезни (по классификации О. А. Амелиной [21]) обследованы 11 больных, в промежуточном и позднем – 44. По уровню повреждения позвоночника обследуемые были распределены на три группы. Травма позвоночника в шейном отделе констатирована у 32 больных, в грудном отделе – у 7, в грудопоясничном отделе – у 16. Нарушения функции тазовых органов были диагностированы у всех больных и проявлялись в виде задержки мочи – 17 (31%) наблюдений; недержания мочи – 19 (35%); затруднения мочеиспускания – 3 (5%); спинального автоматизма – 16 (29%). Нейрогенный мочевой пузырь был диагностирован в 100% случаев.
При задержке мочи дренирование мочевого пузыря осуществлялось уретральным катетером (n=13), эпицистостомой (n=4). При недержании мочи больные использовали уропрезерватив (n=9), подгузник (n=10). При спинальном автоматизме и затрудненном мочеиспускании отхождение мочи осуществлялось через естественные мочевыводящие пути (n=19).

Наличие мочевых камней определяли с помощью ультразвуковой установки Logic S6 (Япония), используя конвексный датчик 3–5 МГц в режиме тканевой гармоники. Выполняли ультрасонографическое исследование почек, мочеточников, мочевого пузыря.
Концентрацию мочевины, креатинина, мочевой кислоты, кальция, магния и неорганического фосфата определяли на биохимическом автоматическом анализаторе Hitachi/BM 902 (Япония) с использованием наборов реагентов фирмы Vital Diagnostic (Россия), содержание натрия, калия и хлоридов – на ионселективном блоке анализатора Hitachi/BM 902 (Япония). Указанные показатели определяли в сыворотке крови и суточной моче. Дополнительно рассчитывали клиренс метаболитов и электролитов [22].
Биохимические показатели обследованных пациентов, полученные на этапах лечения, сравнивали с аналогичными показателями 20 практически здоровых людей обоего пола в возрасте от 20 до 40 лет.
Достоверность различий показателей пациентов на сроках обследования и параметров здоровых людей оценивали с помощью W-критерия Вилкоксона для независимых выборок. Достоверность межгрупповых различий определяли с помощью непараметрического критерия Крускала–Уоллиса с последующим множественным сравнением с использованием критерия Данна.
Результаты. По результатам исследований, у 35 (64%) больных в мочевыводящих путях были определены конкременты различной величины (табл. 1). Лоцированные конкременты в основном (83% наблюдений) имели небольшие размеры (от 2 до 7 мм) и располагались с двух сторон (64% наблюдений). Данные ультрасонографии, проведенной в различные периоды позвоночно-спинномозговой травмы, позволили установить, что камнеобразованию в большей степени подвержены больные с продолжительностью заболевания более 2 лет, что может быть связано с длительным угнетением двигательной активности и нарушением функции тазовых органов (табл. 2).
Далее нами был проведен сравнительный анализ биохимических показателей сыворотки крови и суточной мочи пациентов, у которых в посттравматическом периоде развивалась мочекаменная болезнь (основная группа – 35 больных), и больных, у которых развития данного заболевания не наблюдалось (группа сравнения – 20 больных).
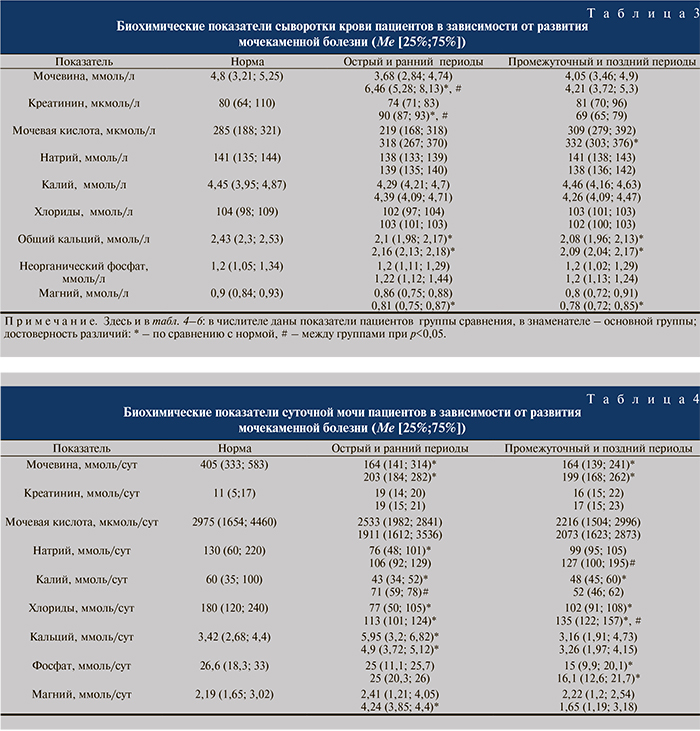
Из полученных результатов обращает на себя внимание то, что у пациентов основной группы в остром и раннем периодах позвоночно-спинномозговой травмы наблюдался статистически значимый рост уровня мочевины и креатинина в крови, причем относительно как нормы, так и показателей пациентов группы сравнения (табл. 3). В остром и раннем периодах у пациентов основной группы был снижен уровень магния в сыворотке крови относительно показателей нормы.
У всех больных было отмечено снижение концентрации общего кальция в крови.
В промежуточном и позднем периодах достоверных межгрупповых различий биохимических показателей сыворотки крови не наблюдалось. Однако у пациентов основной группы отмечалось значимое повышение концентрации мочевой кислоты и снижение уровня магния относительно нормы. Установлено определенное снижение экскреторной функции почек в остром и раннем периодах у пациентов основной группы, на что указывает значительное увеличение в сыворотке крови уровня мочевины и креатинина. В свою очередь содержание мочевины в суточной моче больных в остром и раннем промежуточном и позднем периодах было достоверно ниже нормы (табл. 4). Отмечались отличия электролитного состава суточной мочи у пациентов двух групп. Так, уровень кальция в моче пациентов обеих групп был значимо выше нормы, а уровень хлорида – ниже при отсутствии межгрупповых отличий. Содержание калия в моче пациентов основной группы было в пределах нормы, однако значимо превышало таковое в группе сравнения.

Отмечен и более высокий уровень магния в моче больных основной группы в остром и раннем периодах позвоночно-спинномозговой травмы. В позднем и промежуточном периодах отмечались некоторые межгрупповые отличия. Так, в суточной моче пациентов с мочекаменной болезнью было повышено содержание натрия и хлоридов. В обеих группах зафиксировано снижение экскреции фосфатов.
Проведенное исследование показало, что у пациентов с развившейся мочекаменной болезнью в остром и раннем периодах позвоночно-спинномозговой травмы повышения уровня кальция не наблюдалось, мало того, средние показатели этого электролита, а также уровень уратов были ниже параметров группы сравнения. Единственное, что обращает на себя внимание, – это высокое содержание магния в моче пациентов основной группы в остром периоде.
Установлено, что клиренс мочевины у пациентов обеих групп был снижен как в остром и раннем, так и в промежуточной и позднем периодах позвоночно-спинномозговой травмы (табл. 5). Однако в остром и раннем периодах травмы у больных, у которых развивалась мочекаменная болезнь, клиренс мочевины снижался почти в 4 раза, тогда как у больных без развития камней – только в 1,5 (р=0,03). В остром периоде у пациентов основной группы также было зафиксировано более существенное снижение клиренса уратов и рост клиренса магния относительно как нормы, так и группы сравнения. У пациентов группы сравнения в остром и раннем периодах был снижен клиренс натрия.
Анализ скорости клубочковой фильтрации (СКФ) позволил обнаружить значимое увеличение данного показателя у больных с позвоночно-спинномозговой травмой обеих групп при отсутствии межгрупповых отличий (табл. 6). Интересными с позиции патогенеза мочекаменной болезни при позвоночно-спинномозговой травме представляются другие результаты исследования. Так, у больных основной группы отмечались более существенное снижение скорости экскреции кальция на всех этапах позвоночно-спинномозговой травмы, а также более высокие показатели осмоляльности мочи относительно показателей пациентов группы сравнения. Оценка влияния минералкортикоидов на экскрецию электролитов выявила, что у пациентов, у которых развитие мочекаменной болезни не происходило, наблюдалось более высокое, хотя и недостоверное, значение К/Na-коэффициента мочи, т.е. реакция надпочечников у них была более выражена и направлена на сохранение натрия и воды в организме.
Обсуждение. Данные литературы, посвященной исследованию состояния мочевыделительной системы у больных с позвоночно-спинномозговой травмой, свидетельствуют о том, что риск образования мочевых камней в почках и мочевом пузыре у данной категории больных выше, чем в обычной популяции людей [13]. При этом анализ, проведенный S. Ramsey и соавт. [15], показал, что в большинстве научных публикаций биохимические исследования не выявляют существенных различий показателей крови и мочи у больных в зависимости от наличия мочекаменной болезни, хотя отмечаются достоверные изменения относительно параметров здоровых людей.

M. Nagashima и соавт. [17] также пришли к выводу, что нет никакой разницы между двумя группами пациентов в отношении рН мочи и видов бактерий, обнаруженных в ней. По данным R. Burr и соавт. [18], особенностью формирования мочекаменной болезни у больных с позвоночно-спинномозговой травмой является уменьшение выделения цитрата с мочой. Роль последнего связана с возможностью подавлять образование, рост и агрегацию кристаллов оксалата кальция и фосфата кальция [23].
Следует заметить, что у пациентов с позвоночно-спинномозговой травмой часто встречаются и инфекционные камни. Бактериальные патогены, такие как Proteus, Pseudomonas, Klebsiella, некоторые стафилококки, микоплазмы, сильно ощелачивают мочу, что способствует суперсатурации и кристаллизации магния и фосфатов аммония. Частота образования струвитных камней при таких нарушениях достигает 70% [19, 20, 24, 25]. При этом соотношение струвитных и карбонатапатитных камней, как правило, растет с увеличением времени, прошедшим после травмы [11, 18].
Полученные нами данные позволяют сформулировать определенные положения о патогенезе мочекаменной болезни после позвоночно-спинномозговой травмы. В частности, патофизиологическая картина складывается из двух основных параллельно протекающих событий: 1) в остром периоде позвоночно-спинномозговой травмы происходит снижение перфузии почек кровью на фоне посттравматического шока; 2) в посттравматическом периоде развивается продукционная азотемия различной степени выраженности в зависимости от тяжести травмы. Последнее обстоятельство и является ключевым в развитии мочекаменной болезни: увеличение нагрузки на почки в данном состоянии приводит к развитию почечной азотемии в результате нарушения выделительной функции почек (накопление мочевины, креатинина в крови и снижение их клиренса). В этих условиях происходит нарушение экскреции мочевой кислоты, магния, снижается чувствительность почечных канальцев к действию альдостерона (у пациентов с мочекаменной болезнью соотношение К/Na мочи было ниже). В результате последнего у пациентов снижается реабсорбция натрия и воды, повышается осмоляльность мочи. Рост осмоляльности мочи происходит на фоне нарушения электролитного баланса мочи, что и приводило к образованию камней. Причем основным анионом в данном случае, по-видимому, являлись ураты, в пользу чего говорило значительное снижение их клиренса в остром и раннем периодах позвоночно-спинномозговой травмы у пациентов с развившейся мочекаменной болезнью, а катионом – ионы магния.
Представленные данные позволяют также заключить, что накопление в сыворотке крови пациентов с позвоночно-спинномозговой травмой в остром и раннем периодах продуктов азотистого обмена может являться определенным критерием риска развития мочекаменной болезни. Так, у всех обследованных нами пациентов, у которых развития мочекаменной болезни не отмечалось, концентрация мочевины в остром и раннем периодах позвоночно-спинномозговой травмы находилась в пределах нормы (2–8 ммоль/л).
В свою очередь у половины пациентов с развившейся в ходе лечения мочекаменной болезни отмечалось повышение концентрации мочевины в сыворотке крови в пределах 8–10,2 ммоль/л.
Заключение. Полученные нами результаты указывают на то, что у больных с позвоночно-спинномозговой травмой основным пусковым механизмом образования мочевых камней стала избыточная посттравматическая азотемия. При этом рост концентрации продуктов белково-азотистого катаболизма (мочевина, мочевая кислота, креатинин и др.) в сыворотке крови пациентов в остром и раннем периодах позвоночно-спинномозговой травмы может быть неблагоприятным критерием, определяющим значительный риск развития у них мочекаменной болезни.



