Введение. По данным ВОЗ, заболеваемость раком предстательной железы (РПЖ) во всем мире неуклонно растет. Россия не исключение – в структуре онкологической заболеваемости РПЖ занимает 3-е место после рака легких и желудка. Прирост заболеваемости за последние 10 лет составил 152,3%. Около 3% мужчин имеют шанс умереть от РПЖ [1].
«Золотым» стандартом в лечении локализованного РПЖ является радикальная простатэктомия (РПЭ) [2]. В 75–79% случаев пациентам с выявленной локализованной формой РПЖ выполняется лечение в объеме РПЭ. По данным мировой медицинской литературы, специфическая 5-летняя выживаемость достигает 95% [3]. Однако безрецидивная 5-летняя выживаемость этих пациентов варьируется в пределах 75–95% [4], а при местнораспространенных формах РПЖ снижается до 40%. Местный рецидив развивается не менее чем в 15% случаев лечения локализованного РПЖ независимо от выбранного метода лечения [5]. С учетом более активной хирургической активности при местнораспространенном РПЖ стадии T3a в ближайшее время стоит ожидать увеличения количества рецидивов РПЖ.
 К сожалению, до сих пор не существует единых критериев диагностики и выбора тактики лечения локального рецидива РПЖ после РПЭ. Методом лечения с доказанной эффективностью, но нежелательным влиянием на качество жизни является дистанционная лучевая терапия. Инновационными перспективными, но остающимися экспериментальными для этой группы больных считаются высокоинтенсивный фокусированный ультразвук (ВИФУ) и криодеструкция.
К сожалению, до сих пор не существует единых критериев диагностики и выбора тактики лечения локального рецидива РПЖ после РПЭ. Методом лечения с доказанной эффективностью, но нежелательным влиянием на качество жизни является дистанционная лучевая терапия. Инновационными перспективными, но остающимися экспериментальными для этой группы больных считаются высокоинтенсивный фокусированный ультразвук (ВИФУ) и криодеструкция.
В некоторых европейских странах (Франция, Германия) лечение ВИФУ служит методом выбора для пациентов с местным рецидивом после РПЭ. В исследовании Н. Azzouz (2006) общее число пациентов составило более 70 человек, средний уровень ПСА – 2,87 нг/мл до сеанса ВИФУ, надир ПСА – 0,21 нг/мл, безрецидивная выживаемость достигла 55%. В данном исследовании 84% контрольных биопсий были отрицательными, минимальный период наблюдения составил 7 мес, средний – 23 мес [6]. С учетом ограниченности выбора метода лечения такие результаты обнадеживают и позволяют надеяться на улучшение результатов лечения этих пациентов.
В России лечение больных РПЖ ВИФУ проводится с 2003 г. Одним из первых учреждений здраво- охранения, где начали выполнять подобные операции, стала клиника урологии Первого МГМУ им. И. М. Сеченова [7]. Накопленный опыт позволил применить данную методику к пациентам с локальным рецидивом РПЖ после РПЭ.
Материалы и методы. С октября 2004-го по февраль 2014 г. лечение локального рецидива РПЖ после РПЭ с применением ВИФУ проведено 46 пациентам. Объем предстательной железы до РПЭ составил в среднем 53 (от 21 до 102) см3, средний возраст – 62 (46–68) года. Уровень ПСА перед сеансом ВИФУ варьировался от 0,4 до 18 нг/мл.
В отношении всех пациентов местный рецидив РПЖ был доказан морфологически. Все больные до и после РПЭ были стратифицированы по стадиям (TNM) и степени онкологического риска (D'Amico), в ряде случаев послеоперационная оценка удаленной простаты изменяла стадию заболевания (рТ).
Локализованная стадия заболевания диагностирована 40 пациентам, из них низкий риск определен у 10 больных (Т и рТ совпали у всех пациентов), умеренный риск – у 18 (у 2 больных выявлена рТ3а, у 16 – Т=рТ), высокий риск – у 12 (у 4 пациентов выявлено рТ3а, у 8 – Т=рТ).
Местнораспространенная форма заболевания (стадия Т3а) до РПЭ была у 6 пациентов, из них рТ2b у 4 больных, рТ3а – у 2.
 Говоря о принципах воздействия ВИФУ, следует отметить эффект локальной гипертермии без повреждения окружающих тканей. Именно это позволило применить ВИФУ при местном рецидиве РПЖ после РПЭ.
Говоря о принципах воздействия ВИФУ, следует отметить эффект локальной гипертермии без повреждения окружающих тканей. Именно это позволило применить ВИФУ при местном рецидиве РПЖ после РПЭ.
В клинической практике при лечении методом ВИФУ используются аппараты Ablatherm® (EDAP TMS S.A., Франция) и Sonablate® (Focus Surgery Inc., США). Мы в своей работе применяем аппарат Ablatherm® robotic HiFu (EDAP, Франция).
В комплектацию аппарата Ablatherm® входят:
- лечебный модуль – операционный стол с электронными блоками внутри корпуса и приспособлениями для контроля за неподвижностью пациента;
- управляющий модуль – компьютерная консоль и программное обеспечение;
- эндоректальный зонд – совмещенные ультразвуковой сканер с частотой 7,5 МГц, позволяющий получать изображение в продольной и поперечной плоскостях, и генератор фокусированного ультразвука (3 МГц, фокусное расстояние 40 мм);
- одноразовые расходные материалы – реагенты к охлаждающей системе для защиты стенки прямой кишки и др.
Этот аппарат позволяет осуществлять всю процедуру лечения без смены зондов, имеет автоматизированную систему контроля в реальном времени за положением пациента и стенки его прямой кишки, что максимально снижает риск ее повреждения и развития осложнений.
Противопоказания к лечению ВИФУ: утолщенная стенка прямой кишки (или имеющиеся ректоуретральные фистулы, раковая инфильтрация стенки прямой кишки, металлические клипсы в зоне анастомоза или другие гиперэхогенные включения между прямой кишкой и зоной лечения, препятствующие более 7 мм по данным трансректального УЗИ [ТРУЗИ]), предшествующие прохождению ультразвуковых волн; размер ампулы прямой кишки – менее 50 см3, отсутствие прямой кишки.
Всем больным с местным рецидивом РПЖ после простатэктомии перед сеансом ВИФУ устанавливали уретральный катетер в мочевой пузырь не только для дренирования, но и с целью лучшей ориентировки во время планирования лечения при ультразвуковом наведении (рис. 1).
Алгоритм аблации ВИФУ зоны пузырно-уретрального анастомоза (ПУА) принципиально не отличается от такового при первичном лечении. Однако следует отметить, что время лечения зависит от объема ткани и, как правило, сеанс выполняется 1–2 блоками за 15–40 мин. Пациенты проводят в операционной в среднем 1 ч, что значительно отличается от первичного сеанса ВИФУ, когда лишь время лечения составляет 2–3 ч. После планирования лечения уретральный катетер удаляли и лечение парауретральной зоны осуществляли без катетера. Уретральное дренирование возобновляли после лечения. В послеоперационном периоде проводили антибактериальную и противовоспалительную терапию. Уретральный катетер удаляли на 5–7-е сутки.
До выполнения сеанса ВИФУ всем больным было проведено стандартное комплексное обследование: определение уровня ПСА, УЗИ, ТРУЗИ, урофолоуметрия. Наряду с этим всем пациентам выполнена МРТ с контрастным усилением (ректальная катушка, напряженность поля – 1,5 Т), остеосцинтиграфия. Семнадцати больным проведено гистосканирование. По результатам обследования местный рецидив имел место преимуще- ственно в группах высокого и умеренного риска онкологического прогрессирования, у 66% больных с локализацией в области ПУА.
Новаторство нашего исследования заключалось не только в лечении локального рецидива РПЖ методом ВИФУ и в диагностике путем выполнения МРТ, но и в применении инновационных методов визуализации патологического процесса, в частности ги- стосканирования (HistoScanning). Данная методика позволяет проводить структурный математический анализ ультразвуковой картины области анастомоза, выявляя подозрительные на неопластический процесс изменения. В клинике урологии Первого МГМУ им. И. М. Сеченова данный метод диагностики РПЖ широко применяется с 2011 г. При разработке технологии гистосканирования было проведено сравнение результатов гистологического исследования и акустических характеристик опухолевой ткани простаты у 40 тыс. пациентов. Изменения, обнаруживаемые при гистосканировании, неразличимы при традиционном УЗИ в серой шкале и в допплеровском режиме.
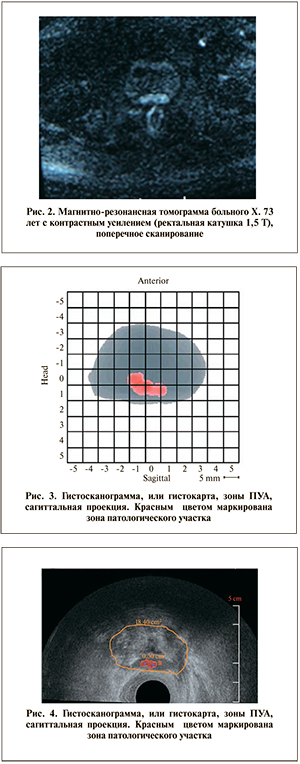
Рецидив заболевания во всех случаях был доказан морфологически. Для этого пациентам проводилась пункционная трансректальная биопсия в зависимо- сти от зоны накопления контрастного препарата при МРТ (рис. 2) и выявления патологических участков при гистосканировании.
Метод гистосканирования, как и МРТ, позволяет точнее и результативнее выполнять биопсии зоны ПУА пациентам с подозрением на местный рецидив РПЖ. Это утверждение подтверждено практически, поскольку с 2011 г. биопсии 28% из общего числа пациентов в клинике урологии Первого МГМУ им. И. М. Сеченова проводились под контролем гистосканирования. Такая прицельность процедуры позволяет сокращать число биоптатов.
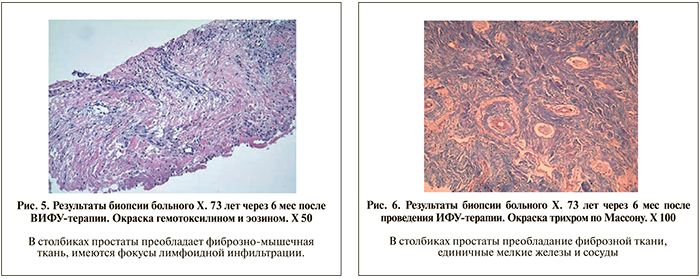
Отличием гистосканирования ПУА от гисто- сканирования простаты является произвольный выбор зоны интереса для структурного анализа, ориентиром служит шейка мочевого пузыря (рис. 3). В отсутствие визуализируемых при ТРУЗИ изменений в зоне анастомоза мы выбирали для анализа зону, по форме близкую к эллипсоиду с длинной осью (3 см) вдоль уретры и короткими осями (по 2 см) перпендикулярно к ней (15% пациентов). При наличии визуализируемого участка, подозрительного на рецидив, зона сканирования могла быть ограничена лишь им. Так мы поступали при его размере более 1 см в любом из измерений (3% пациентов).
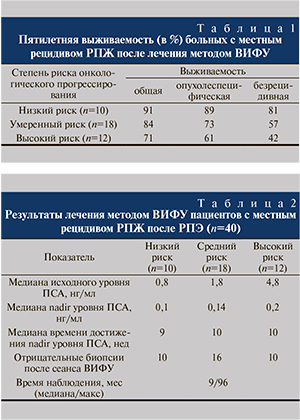
Учтя вышесказанное, при выполнении биопсии для повышения ее точности мы ориентировались на картину ТРУЗИ с экстраполированными результатами гистосканирования (рис. 4). Для ведения медицинской документации и статистического анализа было достаточно гистокарты.
Впоследствии мы оценили частоту совпадения результатов гистосканирования, МРТ и морфологического исследования биоптатов.
Для лучшего понимания топографии ПУА и профилактики осложнений в виде гематурии и уретроррагии перед биопсией мочевой пузырь дренировали уретральным катетером. После лечения ВИФУ всем пациентам проводилась контрольная биопсия в сроки от 6 мес до года.
 Результаты. В 95% наблюдениях локализация зоны накопления контрастного препарата в зоне ПУА на МРТ совпадали с расположением патологических участков при гистосканировании. Частота совпадения результатов морфологического исследования и данных МРТ составила 94%, гистосканирования и морфологического исследования – 93%.
Результаты. В 95% наблюдениях локализация зоны накопления контрастного препарата в зоне ПУА на МРТ совпадали с расположением патологических участков при гистосканировании. Частота совпадения результатов морфологического исследования и данных МРТ составила 94%, гистосканирования и морфологического исследования – 93%.
Переходя к анализу лечения больных, следует отметить, что мы смогли добиться 5-летней безрецидивной выживаемости более чем для 50% пациентов умеренной группы риска с местным рецидивом. Это наиболее большая группа пациентов с локализованной стадией заболевания (табл. 1).
В табл. 2 представлены динамика уровня ПСА в ходе послеоперационного мониторинга больных и результаты контрольной биопсии пациентов с местным рецидивом РПЖ после лечения методом ВИФУ в зависимости от онкологического риска. Nadir уровня ПСА спустя 3 мес наблюдения составил 0,1 нг/мл. Такие цифры преобладали у пациентов группы низкого онкологического риска. От 13% пациентов мы не смогли добиться стабилизации опухолевого процесса, от 3 пациентов – высокого онкологического риска и от 2 – среднего.
Морфологическая картина тканей после лечения методом ВИФУ при безрецидивном течении напрямую зависела от срока взятия контрольного биопсийного материала. Спустя 2–3 мес после проведения ВИФУ-терапии наблюдались участки коагуляционного некроза, расширенные полнокровные сосуды, а также выраженный отек стромы органа.
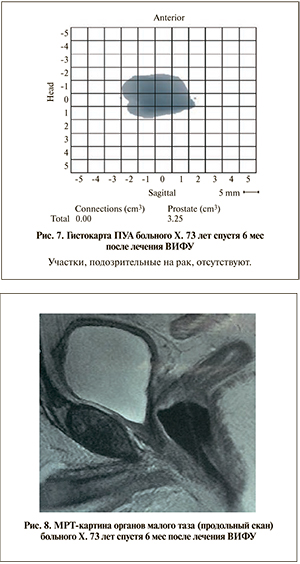
В биоптатах, взятых через 6–7 мес после проведения терапии методом ВИФУ, наблюдали в основном преобладание фиброзной ткани, единичные железы с признаками атрофии эпителия, а иногда и фокусы очаговой лимфоидной инфильтрации (рис. 5, 6). В очень редких случаях даже спустя 6 мес в единичных биоптатах сохранялись фокусы коагуляционного некроза.
При неудовлетворительном лечении на фоне фиброзных изменений отмечали фокусы разрастания мелкоацинарной аденокарциномы.
У 8 (17%) пациентов было отмечено отхождение некротических масс в послеоперационном периоде, 10 (22%) больных предъявляли жалобы на боль в промежностной области, которая проходила самостоятельно в среднем через 1 мес после лечения. Воспалительные изменения нижних мочевых путей были отмечены у 3 (7%) пациентов. У 3 пациентов возникло недержание мочи после сеанса ВИФУ, у 2 проблема разрешилась на 25–30-е сутки после операции. Одному пациенту мы были вынуждены констатировать недержание мочи III степени. К сожалению, в течение первого года наблюдения у 8 (17%) больных мы отметили развитие рубцовой деформации (стриктуры) зоны ПУА, что в связи с плохим мочеиспусканием требовало хирургической коррекции в виде оптической уретротомии или резекции склеротически измененных тканей шейки мочевого пузыря и зоны анастомоза. В то же время в нашей клинической практике (46 пациентов) нам удалось избежать наиболее тяжелых послеоперационных осложнений, таких как ректоуретральные фистулы и ожоги стенки прямой кишки. Ни у одного из пациентов не отмечена выраженная гематурия. За время исследования не было ни одного летального исхода (интраоперационно и спустя 3 мес после операции). Экстренных хирургических вмешательств после сеанса ВИФУ, переливания крови также не потребовалось. Основываясь на представленных данных, мы уже сейчас можем говорить: метод ВИФУ является одним из наиболее безопасных в лечении рецидива РПЖ.
Приводим клиническое наблюдение
 Б о л ь н о й Х 73 лет, диагноз: аденокарцинома простаты pT2aN0M0G2. В 2004 г. в связи с повышением уровня ПСА до 8,1 нг/мл выполнена биопсия простаты, выявлена умеренно-дифференцированная аденокарцинома. Тогда же проведена радикальная простатэктомия. Гистологическое заключение: аденокарцинома 3+3=6 баллов по Глисону, края резекции отрицательные. В дальнейшем, в 2008 г., отмечен рост уровня ПСА до 4,49 нг/мл. При УЗИ в зоне ПУА выявлен участок солидной ткани, подозрительный на локальный рецидив РПЖ. 23.10.13 проведена пункционная трансректальная биопсия зоны ПУА с применением гистосканирования. Гистологическое заключение: картина умеренно дифференцированной аденокарциномы, 3+4=7 баллов по Глисону.
Б о л ь н о й Х 73 лет, диагноз: аденокарцинома простаты pT2aN0M0G2. В 2004 г. в связи с повышением уровня ПСА до 8,1 нг/мл выполнена биопсия простаты, выявлена умеренно-дифференцированная аденокарцинома. Тогда же проведена радикальная простатэктомия. Гистологическое заключение: аденокарцинома 3+3=6 баллов по Глисону, края резекции отрицательные. В дальнейшем, в 2008 г., отмечен рост уровня ПСА до 4,49 нг/мл. При УЗИ в зоне ПУА выявлен участок солидной ткани, подозрительный на локальный рецидив РПЖ. 23.10.13 проведена пункционная трансректальная биопсия зоны ПУА с применением гистосканирования. Гистологическое заключение: картина умеренно дифференцированной аденокарциномы, 3+4=7 баллов по Глисону.
При ТРУЗИ в зоне анастомоза определен солидный участок ткани, подозрительный на рецидив, размером до 2,5х1,1х1,4 см.
При гистосканировании были выявлены участки ткани подозрительной структуры в зоне анастомоза (рис. 3).
В ходе МРТ малого таза с контрастным усилением в проекции ПУА отмечена гомогенная структура со сниженной интенсивностью сигнала размером 20х8х10 мм, располагающаяся преимущественно по передней и правой стенкам анастомоза, накапливающая контрастное вещество (рис. 2).
Пациенту выполнена аблация ВИФУ зоны ПУА с патологическим участком.
До начала сеанса лечения мочевой пузырь дренирован уретральным катетером. После разметки и планирования зоны аблации катетер удален, лечение проводилось двумя блоками. Продолжительность операции составила 28 мин. После окончания лечения мочевой пузырь вновь дренирован уретральным катетером Фолея № 14 Ch.
Уретральный катетер был удален на 5-е сутки. Длительность стационарного лечения составила 7 дней. Через 2 мес после операции уровень ПСА составил 0,01 нг/мл, через 6 мес — 0,005 нг/мл. Неоадъювантная или адъювантная гормональная терапия пациенту не назначалась. При контрольном обследовании: МРТ органов малого таза, ТРУЗИ и гистосканировании через 6 мес солидных образований в зоне анастомоза визуализировать не удалось (рис. 7, 8).
Заключение. Магнитно-резонансная томография органов малого таза с контрастированием и гисто- сканирование – высокоинформативные методы диагностики местного рецидива РПЖ у пациентов после РПЭ. Дальнейшие исследования позволят более четко определять оптимальные сроки исследований и разработать более четкую схему мониторинга.
Высокоинтенсивный фокусированный ультразвук у больных местным рецидивом РПЖ после РПЭ является высокоэффективным методом лечения. При воздействии ВИФУ возникает некроз измененной ткани ПУА с минимальным повреждением окружающих тканей и минимальными побочными эффектами, имеется возможность ранней оценки эффективности лечения и прогноза.
Несомненно, применение ВИФУ представляет большой интерес как для практикующих урологов, так и для пациентов, страдающих РПЖ. Данная методика пока имеет статус экспериментальной, но с упором на клинические данные, количество интра- и послеоперационных осложнений можно предположить, что ВИФУ-терапия местного рецидива РПЖ имеет хорошие перспективы занять достойное место среди методов лечения онкоурологических больных.



