Введение. Криотерапия представляет собой аблацию ткани путем локального воздействия очень низкой температуры. Более полное определение этого термина предложено B. Patel и соавт., которые считают криоаблацию процессом локального замораживания и девитализации тканей, позволяющим прицельно создать зону некроза необходимых формы и размера для деструкции пораженной ткани и прилежащих по краю здоровых клеток [1]. В 1996 г. Американская ассоциация урологов признала тотальную криоаблацию простаты методом терапии локализованного рака предстательной железы (РПЖ) и перестала считать данную методику экспериментальной. В Рекомендациях Европейской ассоциации урологов (2014) отмечено, что криоаблация представляет собой альтернативный, минимально инвазивный, высокоэффективный способ лечения РПЖ [2].
Целью нашего исследования было проведение проспективного анализа собственных результатов криоаблации простаты у больных РПЖ.
Материалы и методы. С марта 2010 по сентябрь 2014 г. в клинике урологии МГСМУ криоаблация простаты с использованием системы «SeedNet» («Galil Medical») проведена 122 больным РПЖ (табл. 1). В 90% случаев (n=110) лечение было первичным, в 10% (n=12) – сальважным (7 пациентов ранее перенесли дистанционную лучевую, 3 – брахитерапию, 2 – первичную криоаблацию простаты). У всех пациентов имела место гистологически верифицированная аденокарцинома простаты. Для 113 больных диагноз был установлен в клинике урологии МГМСУ/ГКБ № 50 г. Москвы или подтвержден при пересмотре микропрепаратов в нашей клинике до операции; в 9 случаях пересмотр стекол биопсии не проводился. По данным биопсии простаты сумма баллов по Глисону 6 (3+3), 7 (3+4), 7 (4+3) и 8 (4+4) имела место у 52 (43%), 37 (30%), 25 (20%) и 8 (7%) пациентов соответственно. Клиническая стадия Т1сN0M0 установлена у 59 (49%) пациентов, Т2N0M0 – у 43 (35%), Т3N0M0 – у 20 (16%) По критериям D’Amico 47 (39%) пациентов относились к группе низкого риска, 55 (45%) – к группе промежуточного риска и 20 (16%) – к группе высокого риска.
 По показаниям пациентам выполняли остеосцинтиграфию и магнитно-резонансную томографию малого таза.
По показаниям пациентам выполняли остеосцинтиграфию и магнитно-резонансную томографию малого таза.
По назначению уролога онкодиспансера 34% пациентов получали неоадъювантную гормонотерапию в течение 3–6 мес до операции. Никто из больных, перенесших тотальную криоаблацию простаты, не был заинтересован в сохранении сексуальной функции: средняя сумма баллов по шкале IIEF составила 2,4 (1–8) балла. До операции 58% пациентов регулярно принимали различные препараты по поводу симптомов нарушенного мочеиспускания (α-адреноблокаторы, ингибиторы 5α-редуктазы, фитопрепараты).
Трем (2,5%) пациентам ранее выполнена трансвезикальная простатэктомия, 5 (4%) – трансуретральная резекция простаты (ТУР) по поводу доброкачественной гиперплазии предстательной железы (ДГПЖ). У всех оперированных ранее пациентов, по данным трансректальной ультрасонографии и фиброцистоскопии, отсутствовал ТУР-дефект, который мог бы препятствовать плотному прилеганию к слизистой уретры согревающего ее катетера.
В 121 случае операция выполнена под эпидуральной или спинномозговой анестезией, одному больному (по решению анестезиолога) – под эндотрахеальным наркозом.
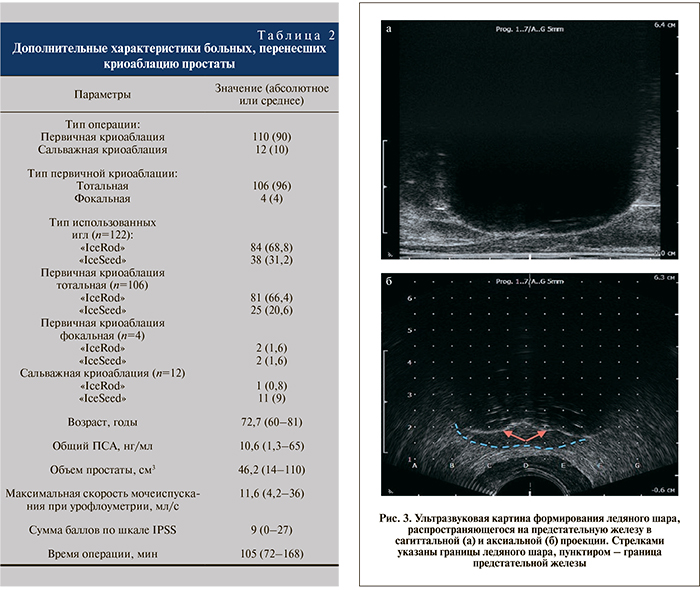
При выполнении криоаблации простаты пациента укладывали в положение для операций на промежности. После фиброцистоскопии мочевой пузырь дренировали по уретре катетером Фолея №16 или 18 Fr (с баллоном, наполненным до 20 мл, для лучшей визуализации шейки мочевого пузыря). Выполняли УЗИ простаты трансректальным биплановым датчиком производства компании «ВК medical, закрепленным в стабилизирующем пошаговом устройстве с координатной решеткой (рис. 1). В соответствии с описанной техникой операции [3] под ультразвуковым контролем в ткань предстательной железы трансперинеально вводили криоиглы и температурные датчики (рис. 2 а, б, в). Кроме того, температурные датчики устанавливали в зону наружного сфинктера (первые 40 операций) и фасции Денонвилье. После введения игл для исключения перфорации стенки уретры и мочевого пузыря выполняли фиброцистоскопию. Затем в мочеиспускательный канал по струне устанавливали катетер, согревающий уретру, и выполняли 2 или 4 цикла замораживания/оттаивания (в зависимости от размеров предстательной железы и используемых игл; рис. 3 а, б). После извлечения игл согревание уретры продолжалось еще 15 мин, в течение которых с гемостатической целью осуществляли давление на промежность пациента. В конце операции мочевой пузырь дренировали по уретре силиконовым катетером Фолея № 14 или 16 Fr (n=121); одному пациенту была установлена цистостомическая дренажная трубка.
Техника проведения фокальной криоаблации простаты описана нами ранее [4].
 Результаты и обсуждение. Впервые в России крио-
аблация простаты с использованием системы «SeedNet» (производитель – «Galil Medical») выполнена 16.03.2010 в клинике урологии МГМСУ на базе ГКБ № 50 Москвы.
Результаты и обсуждение. Впервые в России крио-
аблация простаты с использованием системы «SeedNet» (производитель – «Galil Medical») выполнена 16.03.2010 в клинике урологии МГМСУ на базе ГКБ № 50 Москвы.
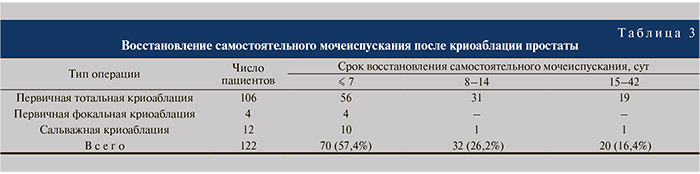
Средний возраст пациентов составил 72,7 (60–81) года, уровень общего простатспецифического антигена (ПСА) в крови – 10,6 (1,3–65) нг/мл, объем простаты – 46,2 (14–110) см3, максимальная скорость мочеиспускания – 11,6 (4,2–36) мл/с, сумма баллов по шкале I-PSS – 9 (0–27) (табл. 2). Продолжительность операции в среднем составила 105 (72–168) мин.
Тотальная первичная криоаблация простаты выполнена 106 (87%) больным, фокальная – 4 (3%), сальважная – 12 (10%) пациентам. В 84 случаях использованы иглы «IceRod», в 38 — «IceSeed». В 3 (2,5%) наблюдениях (при объеме простаты более 80 см3) потребовалось провести 4 цикла замораживания и оттаивания (так называемый маневр pull-back).
У 3 пациентов, перенесших ранее ТУР простаты и аденомэктомию (n=1), при проведении фиброцисто- скопии в начале операции был выявлен стеноз шейки мочевого пузыря, потребовавший выполнения ТУР шейки мочевого пузыря до установки криоигл и катетера, согревающего уретру.
Интраоперационно у 1 пациента отмечена неадекватная работа системы, согревающей уретру, приведшая впоследствии к отхождению струпа слизистой уретры и потребовавшая выполнения ТУР шейки мочевого пузыря через 4 мес после криоаблации простаты. В 11 случаях возникли выраженные технические трудности при введении катетера, согревающего уретру, обусловленные анатомическими особенно-стями строения уретры и простаты.
Течение послеоперационного периода было гладким во всех случаях. Всем больным проведена антибактериальная терапия (парентерально 5–7 сут, затем перорально еще 3 нед), а также лечение α-адреноблокаторами (1 мес).
После удаления на 7-е сутки уретрального катетера у 57,4% пациентов восстановлено самостоятельное мочеиспускание (включая 1 пациента, у которого была пережата цистостомическая трубка и заживлен пузырно-кожный свищ). У 42,6% больных в ближайшие часы или вечером в день удаления катетера развилась острая задержка мочи, потребовавшая однократной катетеризации или повторной установки катетера. У 32 пациентов самостоятельное мочеиспускание восстановилось в течение ≤2 нед, у 20 – в течение 3–6 нед после операции (табл. 3).
У 53% пациентов в течение 3–7 сут после операции отмечен умеренно выраженные отек мошонки и полового члена, у 58% больных имели место петехии на промежности, в области корня мошонки и пениса, не требовавшие проведения специального лечения.

Протокол наблюдения за больными после криоаблации простаты в клинике урологии МГМСУ включает определение уровня общего ПСА крови каждые 3 мес и проведение биопсии простаты через год всем пациентам (независимо от уровня ПСА). При наблюдении свыше года уровень ПСА определяется 1 раз в 6 мес, биопсия рекомендуется по показаниям. Спустя 3, 6 и 12 мес после операции также оценивается характер мочеиспускания (пациенты заполняют опросник I-PSS, выполняется урофлоуметрия, определяется объем остаточной мочи).
К сентябрю 2014 г. медиана наблюдения за пациентами составила 28,5 мес. Через год после криоаблации полностью обследованы 63 больных: средний уровень общего ПСА в крови у них составил 0,28 (0,001–12,8) нг/мл, сумма баллов по шкале I-PSS – 12 (2–18), максимальная скорость мочеиспускания – 10,4 (4,4–32) мл/с, объем остаточной мочи – 84 (0–160) мл. При контрольной биопсии аденокарцинома выявлена у 4/63 пациентов: 2 больным выполнена сальважная криоаблация простаты, 2 – дистанционная лучевая терапия. У 1 пациента с исходной стадией заболевания Т3N0M0 отмечен быстрый рост уровня ПСА после операции, начата гормональная терапия с положительным эффектом.
При наблюдении в течение года 59 пациентов полностью удерживали мочу, 4 больных отмечали эпизоды ургентного недержания мочи 3–7 раз в неделю (использовали не более 1 прокладки в день), у 1 пациента, перенесшего до криоаблации ди- станционную лучевую терапию, отмечено тотальное недержание мочи. В 1 случае выполнена двусторонняя орхидэктомия по поводу острого гнойного орхоэпидидимита (через 3 мес после криоаблации). Случаев формирования уретроректальной фистулы не отмечено.
Безрецидивная выживаемость в нашем исследовании составила 92% (5/63) или 96% (5/122). Оценка общей и раковоспецифической выживаемости при вышеуказанной медиане наблюдения преждевременна.
В настоящее время не существует общепринятых критериев оценки успеха криоаблации простаты. В 2008 г. Американской ассоциацией урологов опубликован документ о статусе криоаблации предстательной железы (Best Practice Statement on Cryosurgery for the Treatment of Localized Prostate Cancer), в котором отмечено отсутствие унифицированных критериев эффективности криотерапии простаты [5].
В 2008 г. J. Jones и соавт. представили сведения из регистра COLD (Cryo On-Line Database) о биохимической безрецидивной выживаемости больных РПЖ разных групп риска, согласно критериям D’Amico [6]. При использовании критерия биохимического рецидива Phoeniх [7] 5-летняя выживаемость пациентов низкого, среднего и высокого риска составила 91,1%, 78,5 и 62,2% соответственно. По данным J.Cohen и соавт., 10-летняя выживаемость 204 больных без биохимического рецидива, согласно критерию Phoenix, в группах низкого, среднего и высокого риска равнялась 80,56%, 74,16 и 45,54% соответственно [8].
Очевидно, что чем ниже уровень общего ПСА после криоаблации простаты, тем меньше вероятность рецидива РПЖ. Вместе с тем, до какого именно значения должен снизиться уровень ПСА, остается неясным [9].
D. Levy и соавт. [10] сообщили о корреляции уровня общего ПСА после криоаблации и вероятности биохимического рецидива РПЖ. При лечении 2427 больных содержание ПСА <0,6 нг/мл после криоаблации простаты было достигнуто 80,2% пациентов. Пятилетняя безрецидивная выживаемость больных низкого, среднего и высокого риска составила 86%, 67 и 51% (определение Phoenix) при изначальном снижении уровня ПСА <0,6 нг/мл. Если ПСА после криоаблации составлял ≥0,6 нг/мл, через 24 мес в среднем у 29,5% больных отмечен биохимический рецидив РПЖ независимо от группы риска [10].
Заключение. Криоаблация простаты – сравнительно новый для России метод оперативного лечения РПЖ. В настоящее время в урологической клинике МГМСУ имеется наибольший опыт в РФ по проведению криоаблации предстательной железы, что позволило нам получить сертификат центра, обучающего врачей методике криоаблации.
Адекватная подготовка группы врачей и среднего медицинского персонала в сочетании с тщательной селекцией пациентов на этапе освоения методики позволяют достигать удовлетворительных результатов лечения. Техника обучения криоаблации сравнительно проста, особенно для урологов, владеющих методиками брахитерапии, трансректальной ультрасонографии и биопсии простаты.
К особенностям развития программы криоаблации предстательной железы в нашей клинике относятся преимущественно первичный характер операции (почти 90% случаев), отказ от рутинного использования интраоперационной цистостомии, разработка ряда технических приемов, оптимизирующих технику проведения операции, минимальное количество серьезных осложнений (n=2 Clavien III), выполнение контрольной биопсии простаты всем пациентам спустя год, а также трудности при отборе пациентов для фокальной криоаблации простаты [11].
Оценка онкологических и долгосрочных функцио- нальных результатов криоаблации предстательной железы продолжается в настоящее время.


