Вопросы наиболее адекватного подхода к лечению больных симптомами нарушенного мочеиспускания (СНМ), обусловленными гиперплазией предстательной железы (ГПЖ), не теряют актуальности многие годы. В первую очередь это связано с увеличением продолжительности жизни населения и ростом заболеваемости данной нозологией. Так, к 60 годам гистологически ГПЖ выявляют у 50% мужчин, к 85 годам – у 90%. Установлено, что симптомы заболевания возникают примерно у половины больных гистологически верифицированной ГПЖ. Известно также, что около 30% мужчин в возрасте старше 65 лет имеют умеренные или выраженные СНМ, детерминированные аденомой простаты, а около трети мужчин, доживающих до 80 лет, подвергаются оперативному лечению по поводу ГПЖ [1, 2].
Крупномасштабные популяционные исследования последних лет убедительно доказали прогрессирующий характер ГПЖ [3, 4]. В настоящее время установлены основные факторы риска прогрессирования заболевания. К ним относятся возраст, объем предстательной железы ≥30 см3, уровень простатспецифического антигена (ПСА) сыворотки крови ≥1,5 нг/мл, суммарный балл симптомов по анкете I-PSS ≥7 (симптомы нижних мочевых путей средней и тяжелой степеней) [5–8].
Наличие у пациента одного или нескольких факторов риска значительно увеличивает вероятность прогрессирования заболевания. В связи с этим особую актуальность приобрела оценка эффективности медикаментозной терапии в отношении не только СНМ, но и способности снижать риск таких последствий прогрессирования ГПЖ, как острая задержка мочеиспускания (ОЗМ) и/или необходимость оперативного вмешательства.
Проблема ГПЖ является предметом неугасающего интереса урологов, и с каждым годом расширяется спектр исследуемых и применяемых способов как медикаментозного, так и оперативного лечения.
Знания о патогенезе ГПЖ, полученные во второй половине XX в., позволили совершить качественный скачок в области ее медикаментозной терапии, обосновав необходимость сочетанного воздействия на заболевание. Не только уменьшение симптоматики, но и влияние на патогенетические механизмы развития ГПЖ определили дальнейший курс развития терапии и формирование риск-ориентированных подходов к лечению. Таким образом, было определено одно из ключевых правил – использование лекарственных комбинаций.
Общие принципы комбинированной терапии были сформулированы в 1988 г. M. Epstein и J. Oster и заключались в простоте назначения и удобстве для врача и пациента, повышении у больного приверженности к лечению (комплаентности), потенциировании и/или аддитивном действии, уменьшении выраженности побочных эффектов (в случае снижения дозы одного или обоих компонентов) [9].
 Обоснованная профессором Ю. А. Пытелем и А. З. Винаровым концепция комбинированной терапии, впервые представленная в программном докладе на Пленуме Всероссийского общества урологов в Саратове в 1994 г., впоследствии была полностью подтверждена многочисленными клиническими исследованиями и в настоящее время активно применяется в лечении пациентов с умеренными и выраженными расстройствами мочеиспускания, вызванными ГПЖ [10].
Обоснованная профессором Ю. А. Пытелем и А. З. Винаровым концепция комбинированной терапии, впервые представленная в программном докладе на Пленуме Всероссийского общества урологов в Саратове в 1994 г., впоследствии была полностью подтверждена многочисленными клиническими исследованиями и в настоящее время активно применяется в лечении пациентов с умеренными и выраженными расстройствами мочеиспускания, вызванными ГПЖ [10].
На сегодня комбинацией, доказавшей высокую эффективность и целесообразность применения, является сочетание ингибитора 5α-редуктазы и α1-адреноблокатора. Такая терапия не только воздействует на клинические проявления, но и уменьшает возможные риски прогрессирования, снижая частоту различных осложнений ГПЖ. В основу такого подхода легли результаты исследования MTOPS, продемонстрировавшего преимущества многостороннего подхода к лечению [11]. В настоящее время можно утверждать, что применение монотерапии α1-адреноблокатором должно ограничиваться только ранними формами ГПЖ у пациентов без рисков прогрессирования заболевания. В остальных случаях рациональным следует считать комбинированную терапию с учетом выраженности симптомов и проявлений заболевания в точном соответствии с состоянием здоровья пациента и целями лечения.
Эта позиция нашла отражение в рекомендациях Европейской ассоциации урологов, регламентирующей риск-ориентированные подходы к терапии ГПЖ [12]. Такие принципы лечения ГПЖ оказались весьма жизнеспособными и не только способствовали укреплению позиций концепции комбинированной терапии, но и обусловили появление на фармацевтическом рынке «готовых» сочетаний лекарственных препаратов. Эффективность комбинации ингибитора 5α-редуктазы и α1-адреноблокатора, доказанная в мультицентровых плацебо-контролируемых исследованиях, послужила основанием к созданию нового комбинированного препарата, состоящего из лекарственных средств обеих групп, Дуодарта, недавно зарегистрированного в РФ. Такая комбинация эффективнее, чем монотерапия ингибиторами 5α-редуктазы или блокаторами α1-адренорецепторов, облегчает симптомы ГПЖ и замедляет клиническое прогрессирование заболевания. Примечателен факт синергизма действия двух лекарственных средств, продемонстрированный в одном из исследований: вместе препараты в большей степени, чем каждый из них в отдельности, улучшали субъективную (I-PSS) и объективную (максимальная скорость мочеиспускания) симптоматику [13].
Одним из наиболее значимых исследований по сравнительному анализу возможностей комбинированной и монотерапии ингибитором 5α-редуктазы и α1-адреноблокатором в отношении отдаленных исходов заболевания (ОЗМ, необходимость оперативного лечения) у пациентов с высоким риском прогрессирования ГПЖ было двойное слепое 4-летнее исследование CombAT (Сombination of Avodart and Tamsulosin).
Симптоматика пациентов была умеренной и выраженной (не менее 12 баллов по шкале I-PSS). Заключительный анализ результатов данного исследования был представлен в журнале European Urology в 2010 г. [13]. В исследовании приняли участие 4844 пациента с установленным диагнозом доброкачественной ГПЖ и высоким риском прогрессирования заболевания (табл. 1).
Больные были рандомизированы в 3 группы:
- группа комбинированной терапии (дутастерид 0,5 мг/сут+тамсулозин 0,4 мг/сут, n=1610);
- группа лечения дутастеридом (0,5 мг/сут, n=1623);
- группа лечения тамсулозином (0,4 мг/сут, n=1611).
Лечение в группах продолжалось в течение 48 мес.

Первичной целью исследования стала оценка эффективности 4-летнего комбинированного лечения дутастеридом и тамсулозином по сравнению с монотерапией каждым из препаратов отдельно в отношении рисков развития ОЗМ или оперативного лечения, а также клинического прогрессирования ГПЖ у мужчин, имеющих повышенный риск прогрессирования заболевания. Анализ результатов через 2 года с начала исследования убедительно показал, что комбинированная терапия дутастеридом и тамсулозином статистически значимо снижает суммарный балл I-PSS по сравнению с любым из вариантов монотерапии (в каждом из сравнений p<0,001). Так, средние снижения I-PSS по сравнению с исходным значением составили 6,2 балла для комбинированного лечения против 4,9 и 4,3 балла для дутастерида и тамсулозина соответственно. В результате обработки данных продемонстрировано, что большее статистически значимое снижение балла I-PSS от исходного наблюдалось для комбинированной терапии по сравнению с дутастеридом с 3-го месяца, а для комбинированной терапии по сравнению с тамсулозином – с 9-го месяца лечения. Указанное преимущество комбинированной терапии по сравнению с монотерапией тамсулозином в период от 24 до 48 мес продолжало увеличиваться (от 1,8 до 2,5 балла), а по сравнению с монотерапией дутастеридом сохранялось и поддерживалось (от 1,3 до 0,96 балла).
Подобно субъективной симптоматике, данная тенденция наблюдалась и при оценке динамики пиковой скорости мочеиспускания (Qmax). Так, к 24-му месяцу в группе комбинированной терапии отмечено увеличение Qmax на 2,4 мл/с, что статистически значимо (p<0,006) превосходило таковое в группах дутастерида и тамсулозина, где рост Qmax составил соответственно 1,9 и 0,9 мл/с. Достоверное преимущество комбинированной терапии по данному показателю отмечено с 6-го месяца лечения и сохранялось до конца лечения.
К 48-му месяцу скорректированное среднее увеличение Qmax по сравнению с исходным значением составило 2,4 мл/с для группы комбинированной терапии по сравнению с 2 мл/с (p=0,05) для группы дутастерида и 0,7 мл/с (p<0,001) для группы тамсулозина.

Для оценки риска развития ОЗМ или оперативного лечения больных ГПЖ с факторами прогрессирования в группах анализировали время до события/долю пациентов с ОЗМ или оперативным вмешательством, обусловленными ГПЖ. Установлено, что время до первого эпизода ОЗМ или до операции по поводу ГПЖ было значимо больше в группе комбинированной терапии по сравнению с группой тамсулозина (p<0,001). В то же время существенного различия между группой комбинированной терапии и группой дутастерида не отмечено (p=0,18). Весьма существенным результатом стало то, что уже начиная с 9-го месяца в группе тамсулозина по сравнению с группами комбинированной терапии и дутастерида имела место значительно более высокая частота ОЗМ и/или операций по поводу ГПЖ. Степень этого различия со временем, вплоть до 48-го месяца терапии, увеличивалась (рис. 1, табл. 2).
По состоянию на 48-й месяц лечения комбинированная терапия снижала относительный риск развития ОЗМ или операции по поводу ГПЖ на 65,8% по сравнению с тамсулозином (p<0,001) и на 19,6% по сравнению с дутастеридом (р>0,05). При раздельном сравнительном анализе групп комбинированной терапии и тамсулозина в первой относительный риск ОЗМ снижался на 67,6%, а риск операции по поводу ГПЖ уменьшался на 70,6%. При сравнении же с группой монотерапии дутастеридом снижение относительного риска на фоне комбинированной терапии составило 18,3% для ОЗМ и 31,1% для операции по поводу ГПЖ. Однако различие по времени до события между группами лечения было статистически незначимым (p=0,37 и p=0,074 соответственно; рис. 2).

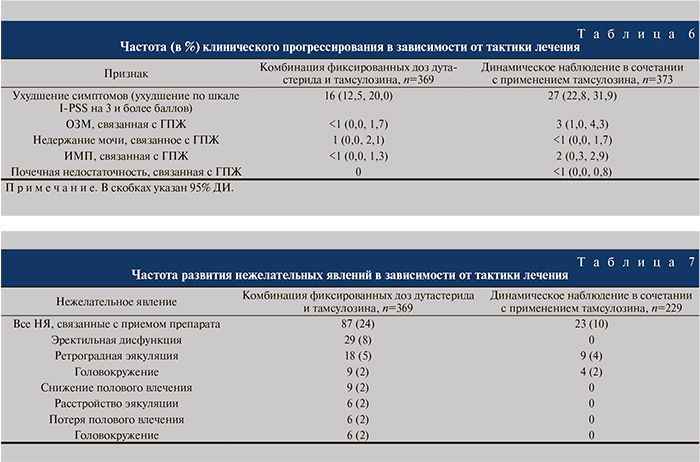
Также в ходе анализа оценивали влияние терапии на общее клиническое прогрессирование ГПЖ. Данное понятие применялось не только к больным развившейся ОЗМ, но и к пациентам с увеличением степени выраженности симптомов по шкале I-PSS на 4 и более баллов, с появившимися недержанием мочи, рецидивирующими инфекциями мочевых путей/уросепсисом или почечной недостаточностью, связанными с ГПЖ. Время до первого эпизода клинического прогрессирования ГПЖ значительно различалось в пользу комбинированной терапии по сравнению с тамсулозином и дутастеридом (p<0,001 для обоих сравнений). Комбинированная терапия снижала относительный риск клинического прогрессирования ГПЖ на 44,1% по сравнению с тамсулозином и на 31,2% по сравнению с дутастеридом. Прогрессирование симптомов на 4 и более баллов по шкале I-PSS было самым частым проявлением клинического прогрессирования в каждой группе лечения (табл. 3).
Приведенные данные свидетельствуют о том, что у пациентов с высоким риском прогрессирования ГПЖ комбинированная терапия дутастеридом и тамсулозином имеет ряд преимуществ перед каждым из монорежимов. При этом немаловажно, что хотя в группе комбинированного лечения частота препарат-ассоциированных нежелательных явлений (НЯ) была выше, это не оказало существенного влияния на переносимость терапии. В итоге частота отмены терапии по причине связанных с препаратом нежелательных событий была сходной во всех группах лечения (табл. 4).
Различий в общей частоте сердечно-сосудистых явлений во всех группах лечения не отмечено, несмотря на то что частота диагноза «сердечная недостаточность» была выше в группах комбинированной терапии (14 из 1610; 0,9%) и монотерапии тамсулозином (10 из 1611; 0,6%), чем в группе монотерапии дутастеридом (4 из 1623; 0,2%). Следует отметить, что частота сердечной недостаточности (≤1%) во всех трех группах лечения в исследовании CombAT была ниже, чем частота событий в группе плацебо через 2 года в ключевых исследованиях III фазы по ГПЖ (1,3%). Подводя итог, можно заключить, что профиль наиболее часто отмечавшихся НЯ при применении комбинированной терапии соответствовал ранее выявленному при монотерапии каждым из препаратов и в целом комбинированная терапия хорошо переносилась в течение 4 лет исследования.
Между тем активно внедряемые в клиническую практику риск-ориентированные подходы к лечению пациентов, ступенчатость терапии в зависимости от тяжести состояния пациента актуализировали использование тактики активного наблюдения, включающей помимо постоянного мониторинга состояния пациентов с ГПЖ, смену образа жизни и т.д. Важным вопросом, вытекающим из подобной парадигмы, стало определение сроков начала медикаментозной терапии, ее объема и критериев назначения. Появилась необходимость оценки предложенных схем комбинаций с учетом новейших достижений фарминдустрии.
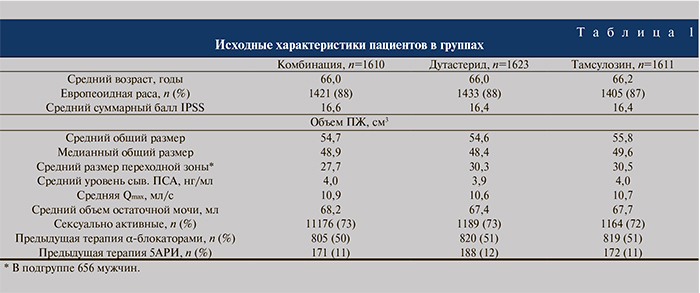
Таким важным и наиболее современным исследованием по комбинированной терапии ГПЖ явилось 2-летнее исследование CONDUCT по изучению эффективности и безопасности комбинации дутастерида и тамсулозина в фиксированной дозировке (Дуодарт®) по сравнению с активным наблюдением и последующим назначением тамсулозина в случае ухудшения симптоматики, сопровождающееся в обоих случаях рекомендациями по образу жизни и направленное на терапию ранее не лечившихся пациентов с умеренно выраженной симптоматикой доброкачественной ГПЖ, результаты которого опубликованы в 2015 г. [14]. Это было открытое рандомизированное мультицентровое международное исследование IV фазы, в котором приняли участие 742 пациента из 8 стран и которое проходило с декабря 2010 по октябрь 2013 г. Основной целью было подтвердить или опровергнуть гипотезу о большей эффективности применения Дуодарта по сравнению с активным наблюдением за пациентами и их последующей терапией тамсулозином в случае отрицательной динамики выраженности симптомов (рис. 3).
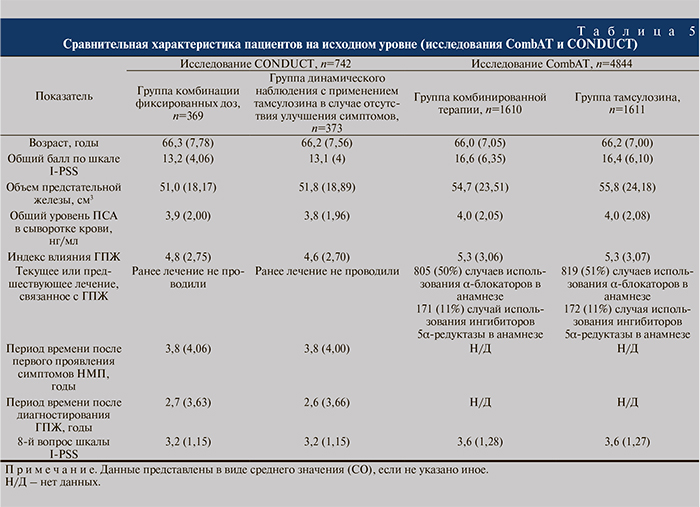
Все пациенты (n=742) были старше 50 лет с установленным диагнозом доброкачественной ГПЖ, умеренными СНМ (I-PSS 8–19 баллов), объемом простаты по данным ТРУЗИ≥30 см3 и уровнем общего ПСА≥1,5 нг/мл на момент скрининга, т.е. имели высокий риск прогрессирования (табл. 5).
На наш взгляд, наиболее интересно рассмотреть группы пациентов, вошедших в исследование CONDUCT, с позиций сравнения с исследованием CombAT. В оба исследования были рандомизированы пациенты с высоким риском прогрессирования заболевания (высоким уровнем ПСА, увеличенным объемом предстательной железы). Однако к отличительным особенностям выборки CONDUCT относились меньшая тяжесть состояния этих пациентов и отсутствие какого-либо лечения по поводу ГПЖ в анамнезе. Такие критерии позволили максимально приблизить дизайн исследования к реальной клинической практике и наиболее адекватно оценить предлагаемые терапевтические подходы к этой группе пациентов.
Таким образом, исследование CONDUCT дополнило имеющуюся клиническую информацию (исследование CombAT) о назначении комбинированной терапии пациентам с ГПЖ средней степени тяжести, которые имеют риск прогрессирования заболевания за счет не только особенностей выборки, но и самого дизайна: использован показатель эффективности предшествующего (4 нед ранее) назначения комбинации фиксированных доз дутастерида и тамсулозина и сравнение с динамическим наблюдением в сочетании с применением тамсулозина в случае отсутствия положительной динамики состояния.
Всем пациентам, принимавшим участие в данном исследовании, помимо изучаемой лекарственной терапии давали советы по образу жизни, способствующему улучшению качества жизни – сокращение потребления жидкостей, отказ или умеренное потребление кофеина и алкоголя, использование приемов расслабленного и двойного мочеиспускания, массаж уретры, техники отвлечения внимания, повторная тренировка мочевого пузыря, анализ принимаемых лекарственных препаратов, предоставление необходимой помощи в случае нарушения двигательных возможностей, лечение запоров.
Больные были рандомизированы в две группы:
- группа комбинированной терапии (Дуодарт, n=369);
- группа активного наблюдения с последующим лечением тамсулозином (0,4 мг/сут, n=373).
Наблюдение за пациентами в обеих в группах продолжалось в течение 24 мес.
Первичной целью исследования стала оценка изменения субъективной симптоматики (по шкале I-PSS) с момента начала исследования и до его окончания через 24 мес. Вторичными целями исследования были показатели улучшения симптоматики на 2, 3 балла и более или на 25% от исходного (по шкале I-PSS), число пациентов с клиническим прогрессированием ГПЖ (ухудшение симптоматики на 3 и более баллов по шкале I-PSS), а также частота возникновения ОЗМ, инфекции мочевых путей (ИМП) и признаков почечной недостаточности, вызванных ГПЖ. Также результаты лечения оценивали по шкале BII, качества жизни и ответов на вопросы опросника PPST. Полностью завершили 2-летнее исследование 292 (79%) пациента группы Дуодарта и 300 (80%) – группы тамсулозина. Двести двадцать девять пациентов второй группы стали получать тамсулозин в первые 6 мес наблюдения в связи с ухудшением симптоматики по шкале I-PSS, что и служило основанием к назначению соответствующей протоколу терапии.
Анализ результатов убедительно показал, что комбинированная терапия дутастеридом и тамсулозином статистически значимо снижает суммарный балл I-PSS по сравнению с группой сравнения (терапия тамсулозином после активного наблюдения). Причем данные изменения происходят начиная с первого месяца терапии (р<0,001; рис. 3, а).
Так, к 24-му месяцу среднее изменение балла I-PSS в группе Дуодарта составило -5,4 балла против -3,6 – в группе тамсулозина, назначаемого после активного наблюдения за пациентами с отрицательной динамикой симптомов (p<0,001, 95% доверительный интервал [ДИ] – -2,5, -1,2). Начиная с 9-го месяца и до конца исследования все пациенты группы комбинированной терапии Дуодартом испытывали легкие симптомы (I-PSS<8), в то время как выраженность симптомов у пациентов в группе сравнения (тамсулозин) оставалась на протяжении всего исследования умеренной (8–19; рис. 3, б).
Значимые изменения в симптоматике, согласно шкале I-PSS (более чем на 3 балла или на 25% и выше от исходных значений), происходили в группе комбинированной терапии по сравнению с группой тамсулозина – 77 против 64% и 73 против 60% пациентов соответственно (р<0,001).
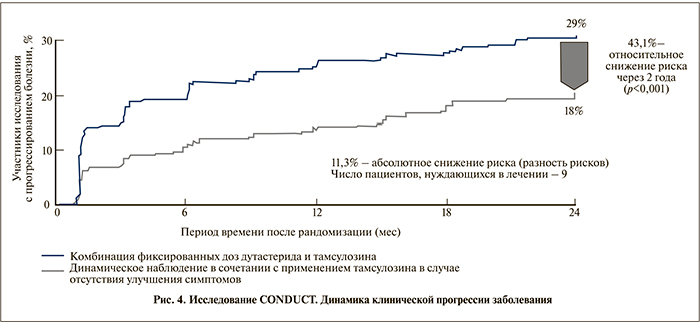
К 24-му месяцу исследования клиническое прогрессирование заболевания наблюдалось у 29% мужчин группы тамсулозина и лишь у 18% мужчин группы Дуодарта. Комбинированная терапия достоверно снижала относительный риск клинического прогрессирования заболевания на 43,1% (95% ДИ – 22,5, 58,2) по сравнению с контрольной группой пациентов, принимавших тамсулозин (p<0,001), а абсолютный риск в данной группе снизился на 11,3% (рис. 4).
В обеих группах наиболее частым проявлением клинического прогрессирования было ухудшение симптоматики на 3 и более баллов по шкале I-PSS. Это имело место в отношении 16% пациентов группы Дуодарта и 27% пациентов группы тамсулозина (табл. 6).
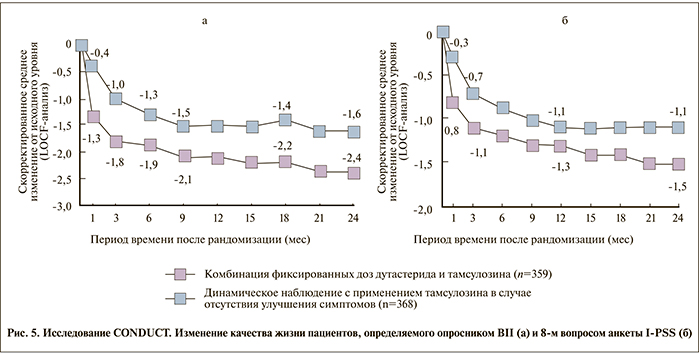
Что касается качества жизни пациентов, определяемого опросниками BII и 8-м вопросом анкеты I-PSS, то достоверные различия между группами наступили с первого месяца лечения и сохранялись до окончания наблюдения (р<0,001; рис. 5).
К концу 24-го месяца среднее изменение оценки по опроснику BII в группе Дуодарта составило -2,4 балла против -1,6 в группе тамсулозина (p<0,001, 95% ДИ – -1,2, -0,5). Изменения в ответе на 8-й вопрос анкеты I-PSS в группе Дуодарта демонстрировали разницу в -1,5 балла против -1,1 в группе тамсулозина (p<0,001, 95% ДИ – -0,6, -0,2), что иллюстрировало тот факт, что большинство пациентов группы Дуодарта были бы не против прожить остаток жизни с той выраженностью симптомов, которая была у них на момент окончания участия в исследовании.
Оценка безопасности терапии проведена для всех 369 пациентов группы, получавшей в качестве терапии комбинацию дутастеридом и тамсулозином (Дуодарт), и 229 пациентов контрольной группы, которые стали получать тамсулозин после активного наблюдения в связи с ухудшением симптоматики. Наиболее часто встречающимися НЯ в обеих группах оказались эректильная дисфункция и ретроградная эякуляция, которые имели место соответственно у 8% мужчин группы Дуодарта и 0% группы тамсулозина и у 5% группы Дуодарта и 4% группы тамсулозина (табл. 7).
Нежелательные явления, связанные с сердечно-сосудистой системой, встречались примерно в равных пропорциях в обеих группах: любые сердечно-сосудистые нарушения встречались в 1,9% (7 пациентов) и 0,8% (3 пациента) наблюдениях сердечной недостаточности в группе Дуодарта, и 2,6% (6 пациентов) всех сердечно-сосудистых нарушений и 0,4% (1 пациент) с сердечной недостаточностью в группе тамсулозина соответственно. Рак простаты диагностирован у одного пациента группы тамсулозина. Также двое пациентов группы тамсулозина умерли по причинам, не связанным с проводимой терапией. Суммируя результаты по изучению безопасности применения комбинированной терапии, можно сделать заключение о ее сравнимом с монотерапией тамсулозином уровне.
Исследование CONDUCT наглядно демонстрирует, что назначение комбинированной терапии ингибиторами 5α-редуктазы и α1-адреноблокаторами при соблюдении рекомендаций по образу жизни способствует более значимому улучшению симптоматики, обусловленной ГПЖ, по сравнению с активным наблюдением при соблюдении аналогичных рекомендаций с последующим назначением α1-адреноблокаторов в случае, если симптоматика не улучшается. Причем преимущество в снижении выраженности симптоматики начиналось с первого месяца приема комбинации и устойчиво сохранялось на протяжении всего времени исследования, убедительно демонстрируя, что раннее назначение комбинированной терапии фиксированными дозами дутастерида и тамсулозина приводит к быстрому избавлению от СНМ и лучшим образом сказывается на качестве жизни.
C одной стороны, отсутствие плацебо-контроля в данном исследовании может считаться потенциальным недостатком дизайна настоящего исследования. Однако современные клинические руководства обычно рекомендуют назначение лечения пациентам с умеренной и выраженной симптоматикой (как в представленных выше исследованиях), в связи с чем вариант контрольной группы, представленной пациентами, также получающими терапию, кажется нам валидной, поскольку отражает реально возможные варианты клинического подхода к терапии.
Лечение после активного наблюдения может быть различным: наиболее часто урологи прибегают к назначению α1-адреноблокаторов, ингибиторов 5α-редуктазы, фитотерапевтических агентов, антимускариновых препаратов и их комбинации. Выбор именно α1-адреноблокаторов в этом исследовании обоснован данными, полученными из шести европейских стран, где более чем 2300 пациентов с впервые диагностированной ГПЖ наиболее часто получали именно тамсулозин [15]. Другим обоснованием выбора терапии контрольной группы послужил анализ более 400 тыс. случаев впервые выявленных СНМ, из которых 58% мужчин находились под активным наблюдением, а 42% начали получать терапию. Около 80% из них получали монотерапию α1-адреноблокатором [16].
Резюмируя данный обзор клинических исследований, следует подчеркнуть, что опубликованные за последние годы результаты больших и долгосрочных исследований показали уникальную на сегодняшний день способность ингибиторов 5α-редуктазы существенно снижать риски прогрессирования заболевания. Данные 4-летнего исследования CombAT свидетельствуют о высокой эффективности и изученной безопасности долгосрочного использования комбинированной терапии дутастеридом и тамсулозином больных ГПЖ с умеренными и выраженными СНМ, имеющих повышенный риск прогрессирования заболевания. Полученные результаты 4-летнего исследования CombAT подтверждают необходимость длительного использования комбинированной терапии дутастеридом и тамсулозином мужчин со среднетяжелыми и тяжелыми СНМ вследствие ГПЖ, имеющих повышенный риск прогрессирования заболевания (объемом простаты не менее 30 см3, ПСА не менее 1,5 нг/мл).
Исследование CONDUCT было первым по изучению эффективности и безопасности комбинации дутастерида и тамсулозина для пациентов с умеренной симптоматикой и риском прогрессирования ГПЖ. Идея критериев выборки связана с тем, что пациенты с подобной симптоматикой наиболее часто встречаются в повседневной врачебной практике. Соответственно, результаты данного исследования позволят практикующим урологам принимать взвешенные решения по терапии пациентов с умеренной симптоматикой и риском прогрессирования ГПЖ.
Вопросы длительности комбинированной терапии также еще не окончательно решены. Ряд авторов считают возможным определенный синергизм, возникающий при применении данных препаратов в комбинации [17]. Однако необходимость постоянной комбинированной терапии также обсуждается. Дальнейшие исследования по изучению причин большего или меньшего прогрессирования ГПЖ у разных пациентов, возможно, прольют свет на данный вопрос.
В качестве примера можно привести исследование SMART-1, в котором авторы настоящего обзора принимали непосредственное участие. В этом рандомизированном плацебо-контролируемом исследовании изучался эффект отмены приема α1-адреноблокатора после его применения в комбинации с ингибитором 5α-редуктазы в течение 6 мес при последующей монотерапии ингибитором 5α-редуктазы. Исследование показало, что после отмены тамсулозина удавалось сохранять выраженность симптомов на уровне, аналогичном таковому в контрольной группе, где пациенты продолжали начатую 6 мес назад комбинированную терапию. Между тем данное правило распространялось не на все группы. Так, пациенты, имевшие изначально высокие значения I-PSS (≥20 баллов) после исключения тамсулозина из состава комбинированной терапии сообщали о более выраженных симптомах, нежели пациенты, продолжавшие получать комбинацию препаратов [18]. Это дает нам основание к дальнейшему изучению режимов медикаментозного лечения пациентов с ГПЖ с целью определения максимально эффективной, безопасной и экономически выгодной тактики.



