В России в 2013 г. было зарегистрировано 31 569 новых случаев рака предстательной железы (РПЖ), а среднегодовой темп прироста заболеваемости данной патологией – самый большой среди всех видов злокачественных новообразований у мужчин (8,09 %) [1]. В лечении РПЖ используют брахитерапию, гормональную терапию, радикальную простатэктомию, дистанционную лучевую терапию. Брахитерапия отличается наименьшими инвазивностью и продолжительностью лечения, а также позволяет лечить больных амбулаторно. Метод брахитерапии заключается в имплантации радиоактивных микроисточников в предстательную железу с помощью полых игл. В зависимости от дозы облучения различают низко- и высокодозную брахитерапию. Низкодозная брахитерапия (перманентная имплантация микроисточников) используется как самостоятельный радикальный метод и на сегодняшний день является одним из ведущих вариантов лечения РПЖ, поскольку позволяет достигать впечатляющих отдаленных результатов лечения пациентов с низким, средним и высоким риском распространения локализованного опухолевого процесса [2, 3]. Традиционно введение микроисточников в железу осуществляется врачом вручную.
У данного способа существует ряд недостатков:
- использование фиксированного шаблона для введения игл, что ограничивает маневренность;
- сложность введения иглы под углом в случае необходимости;
- при дозиметрическом планировании не учитываются факторы движения и деформации предстательной железы и кровотечения, которые имеют место при введении игл;
- влияние человеческого фактора на постоянство, точность и эффективность проведения процедуры.
В связи с вышесказанным все большую актуальность приобретают разработка и внедрение в клиническую практику роботизированных систем для проведения процедуры брахитерапии. Несколько таких систем уже разработано, однако в каждой из них используются стандартные негнущиеся иглы, которые не обеспечивают врачу в полной мере условий, позволяющих избегать определенных препятствий при введении иглы и достигать намеченной цели [4].

Установлено, что более 70% опухолевых очагов располагается по периферии предстательной железы [5, 6]. Однако введение иглы в периферическую зону затруднительно из-за сложности с прокалыванием капсулы предстательной железы вдали от ее центральной оси [7]. Отдельно стоит выделить такой фактор, как отек предстательной железы при проведении брахитерапии, который развивается при введении игл в ткани железы [8, 9]. L. Eapen и соавт. [10] установили, что травма предстательной железы, обусловленная введением игл, вносит значительный вклад в развитие побочных эффектов со стороны мочеполовой системы (недержание мочи, острая задержка мочеиспускания, стриктуры уретры). Авторы предложили свести к минимуму манипуляции иглами по околомочеточниковой траектории. J. Shan и соавт. [11] изучали зависимость развития побочных эффектов со стороны прямой кишки (например, острая диарея) от количества используемых при проведении брахитерапии игл. Было показано, что более выраженная острая диарея развивалась в случае использования большего числа игл и, очевидно, из-за более выраженной травмы в области передней стенки прямой кишки от тех игл, посредством которых микроисточники вводятся в дорсальную поверхность предстательной железы. На основании этого можно предположить, что, сократив число используемых игл, а значит, и количество манипуляций, можно улучшить результаты брахитерапии.
Проблемы введения игл в периферическую зону предстательной железы могут быть устранены путем использования нового типа иглы, которую можно свободно размещать в соответствии с формой предстательной железы. Исследователи [12] занимались созданием гибких игл, которые могли бы «подстраиваться» под особенности геометрии предстательной железы (рис. 1). В предлагаемом авторами подходе иглы вводятся вблизи, но не вдоль центральной оси предстательной железы по криволинейной траектории (криволинейный подход к имплантации микроисточников). Было показано, что при использовании подхода по формированию криволинейной траектории улучшаются почти все дозиметрические параметры (равномерность распределения дозы облучения по предстательной железе, средняя ректальная доза) по сравнению с прямолинейным подходом; сокращая площадь введения за счет использования меньшего числа игл, удается уменьшить отек предстательной железы и минимизировать дискомфорт для пациента.
 Для того чтобы обеспечить иглам необходимые параметры гибкости, в их изготовлении стали применять специальные сплавы, позволяющие получать иглы с памятью формы (СПФ-иглы). В случае использования таких игл критическим моментом служит отслеживание пути следования данной иглы по намеченной траектории, что затруднительно при проведении процедуры брахитерапии. B. Ruiz и соавт. разработали роботизированную систему с приводом для СПФ-игл для проведения брахитерапии [13]. Реальная траектория иглы отслеживается с помощью электромагнитного сенсора, расположенного на кончике иглы. Предварительные результаты показали, что данный привод для СПФ-игл обеспечивает адекватную изогнутую конфигурацию игл, соответствующую геометрическим особенностям предстательной железы. В клинической практике был использован способ введения гибких игл по криволинейной траектории при транскутанных вмешательствах на почке [14]. F. Orlando и соавт. [15] сравнивали адекватность трех методов контроля за введением СПФ-игл: электромагнитных сенсоров, прямой визуализации (камера) и ультразвука. Среднеквадратичное отклонение значений от намеченной траектории было минимальным в случае использования электромагнитных сенсоров, что позволило авторам рассматривать данный способ обратной связи как наиболее точный. Худшие результаты были получены в случае использования ультразвукового контроля: плохое качество изображения по сравнению с веб-камерой требует большего количества вычислений для сопоставления с образцом траектории введения иглы.
Для того чтобы обеспечить иглам необходимые параметры гибкости, в их изготовлении стали применять специальные сплавы, позволяющие получать иглы с памятью формы (СПФ-иглы). В случае использования таких игл критическим моментом служит отслеживание пути следования данной иглы по намеченной траектории, что затруднительно при проведении процедуры брахитерапии. B. Ruiz и соавт. разработали роботизированную систему с приводом для СПФ-игл для проведения брахитерапии [13]. Реальная траектория иглы отслеживается с помощью электромагнитного сенсора, расположенного на кончике иглы. Предварительные результаты показали, что данный привод для СПФ-игл обеспечивает адекватную изогнутую конфигурацию игл, соответствующую геометрическим особенностям предстательной железы. В клинической практике был использован способ введения гибких игл по криволинейной траектории при транскутанных вмешательствах на почке [14]. F. Orlando и соавт. [15] сравнивали адекватность трех методов контроля за введением СПФ-игл: электромагнитных сенсоров, прямой визуализации (камера) и ультразвука. Среднеквадратичное отклонение значений от намеченной траектории было минимальным в случае использования электромагнитных сенсоров, что позволило авторам рассматривать данный способ обратной связи как наиболее точный. Худшие результаты были получены в случае использования ультразвукового контроля: плохое качество изображения по сравнению с веб-камерой требует большего количества вычислений для сопоставления с образцом траектории введения иглы.
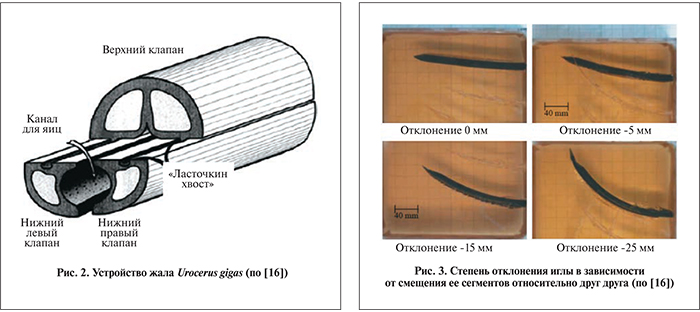
Рассматривая возможности использования гибких игл, следует также обратить внимание на их конструктивное исполнение. При планировании операции брахитерапии с низкодозным облучением одним из главных этапов является доставка и расположение микроисточников в опухоли по заранее составленному дозиметрическому плану. Поэтому взаимосвязь между конструктивом самой иглы и способом ее перемещения в тканях влияет на вероятность повреждения тканей железы, возможность обхода препятствий по криволинейной траектории и точность позиционирования микроисточников при их расположении. Так, S. Ko и соавт. [16] реализовали принцип управления движением иглы по криволинейной траектории, взяв за основу принцип работы жала насекомого Urocerus gigas (Рогохвоста большого) (рис. 2).
В ходе испытаний сконструированных подобным образом игл осуществлено перемещение иглы с различной степенью смещения (изгиба) (рис. 3), при этом точность позиционирования кончика иглы составила 0,68±1,45 мм.
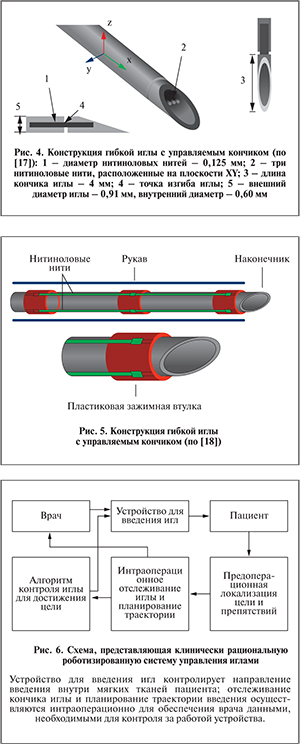
P. Swaney и соавт. [17] предложили для повышения управляемости иглы и увеличения кривизны траектории обеспечить несколько степеней свободы асимметричному кончику иглы, расположив нитиноловые нити по всей длине тела иглы (рис. 4). Наличие степени свободы у кончика позволяет увеличить угол отклонения, тем самым повысить маневренность иглы и ее управляемость, как следствие – потенциально уменьшить травматизацию тканей.
В работе [18] предложена конструкция гибкой иглы, в которой нитиноловые нити располагаются по ее внешней стороне на специальных зажимных втулках (рис. 5). При таком расположении обеспечивается прямой контакт ткани и нитей, которые обладают свойством памяти формы под воздействием температуры, в результате чего игла отклоняется и движение происходит по криволинейной траектории [18].
При создании робототехнической системы для проведения брахитерапии важна не только разработка специальных игл и оптимальной траектории их введения, но и обеспечение методов контроля за поведением иглы в организме при выполнении процедуры брахитерапии. N. Abolhassani и соавт. предложили модель контроля за отклонением иглы от заданного направления с использованием ультразвуковой визуализации для обратной связи [19]. В работе [20] представлен вариант контроля с помощью оценки силы, прилагаемой к игле при подкожных вмешательствах. S. Ko и соавт. [16] предложили схему с закрытым контуром для контроля управляемым зондом с использованием электромагнитного сенсора, который отслеживает траекторию введения игл в режиме 2D. Исследователи [21] разработали алгоритм выравнивания плоскости введения игл вдоль плоскостной траектории. Используя стереокамеру для определения координат кончика иглы, авторы реализовали концепцию «наблюдателя» для примерного расчета таких параметров, как ротационная степень свободы иглы, которую ранее было невозможно измерить. Отклонение иглы с коническим кончиком от заданной траектории можно контролировать, используя специальный алгоритм, который позволяет варьировать кривизной иглы, меняя соотношение между периодом введения иглы с вращением и общим периодом введения [22, 23]. D. Glozman и соавт. [24] использовали инверсную кинематику гибкой иглы, вводимой в вязкоупругую модель ткани. Было показано, что траектория иглы не уникальна и оптимизация процесса введения может быть осуществлена за счет сведения к минимуму латерального давления тела иглы на ткань. E. Dehghan и соавт. [25] оптимизировали методику определения угла и глубины введения иглы, используя 3D-модель ткани, в которой находится несколько «мишеней».
Интересно исследование [26], в котором в условиях эксперимента авторы использовали алгоритмы 3D-планирования и контроля траектории введения иглы под контролем ультразвука, который остается одним из наиболее доступных методов визуализации в клинической практике. Схема процедуры введения игл с использованием предлагаемой авторами роботизированной системы контроля представлена на рис. 6.
Изображения интересующей анатомической области врач получает перед операцией в виде ультразвуковых снимков. На основании данных изображений врач определяет локализацию «мишеней» (места введения микроисточников), чувствительных тканей, которые необходимо защитить от облучения (в случае брахитерапии — прямая кишка, мочеточники), и возможные препятствия на пути движения иглы. Траектория введения иглы для достижения цели и обхода препятствий генерируется с помощью разработанного алгоритма. Кроме того, планирующее устройство интраоперационно задает новые пути движения иглы по мере обработки данных о реальном положении кончика иглы (полученных с помощью ультразвука) и «мишени» во время процедуры. Таким образом, процесс введения иглы становится автономным, но происходит под наблюдением врача.
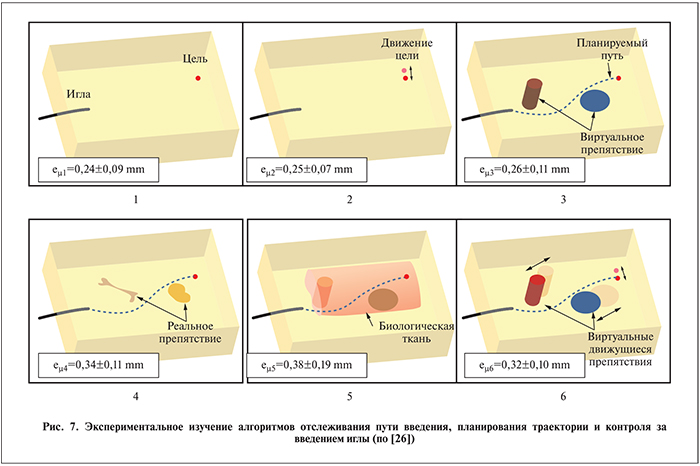
Установку оценивали на фантоме мягких тканей, сделанном из желатиновой смеси, в которую была добавлена кремниевая пудра, чтобы создать акустическое рассеяние подобное тому, которое имеет место в тканях человека. Были использованы СПФ-иглы из сплава никеля и титана. Авторы рассматривали несколько экспериментальных сценариев, чтобы более подробно оценить поведение и возможности предлагаемых алгоритмов отслеживания пути введения, планирования траектории и контроля за введением иглы (рис. 7).
Для каждого из рассматриваемых случаев авторами была рассчитана ошибка наведения (еµ), которая определялась как абсолютное расстояние между реальным положением кончика иглы и его заданным положением в конце введения.
Основное преимущество рассматриваемых алгоритмов заключается в следующем: игла вращается только в случае, когда необходимо изменить направление введения. Соответственно, уменьшается число вращений иглы, что потенциально позволит снизить травматичность процедуры. Обсуждая результаты выполненных экспериментов, авторы отмечают, что видимость иглы на ультразвуковых снимках ухудшается из-за теней окружающих ее твердых препятствий, что влияет на точность наведения. Ошибка наведения увеличивается при управлении введением иглы в биологической ткани из-за ее неоднородности. Это обусловливает изменение поведения иглы в ходе введения. По результатам экспериментальных исследований ошибка наведения варьировалась от 0,24±0,09 до 0,38±0,19 мм.
Однако в условиях клинических испытаний стоит ожидать снижения точности наведения, поскольку свой вклад начинают вносить такие факторы, как физиологическое движение ткани, потоки биологических жидкостей и тканевая неоднородность. Функции системы управления могут быть расширены до того, чтобы учитывать физиологическое смещение предстательной железы, которое происходит во время введения игл (например, при дыхании). В целом в условиях эксперимента было показано, что предлагаемые для роботизированной системы алгоритмы введения иглы под контролем доступного способа визуализации (ультразвука) обеспечивают достаточную точность введения игл и могут уменьшать травмирующее влияние процедуры на биологические ткани.
В заключение можно сделать вывод, согласно которому результаты проведенных на сегодняшний день теоретических и практических исследований формируют научно-технический задел в области создания гибких игл и методов контроля за их перемещением в составе робототехнических комплексов для проведения процедуры брахитерапии.
Благодарности. Статья подготовлена при финансовой поддержке Минобрнауки в ходе выполнения работ по Соглашению № 14.575.21.0035 RFMEFI57514X0035 от 27.06.2014 о предоставлении субсидии в целях реализации федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технического комплекса России на 2014–2020 годы».


