Введение. Мочекаменная болезнь (МКБ) является одним из распространенных урологических заболеваний и в общей популяции встречается не менее чем у 3–5% населения [1–9]. В 1955 г. W. Goodwin впервые внедрил в практику пункционную нефростомию, что послужило началом перкутанной хирургии. В дальнейшем J. Wickham, P. Alken и K. Amplatz усовершенствовали методику дилатации нефростомического канала, а M. Marberger впервые создал нефроскоп, предназначенный непосредственно для выполнения чрескожной нефролитотрипсии (ЧНЛТ). С 1984 г. и по сей день ЧНЛТ остается «золотым» стандартом в хирургическом лечении коралловидных и крупных камней почек. Появление любой новой методики хирургического лечения ввиду отсутствия должного опыта всегда сопровождается массой вопросов, таких как выбор дренажа, особенности течения послеоперационного периода, необходимость медикаментозных назначений, сроки удаления дренажей.
В 1986 г. H. Winfield и соавт. [10] на основании проведенного анализа после- и интраоперационных осложнений рекомендовали дренировать чашечно-лоханочную систему (ЧЛС) после ЧНЛТ нефростомой сроком на 24–48 ч. К данной методике и по настоящее время в большинстве случаев прибегают по завершении ЧНЛТ. Нефростомический дренаж позволяет адекватно оценивать функциональное состояние прооперированной почки, а также в случае возникновения кровотечения осуществлять тампонаду ЧЛС путем пережатия нефростомического дренажа с последующим отмыванием сгустков [11–13]. Однако еще в 1984 г., на заре перкутанной хирургии, J. Wickham представил результаты 100 успешных бездренажных операций [14], тем самым доказав, что у определенной категории пациентов и при достаточном опыте оперирующего хирурга возможна бездренажная ЧНЛТ.
Усовершенствование методов литотрипсии, методики пункционного доступа к ЧЛС, а также появление эндоскопических инструментов малого диаметра для выполнения мини-чрескожных оперативных пособий послужило толчком к появлению большого количества наблюдений с альтернативными методами дренирования ЧЛС после ЧНЛТ [15–20]. В 1997 г. G. Bellman и соавт. [21] представили результаты 50 успешных безнефростомных операций, при которых дренирование верхних мочевыводящих путей осуществлялось с помощью мочеточникового стента (tubeless). В 2007 г. A. Shpall и соавт. при безнефростомной ЧНЛТ предложили использовать стент с лигатурой, фиксированной на проксимальном его конце [22]. А в 2014 г. S. Choi и соавт. [23] представили успешные результаты 54 полностью бездренажных ЧНЛТ. Масса исследований, посвященных изучению различных методов дренирования, обусловлена в первую очередь желанием улучшить качество жизни пациентов в послеоперационном периоде, снизить продолжительность послеоперационного койко-дня и сократить сроки восстановления трудовой активности пациентов.
На кафедре урологии Первого МГМУ им. И. М. Сеченова ЧНЛТ проводят с 2000 г., к настоящему моменту выполнено более 1000 операций. С 2009 г. накоплен опыт использования различных методов как внутреннего, так и наружного дренирования ЧЛС после ЧНЛТ.
Целью работы было определить возможности выбора метода дренирования верхних мочевыводящих путей после ЧНЛТ исключительно на основании данных дооперационного обследования, тем самым заранее спрогнозировать особенности послеоперационного периода и сроки пребывания в стационаре.
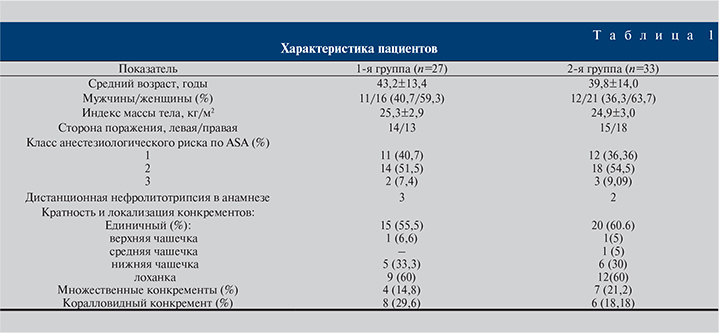
Материалы и методы. Исследование выполнено на базе клиники урологии ГБОУ ВПО «Первый МГМУ им. И. М. Сеченова». В исследование были включены 60 пациентов, которым с марта 2013-го по декабрь 2014 г. была выполнена классическая ЧНЛТ с диаметром нефростомического канала 28–30 Сh (дилатацию нефростомического хода осуществляли при помощи Амплац-бужей). Все пациенты на догоспитальном этапе были разделены на две группы. В 1-ю группу вошли 27 пациентов, которым было запланировано наружное дренирование (нефростомический дренаж) ЧЛС, во 2-ю – 33 пациента с различными вариациями внутреннего дренирования ЧЛС: катетер-стент (17 человек), катетер-стент с лигатурой на коже (13) и мочеточниковый катетер с наружным выведением (3).
Исследование носило исключительно проспективный характер, поэтому в обеих группах метод дренирования ЧЛС выбирали на дооперационном этапе, а не непосредственно во время операции. По той же причине в исследование были включены только те пациенты, которым на догоспитальном этапе было выполнено максимальное количество исследований, необходимых для точной оценки локализации, размеров и количества конкрементов. Операции всем пациентам выполняли хирурги, обладающие богатым опытом в эндоскопической хирургии и с опытом более 150 чрескожных нефролитотрипсий.
Предоперационное обследование включило УЗИ, компьютерную томографию (КТ), нефросцинтиграфию, в некоторых наблюдениях экскреторную урографию, обзорную рентгенографию. Также всем пациентам было выполнено мультипланарное 3D-моделирование [24, 25]. Метод основан на воссоздании единой картины патологического процесса в трехмерном режиме путем совмещения всех четырех фаз исследования почек, полученных при мультиспиральной КТ (МСКТ) с контрастным усилением. Данная программа позволяет без искажений визуализировать как все фазы МСКТ в одном изображении, так и раздельно каждую фазу – нативную, артериальную, паренхиматозную, экскреторную, что обеспечивает получение исчерпывающей информации об анатомических особенностях пораженной почки. При этом дополнительно стало возможным создать эффект послойно-тканевой прозрачности, что дает оперирующему хирургу уникальные виртуальные данные о взаимоотношении патологического процесса с крупными внутрипочечными сосудами и элементами ЧЛС.
Техника выполнения оперативного пособия, а именно пункционный доступ, дилатация нефростомического хода, а также сам рабочий элемент (нефроскоп), в двух группах была одинаковой. Для бужирования нефростомического хода использовали дилататоры Амплац, с помощью которых производили расширение хода в два приема: бужем промежуточного размера (18–22 Сh) и последним бужем (26–30 Сh), по которому устанавливали амплац-трубку для последующего заведения нефроскопа. В случае установки нефростомического дренажа использовали нефростомы с баллончиком диаметром 22–24 Сh. Диаметр катетеров-стентов и мочеточниковых катетеров составил 7 Сh.
Интраоперационно для выявления резидуальных фрагментов конкрементов выполняли контрольную нефроскопию под рентгенологическим контролем.
Установка нефростомического дренажа планировалась в следующих случаях:
- большие размеры и относительно высокая плотность конкремента, для удаления которого могло потребоваться множество времени (100 или более минут);
- длительность оперативного пособия, обусловленная трудностью литотрипсии, сопряженная с высоким риском интраоперационных осложнений и кровотечения;
- для полного удаления конкремента планировалось более одного доступа к ЧЛС (всем пациентам, вошедшим в наше исследование, конкременты были удалены через 1 доступ);
- выраженные ретенционные изменения ЧЛС;
- хроническая пиурия и положительный результат бактериологического посева мочи;
- атаки острого пиелонефрита в анамнезе.
Во всех остальных случаях верхние мочевыводящие пути планировалось дренировать внутренним дренажом, выбор которого осуществлялся хирургом интраоперационно.
Обе группы были сопоставимыми по возрасту, полу, индексу массы тела, анестезиологическому риску (ASA) оперативного пособия, наличию в анамнезе оперативных пособий по поводу МКБ, кратности и локализации конкрементов (табл. 1).
Для измерения объема кровопотери использовали формулу, предложенную в 1976 г. Hartung и соавт., для определения интраоперационной кровопотери при трансуретральных вмешательствах. С этой целью тщательно собирали и измеряли объем промывной жидкости. После завершения операции жидкость тщательно перемешивали и несколько миллилитров забирали для определения в ней содержания гемоглобина. Расчет величины кровопотери производили по следующей формуле:
![]()
где Vкр – объем кровопотери (л); Нbж – уровень гемоглобина в промывной жидкости (г/л); Vж – объем промывной жидкости (л); Нbк – уровень гемоглобина крови больного перед операцией (г/л).
Кроме того, для оценки интраоперационной кровопотери и кровопотери в раннем послеоперационном периоде оценивали уровень гемоглобина до и через 3–4 ч после операции.
Для оценки выраженности боли после операции использовали визуальную аналоговую шкалу (VAS). Ввиду своей простоты данная шкала позволяет проводить опрос пациента в раннем послеоперационном периоде непосредственно через несколько часов после операции, а также оценивать динамику боли в ходе наблюдения. Всех пациентов опрашивали вечером непосредственно в день операции, утром второго дня, перед тем как активизировали пациента, на 3-и и 5-е сутки.
Кроме этого оценивали послеоперационный койко-день, а также сроки удаления дренажей.
Критерием исключения из исследования являлось наличие резидуальных конкрементов, требовавших повторного оперативного пособия.
Для исключения наличия резидуальных конкрементов в раннем послеоперационном периоде проводили контрольное УЗИ, обзорную рентгенографию и при необходимости антеградную пиелоуретерографию.
Результаты. Основной задачей исследования было подтвердить правильность выбора на дооперационном этапе метода дренирования ЧЛС.
Из исследования исключен 1 пациент, у которого в раннем послеоперационном периоде, по данным контрольного УЗИ и рентгенографии, был выявлен резидуальный конкремент. В 4 (6,8%) из 59 наблюдений по причине интраоперационного кровотечения из нефростомического хода и непредвиденных технических трудностей, связанных со сложностью литотрипсии и литоэкстракции, для дренирования верхних мочевыводящих путей вместо запланированного катетера-стента был использован нефростомический дренаж. Данные пациенты были исключены из 2-й группы и включены в 1-ю. Таким образом, в 4 из 59 случаев метод дренирования верхних мочевыводящих путей был выбран ошибочно, т.е. процент достоверности прогноза выбора метода дренирования составил 93,2.
Продолжительность оперативного пособия в 1-й группе, где изначально планировалась установка нефростомического дренажа, а значит, предполагалась более длительная и сопряженная с риском кровотечения ЧНЛТ, в среднем составила 104±17 мин. Данный показатель совпал с общепринятыми рекомендациями: в случае продолжительности оперативного пособия свыше 100 мин дренировать верхние мочевыводящие пути нефростомическим дренажом [26]. Во 2-й группе с предполагаемой установкой внутреннего дренажа длительность операции в среднем составила 71±19 мин. Данная цифра объясняется более удобным расположением конкрементов для литотрипсии и дальнейшего извлечения их фрагментов.
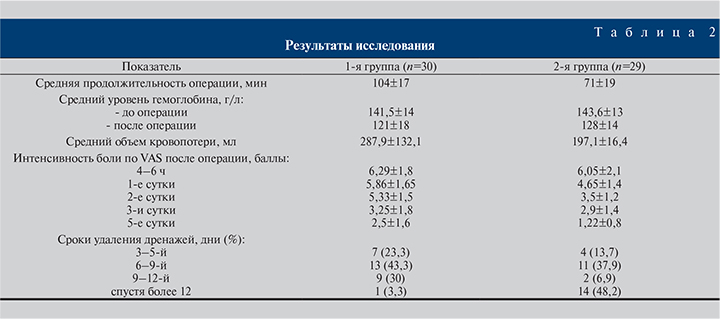
В 1-й группе средняя величина интраоперационной кровопотери составила 287,9±132,1, во 2-й – 197,1±16,4 мл. Исходный средний уровень гемоглобина был сопоставимым, составив 141,5±13 и 143,6±18 г/л в 1-й и 2-й группах соответственно. Однако в раннем послеоперационном периоде соответствующие показатели составили уже 121±13 и 128±14 г/л.
Анализ полученных данных показал, что у пациентов, которым на дооперационном этапе планировалось дренирование ЧЛС нефростомой, потери гемоглобина составили в среднем 20,5 г/л, а у пациентов, которым планировалось дренирование ЧЛС внутренними дренажами, – 15,6 г/л.
Сопоставив показатели продолжительности оперативного пособия и объема интраоперационной кровопотери, мы получили подтверждение правильности оценки предполагаемого объема оперативного пособия и выбора метода дренирования верхних мочевыводящих путей на дооперационном этапе.
Эффективность того или иного выбора метода дренирования на дооперационном этапе должна была заключаться в различии послеоперационных периодов в двух разных группах. Поэтому вторым вопросом нашего исследования было доказать безопасность и эффективность как внешнего, так и внутреннего дренирования.
Показатели интенсивность боли по VAS в раннем послеоперационном периоде оказались практически идентичными и составили в 1-й группе 6,29, во 2-й – 6,05 балла. Частота и объем назначений анальгетиков в раннем послеоперационном периоде также были сопоставимыми. Однако начиная со второго дня, а именно с момента активизации пациентов, показатели интенсивности боли в группах стали различаться (табл. 2). При более тщательном выяснении источника боли 21 (80,7%) пациент боль связывал непосредственно с нефростомой и болью в области нефростомического хода при движении и только 5 (19,3%) человек к источнику боли относили непосредственно прооперированную почку.
Анализ данных по интенсивности боли выявил следующую закономерность. Независимо от способа дренирования в первые двое суток до начала активизации пациентов интенсивность боли была сопоставимой и источником боли являлась непосредственно прооперированная почка. Однако, после того как пациентов активизировали, в группе, где установлена нефростома, боль сохранялась и источником боли служил нефростомический дренаж. В случае использования внутренних дренажей (мочеточникового катетера или катетера-стента) выраженной боли пациенты не испытывали и на 5-е сутки после операции 25 (92,5%) пациентов не отметили значимой боли даже при наличии дренажа.
В связи с этим в 1-й группе прооперированных выписывали из стационара только после удаления нефростомического дренажа, т.е. послеоперационный койко-день напрямую зависел от срока его удаления, который варьировался от 3 до 12 дней. Во 2-й группе в отсутствие клинически значимых отклонений (наличие выраженной боли, гематурии, лихорадки) у 20 (68,9%) пациентов послеоперационный койко-день составил 3–5 дней, у 7 (24,1%) – 6–9 и у 2 (6,29%) человек превысил 10 дней. Мочеточниковые катетеры (в 3 наблюдениях) удалены на 2–3-й день после операции. Катетеры-стенты в 24 наблюдениях удаляли амбулаторно: при этом катетеры-стенты с лигатурой у 12 пациентов удаляли транслюмбально без использования цистоскопии в сроки от 5 до 9 дней, в то время как катетеры-стенты без лигатуры удаляли на 14–16-е сутки с обязательным выполнением цистоскопии.
У 2 пациентов 2-й группы в послеоперационном периоде возникли осложнения, потребовавшие повторного дренирования верхних мочевыводящих путей. В первом случае верхние мочевыводящие пути после операции были дренированы мочеточниковым катетером, который на 2-е сутки в плановом порядке был удален, однако по причине развития обструкции, вызванной миграцией сгустка крови из ЧЛС в мочеточник, развилась атака острого обструктивного пиелонефрита, что потребовало установки катетера-стента с последующим проведением антибактериальной терапии. Во втором случае на 5-е сутки после операции ввиду неадекватного функционирования катетера-стента с целью предотвращения развития атаки обструктивного пиелонефрита произведена замена нефункционирующего катетера-стента на аналогичный.
Обсуждение. Современные методы исследования, такие как мультиспиральная компьютерная томография с контрастированием, а также мультипланарное 3D-моделирование, позволяют на дооперационном этапе получать всю необходимую информацию о размерах, количестве и локализации конкрементов, сосудистой архитектонике почки, взаиморасположении близлежащих органов и почки. Все это позволяет опытному эндоскопическому хирургу на этапе планирования операции предположить ход операции и метод послеоперационного дренирования ЧЛС.
Классическим завершением ЧНЛТ в случае длительности оперативного пособия более 100 мин и при наличии выраженного интраоперационного кровотечения является установка нефростомического дренажа, что и осуществлялось нами. Однако продолжительность операции менее 100 мин, отсутствие выраженного интраоперационного кровотечения, выраженных ретенционных изменений, отсутствие в анамнезе рецидивирующих эпизодов острого пиелонефрита позволяют рекомендовать дренировать ЧЛС внутренними дренажами, будь то мочеточниковый катетер с наружным выведением или катетер-стент. Ведь как показало исследование, в основном в послеоперационном периоде жалобы на боль имели те пациенты, которым был установлен нефростомический дренаж, и боль возникала именно из зоны фиксации нефростомы к коже. Само по себе наличие внешнего дренажа служило дополнительным раздражающим фактором для пациентов, а боязнь его повредить или удалить сковывало их в движениях, что сказывалось на ухудшении качества жизни в послеоперационном периоде и требовало дополнительного назначения анальгетиков. В случае дренирования ЧЛС внутренними дренажами пациенты практически не предъявляли жалоб на боль, обусловленную нахождением дренажа. Кроме того, внутренний дренаж не сковывал их движений и не требовал дополнительного обезболивания. В связи с этим количество койко-дней во 2-й группе не зависело от сроков удаления дренажей. Удаление дренажей выполнялось амбулаторно, а в 12 наблюдениях катетер-стент был удален транслюмбально в условиях перевязочного кабинета и без дополнительных материальных затрат.
Заключение. По результатам нашего исследования выявлено, что процент достоверности прогноза выбора метода дренирования после ЧНЛТ составил 93,2%, что в свою очередь в большой степени вероятности могло спрогнозировать особенности течения послеоперационного периода в группах с различными дренажами и предположить приблизительное количество послеоперационных койко-дней. Безнефростомное завершение ЧНЛТ – безопасный и эффективный метод при корректном дооперационном подборе пациентов и отсутствии интраоперационных осложнений.


