Введение. Мочекаменная болезнь является одним из наиболее распространенных урологических заболеваний и встречается не менее чем у 3% населения России [1]. Многие авторы указывают на наличие корреляции между риском развития мочекаменной болезни и метаболическим синдромом, а также высокую социальную значимость этих заболеваний из-за широкой распространенности [2–4]. Среди заболеваний, отягощающих течение калькулезного пиелонефрита, важное место занимает сахарный диабет (СД), который ассоциируется со снижением иммунного ответа, ухудшением почечной гемодинамики, полинейропатией [5–8].
Существуют значительные отличия в чувствительности/резистентности уропатогенов к антимикробным препаратам в зависимости от фоновых заболеваний, а также от региона одной страны [6, 9–11]. В связи с этим актуальным остается изучение региональных особенностей чувствительности/резистентности уропатогенов, выделенных от больных гнойно-воспалительными заболеваниями почек в сочетании с СД 2 типа (СД2) с целью разработки оптимальной антибактериальной терапии.
Материалы и методы. На базе урологического отделения стационара НУЗ ОКБ на ст. Волгоград-1 ОАО РЖД было выполнено фармакоэпидемиологическое ретроспективное исследование, объектом которого служила первичная медицинская документация (медицинские карты стационарных больных) за 2009 и 2013 гг.
Были изучены истории болезни 179 пациентов с калькулезным пиелонефритом, оперированных в 2009 г. (88 [49,1%]) человек [1-я группа]) и в 2013 г. (91 [50,9%]) человек [2-я группа]).
Проанализированы истории болезни пациентов мужского и женского пола в возрасте старше 18 лет с установленным диагнозом «калькулезный пиелонефрит» и результатами бактериологического исследования мочи c определением микрофлоры и ее чувствительности к антибиотикам. Пациенты поступали в плановом или экстренном порядке.
В зависимости от вида калькулезного пиелонефрита и выбранной тактики лечения сбор мочи на клинический и бактериологический анализ производился либо естественным путем в отсутствие необходимости дренирования мочевых путей или после дренирования их катетером-стентом, либо по дренирующему мочеточниковому катетеру/нефростоме в случае проведенного дренирования верхних мочевых путей. Сбор мочи на анализ осуществляли сразу при поступлении или после дренирования мочевых путей, до начала антибактериальной терапии.
Критерии исключения: сопутствующие онкологические заболевания; туберкулез (легочная и вне- легочная формы); наличие у пациентов постоянного уретрального катетера на момент госпитализации; беременность и кормление грудью; наличие у пациента другого заболевания, требующего назначения системной антибактериальной терапии; острая или хроническая почечная недостаточность; ВИЧ-инфекция.
Определение чувствительности выделенных штаммов микроорганизмов к антибактериальным препаратам проводили диско-диффузионным методом на агаре Мюллер–Хинтона в соответствии с рекомендациями МУК от 1994 г. Контроль качества определения чувствительности осуществляли параллельно с тестированием исследуемых возбудителей с использованием штаммов E. coli ATCC 25922, S. aureus ATCC 25923, P. aeruginosa ATCC 27853, Streptococcuspneumoniae ATCC 49619, E. coli ATCC 35218.
Статистическую обработку данных выполняли с использованием электронных таблиц Exсel и программы STATISTICA 6.0. Достоверность различий между количественными показателями оценивали с помощью критерия Манна–Уитни. Различия считали значимыми при p<0,05.
Результаты и обсуждение. Среди больных были 99 (55,4%) женщин и 80 (44,6%) мужчин. Причем в 1-й группе было больше женщин – 56 (31,2%) и 43 (24,2%) соответственно, во 2-й, напротив, – мужчин: 48 (26,8%) и 32 (17,8%) соответственно.
Большинство больных женского пола были в возрасте от 41 года до 50 лет – 26 (14,5%) человек, мужчин в этой возрастной категории было 21 (11,7%) .
Наибольшее количество больных мужского пола были в возрасте от 51 года до 60 лет – 25 (13,9%) пациентов, женщин в этом возрасте было 19 (10,7%). Меньше всего пациентов и мужского, и женского пола было в возрасте от 18 до 20 лет – 1 (0,5%) и 3 (1,7%) человека соответственно.
У 71 (80,6%) пациента 1-й группы и у 87 (95,6%) – 2-й наблюдался лейкоцитоз (р>0,05), у 66 (75%) и 82 (91,1%) соответственно – повышение СОЭ. Наличие лейкоцитоза и увеличение СОЭ у подавляющего большинства пациентов свидетельствовали о воспалительной реакции организма.
Рост микрофлоры в 1-й группе выявлен у 52 (59%) больных, из них у 34 (38,6%) – в титре 105 КОЕ/мл, у 13 (14,7%) – в титре 106 КОЕ/мл, у 5 (5,6%) – в титре 107 КОЕ/мл; во 2-й группе – у 63 (69%) пациентов, из них у 36 (39,5%) – в титре 105 КОЕ/мл, у 19 (20,8%) – в титре 106 КОЕ/мл, у 8 (8,7%) – в титре 107 КОЕ/мл.
Как видно из представленных данных, в обеих группах возбудители чаще выделялись в титре 105 КОЕ/мл. Кроме того, в 2013 г. отмечено увеличение доли пациентов с титром 106 КОЕ/мл на 6,1% и с титром 107 КОЕ/мл на 3,1% (p<0,005). Это явление можно объяснить повышением вирулентности возбудителей, что в последующем может способствовать появлению резистентных форм.
Для оценки тяжести течения сахарного диабета использована общепринятая классификация, согласно которой СД подразделяется на легкую, среднюю и тяжелую формы [5]. В нашем исследовании у большей части пациентов с калькулезным пиелонефритом был СД2 легкой степени тяжести (49,1%), средней – 36,7%, тяжелой степени тяжести – 14,2%.
 Всего пациентов с калькулезным пиелонефритом, осложненным СД2, было 49 (27,3%) человек, из них 22 (12,2%) – 1-й группы, 27 (15,1%) – 2-й.
Всего пациентов с калькулезным пиелонефритом, осложненным СД2, было 49 (27,3%) человек, из них 22 (12,2%) – 1-й группы, 27 (15,1%) – 2-й.
Анализ структуры возбудителей инфекции у пациентов с калькулезным пиелонефритом, не страдавших СД2 (66 человек), за 2009 г. показал, что наиболее часто выделялась E. coli – 56 штаммов (63,3%), несколько реже – P. aeruginosa (33 штамма [37,5%]), Enterobactercloacae – 28 (31,8%), Enterococcusfaecalis 26 (29,5%), Proteusmirabilis (2 (25%), K. рneumonia 18 (20,4%) штаммов соответственно.
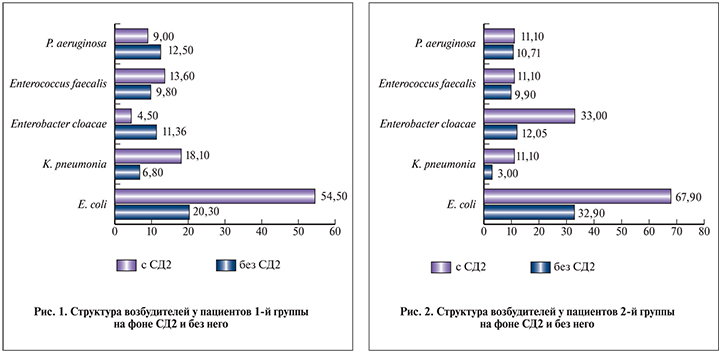
У пациентов 1-й группы, страдавших калькулезным пиелонефритом и СД2, основными выделенными возбудителями также оказались представители семейства Enterobacteriaceae (рис. 1). При этом штаммов E. coli выделено 12 (54,5%), K. pneumoniae – 4 (18,1%). Другими этиологически значимыми микроорганизмами были Enterococcus spp. – 3 (13,6%) штамма, P. aeruginosa – 2 (9%). К группе «другие» (4,5%) мы отнесли возбудителей, выделенных в единственном числе: Erobacter spp., S. aureus и Klebsiellaoxytoca.
Учитывая значительное количественное различие групп больных калькулезным пиелонефритом без СД (n=66 пациентов) и с СД2 (n=22 больных) с целью получения достоверных статистических данных сравнения структуры возбудителей пиелонефрита, мы выбрали случайным образом (рандомно) одинаковое количество пациентов первой группы наблюдения с мочекаменной болезнью и пиелонефритом, без СД (n=22 больных) и с СД2 (n=22 больных) (рис. 1).
Анализ структуры возбудителей инфекции у пациентов 2-й группы, не страдавших СД2, показал (n=64 пациента), что основным возбудителем являлась E. coli – 72 (79,1%) штамма. Другими этиологически значимыми микроорганизмами были P. aeruginosa – 27 (24,1%) штаммов, Enterobactercloacae – 26 (28,5%), K. pneumoniae – 24 (26,3%), Enterococcusfaecalis, Proteusmirabilis – по 22 (24,1%).
У пациентов 2-й группы с калькулезным пиелонефритом на фоне СД2 (n=27 больных) основными возбудителями также оказались представители семейства Enterobacteriaceae (рис. 2), из них штаммы E. coli составили 17 (62,9%), K. pneumoniae – 3 (11,1%) штамма. Другими этиологически значимыми микроорганизмами были Enterococcus spp., P. аeruginosa – по 3 (11,1%) штамма. К группе «другие» (3,7%) мы отнесли возбудителей, выделенных в единственном числе: Erobacter spp., S. aureus и Klebsiellaoxytoca.
Учитывая значительное количественное различие групп больных калькулезным пиелонефритом, без СД (n=64пациента) и с СД2 (n=27 больных) с целью получения достоверных статистических данных сравнения структуры возбудителей пиелонефрита, мы выбрали случайным образом (рандомно) одинаковое количество пациентов второй группы наблюдения с мочекаменной болезнью и пиелонефритом, без СД (n=27 больных) и с СД2 (n=27 больных) (рис. 2).
Глюкозурия благоприятствует более частому развитию мочевой инфекции, поскольку служит питательной средой для размножения бактерий [2, 5].
Хроническая гипергликемия способствует повышению частоты тяжести микро- и макроангиопатий, а также диабетической нейропатии [7]. Следует особо отметить, что наличие нейропатии повышает риск развития мочевой инфекции, поскольку при этом нарушается эвакуация мочи, что приводит к ее застою и инфицированию [8, 9]. Наконец, в условиях хронической гипергликемии появляются изменения в иммунной системе [12].
Наиболее важными представляются три фактора:
- снижение продукции и активности ключевых факторов иммунной защиты;
- нейрогуморальные «поломки» делают организм малочувствительным к изменениям, связанным с начинающейся инфекцией, а симптомы воспаления становятся заметными уже при выраженном инфекционно-воспалительном процессе;
- осложнения диабета, включая микро- и макроангиопатии, которые препятствуют не только нормальному функционированию иммунной системы, но и биодоступности антибактериальных препаратов [8, 10, 12].
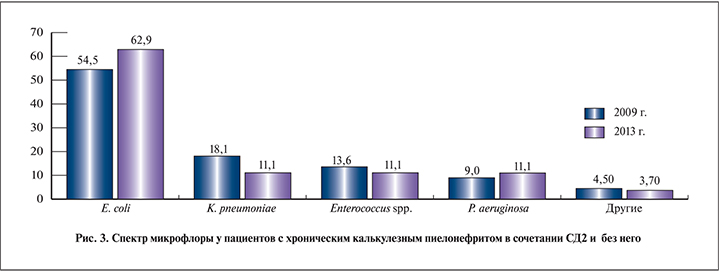
При анализе обеих групп пациентов по признаку спектра микрофлоры у пациентов с хроническим калькулезным пиелонефритом в сочетании с СД2 и без него (рис. 3) мы выявили, что на фоне СД частота выявления инфекции в динамике растет. Так, например, количество пиелонефритов, вызванных E. coli, зарегистрированных в 2009 г. на фоне СД2, составило 54,5%, в 2013 г. – 62,9% соответственно.
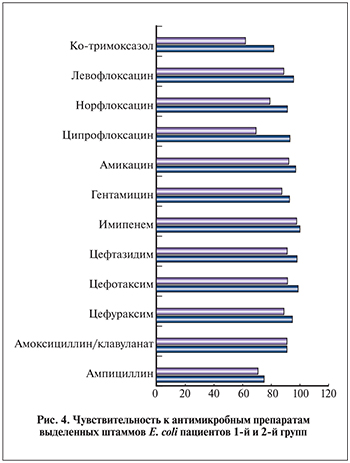
Сравнив чувствительность к антимикробным препаратам выделенных штаммов E. coli у пациентов первой и второй групп за 2009 и 2013 гг. соответственно (рис. 4), мы выявили общую тенденцию снижения чувствительности E. coli к практически всем антимикробным препаратам. Наиболее достоверно выраженно снизилась чувствительнось E. coli к фторхинолонам: к норфлоксацину – на 12,9% (p<0,05), к ципрофлоксацину – на 23,5% (p<0,01). Было отмечено неуклонное динамическое снижение E. coli к аминогликозидам: к гентамицину – на 5,6%; к ампициллину – почти на 3,9%, к цефалоспоринам третьего поколения – на 7,4%; к левофлоксацину – на 4,8%.
Однако, несмотря на растущую резистентность E. coli к антибиотикам, сохраняется высокая чувствительность к амоксициклину/клавуланату (90,9%), к цефотаксиму – 91,4%, цефтазидиму – 91,1%, амикацину – 92,3%, к имипенему – 97,7%, что позволяет использовать эти препараты для эмпирической антибактериальной терапии.
У пациентов с хроническим калькулезным пиелонефритом на фоне СД2 сохраняется высокая чувствительность основных возбудителей инфекции к цефалоспоринам III и IV поколений (92%), к защищенным β-лактамным пенициллинам (амоксициллин/клавуланат) – 86,4%, к производным карбапенемов – 89,4%.
Таким образом, для терапии инфекции верхних мочевыводящих путей пациентам с СД могут быть рекомендованы защищенные β-лактамные пенициллины, цефалоспорины III и IV поколений, производные карбапенемов.
Заключение. Проведенный сравнительный анализ показал, что ведущим возбудителем инфекции верхних мочевыводящих путей и причиной гнойно-воспалительных заболеваний почек более чем в две трети клинических случаев является E. coli. Несмотря на активную позицию врачей в лечении данных нозологий, назначение антибактериальных препаратов не влияет на вирулентность возбудителя. Например, прирост выявления E. coli к 2013 г. составил 15,8%, прирост Klebsiella pneumoniae – 5,9% (p<0,05).
При сравнении титров возбудителей калькулезного пиелонефрита у пациентов первой и второй групп мы выявили, что наибольшую часть в обеих группах составляют бактерии, выявленные в титре 105 КОЕ. Более того, в 2013 г. мы зафиксировали увеличение количества пациентов с титром 106 КОЕ до 25%, и до 20% – с титром 107 КОЕ соответственно. Это явление также можно объяснить повышением вирулентности возбудителей, что в последующем может приводить к появлению резистентных форм. В связи с постоянным изменением уровня резистентности бактерий необходим регулярный пересмотр рекомендаций по антимикробной терапии инфекций мочевыводящих путей.
При анализе спектра микрофлоры обеих групп пациентов с хроническим калькулезным пиелонефритом в сочетании с СД2 и без него мы выявили, что на фоне СД частота выявления инфекции в динамике растет. Так, например, количество больных пиелонефритом, вызванным E. coli, зарегистрированных в 2009 г. на фоне СД2, составило 54,5%, в 2013 г. – 62,9% соответственно. На втором месте по частоте встречаемости в 2009 г. была обнаружена K. pneumoniae (18,1%), в 2013 г. мы отметили снижение до 11% случаев, на долю P. aeruginosa приходилось в 2009 г. 9%, в 2013 г. – 11%. Другим значимым возбудителем являлся Enteroccocus spp.: в 2009 г. – 13,6 и 11,10% – в 2013 г. (p<0,05).
Сохраняется высокая чувствительность основных возбудителей инфекции к цефалоспоринам III и IV поколений (92%), к защищенным β-лактамным пенициллинам (амоксициллин/клавуланат) – 86,4%, к производным карбапенемов – 89,4%, что позволяет рекомендовать эти группы препаратов для эмпирической антибактериальной терапии больных пиелонефритом после коррекции осложняющего фактора.


