Рак предстательной железы (РПЖ) является наиболее частой солидной злокачественной опухолью и второй по частоте причиной онкологической смертности среди мужчин, живущих в развитых странах [1]. В результате широкого распространения скрининга уровня простатспецифического антигена (ПСА) и снижения пороговых значений ПСА, являющихся показанием к биопсии простаты, уменьшилось число мужчин, у которых заболевание впервые диагностировалось на поздней стадии и снизилась раковоспецифическая смертность. Широкое внедрение ПСА-скрининга стало причиной значительного увеличения частоты выявления опухолей низкого онкологического риска и числа мужчин, которым по поводу РПЖ низкого риска прогрессирования выполнялась радикальная простатэктомия (РПЭ) или лучевая терапия (ЛТ) [2]. Оосложнения, развивавшися после использования данных методов в отношении пациентов с опухолью низкого риска прогрессирования на ранней стадии, перевешивали их терапевтическую пользу [3, 4]. Альтернативным вариантом ведения пациентов с опухолями низкого риска является активное наблюдение, но при длительных сроках наблюдения потенциально может снижаться выживаемость [5]. В связи с невозможностью достоверной стратификации пациентов в группы риска на момент первичной диагностики заболевания от 14 до 41% пациентов группы активного наблюдения впоследствии подвергаются РПЭ или ЛТ вследствие повышения степени градации опухоли или клинической стадии [6].
Фокальная терапия РПЖ является новой методикой лечения, при которой происходит разрушение заранее предопределенной (таргетной) зоны простаты, в которой находится клинически значимая злокачественная опухоль [7].
В аспекте фокальной терапии были исследованы различные потенциальные источники энергии, включая криотерапию [8], высокоинтенсивный сфокусированный ультразвук (ВИФУ) [9], фотодинамическую терапию [10] и лазерную термокоагуляцию [11], в последнее время также изучаются возможности электровапоризации [7]. Все перечисленные методы ассоциированы со значительным снижением риска осложнений по сравнению с классическим лечением – радикальной простатэктомией или лучевой терапией, однако лазерная термокоагуляция все же имеет ряд преимуществ: может производиться под контролем МРТ в режиме реального времени, вызывает гомогенный некроз ткани, имеет относительно низкую стоимость и широкую доступность [12]. Фокальное разрушение под контролем МРТ позволяет осуществлять интраоперационный мониторинг посредством МР-термометрии и визуализации таргетной зоны в режиме реального времени [13, 14]. В данном обзоре рассматриваются принципы лазерной термокоагуляции, результаты опубликованных клинических исследований, критерии отбора кандидатов для фокальной терапии РПЖ и обсуждение перспектив развития фокальной лазерной термокоагуляции (ФЛТ) в аспекте лечения локализованного РПЖ.
Принципы ФЛТ
Лазерная термокоагуляция (фототермальная терапия, лазерная интерстициальная терапия, лазерная интерстициальная фотокоагуляция, лазерная абляция) представляет собой процесс разрушения целевого участка ткани с применением сфокусированного пучка электромагнитного излучения, испускаемого лазером [7]. Результатом быстрого повышения температуры в ткани целевого очага становится денатурация белков, что приводит к разрушению тканей in vivo. Ткань простаты хорошо подходит для ФЛТ благодаря ее свойствам: оптическому поглощению, отсутствию чрезмерно развитого сосудистого русла, доступности для пункции и введения лазерного волокна, что позволяет производить хорошо контролируемую термокоагуляцию [15]. Эффективная ФЛТ для лечения РПЖ требует: 1) точной доставки лазерной энергии в целевую ткань; 2) достаточного теплового эффекта для надежного разрушения очага воздействия; 3) минимального теплового повреждения окружающих тканей и нервно-сосудистых пучков.
J. Cepek и соавт. [16] изучили погрешность размещения лазерного волокна при проведении ФЛТ и влияние этой погрешности на достижение необходимого объема разрушения ткани. В исследовании была использована упрощенная модель РПЖ. По результатам проведенной работы авторы пришли к выводу, что целевой очаг, длина которого по крайней мере на 5 мм меньше диаметра участка разрушения ткани, может быть полностью разрушен при использовании максимум 4 лазерных волокон, если погрешность их размещения не будет превышать 3 мм. Однако в данном исследовании не учитывалось местоположение целевого очага относительно остальной части предстательной железы, уретры и прямой кишки, поэтому применять эти результаты при проведении фототермальной терапии в клинической практике нельзя [16].
В проведении ФЛТ большое значение имеет МРТ, которая позволяет определять локализацию подозрительного очага, в режиме реального времени обеспечивать интраоперационный контроль благодаря MР-термометрии, а также вести послеоперационное наблюдение за пациентами, перенесшими ФЛТ [17–22]. На каждом этапе проведения ФЛТ встречаются определенные технические сложности, но достижения в области разработок методик получения и анализа изображений, моделирования передачи биотепла и доставки лазерной энергии на сегодняшний день делают ФЛТ РПЖ технически выполнимой.
Точное разрушение целевой ткани достигается путем введения лазерного волокна в патологический очаг через промежность или прямую кишку [11].
Используя 3D-МРТ-реконструкции в режиме реального времени, R. Stafford и соавт. [13] на семи моделях предстательных желез у собак показали, что лазерные аппликаторы позиционируются в пределах 1,1±0,7 мм от целевой зоны. Технически возможно правильно локализовать лазерное волокно в целевые очаги в мягких тканях, а МРТ в режиме реального времени в процессе разрушающего воздействия дает возможность точно оценивать степень некроза тканей [23]. Разрушение ткани опосредуется термической конверсией сфокусированной электромагнитной энергии, которая повышает температуру ткани, вызывая коагуляционный некроз [24]. Так как эффект от нагревания ткани зависит как от количества теплоты, так и от глубины проникновения, степень разрушения зависит от длины волны лазерного излучения [25]. Лазер, который изначально применялся для термокоагуляции раковой ткани предстательной железы, был инфракрасным Nd:YAG, испускающим излучение с длиной волны 1064 нм. Возможности его применения при ФЛТ ткани предстательной железы изучали отечественные урологи, проведя исследование на беспородных собаках массой до 20 мкг [26]. Воздействие осуществлялось контактно, дистальным торцом кварцевого волоконно-оптического катетера с диаметром сердцевины 600 мк при мощности 20 Вт и длительности 10 с. Макро- и микроскопическому анализу ткани подвергались непосредственно после воздействия, на 3-и, 7-е и 14-е сутки после вмешательства. В 2012 г. О. В. Теодорович и соавт. [27] повторили данный эксперимент с последующим применением Nd:YAG-лазера при ФЛТ 30 больными РПЖ. В результате этих исследований был выявлен ряд положительных характеристик применения инфракрасного лазера: 1) относительно небольшая величина транзиторной зоны, что позволяет надеяться на хорошую «управляемость» направления развития патологического процесса при использовании лазерного излучения в качестве «скальпеля»; 2) относительно небольшая величина зоны демаркационного воспаления, что свидетельствует о низкой активации процесса формирования соединительнотканного рубца; 3) ровный контур зоны повреждения в апикальной части [28]. Однако, несмотря на то что неодимовый лазер часто использовался для фокальной лазерной термокоагуляции, маленькие (1064 нм) диодные лазеры набирают популярность благодаря их портативности, мощности и экономической эффективности [29]. М. Marqa [30] подтвердил данный факт в исследовании, в котором 10 крысам была произведена подкожная инъекция опухолевых клеток, а затем выполнена ФЛТ с помощью диодного лазера (5 Вт, 980 нм). После процедуры были сделаны МРТ-снимки и проведено гистологическое исследование, которые продемонстрировали отсутствие опухоли в зоне термокоагуляции.
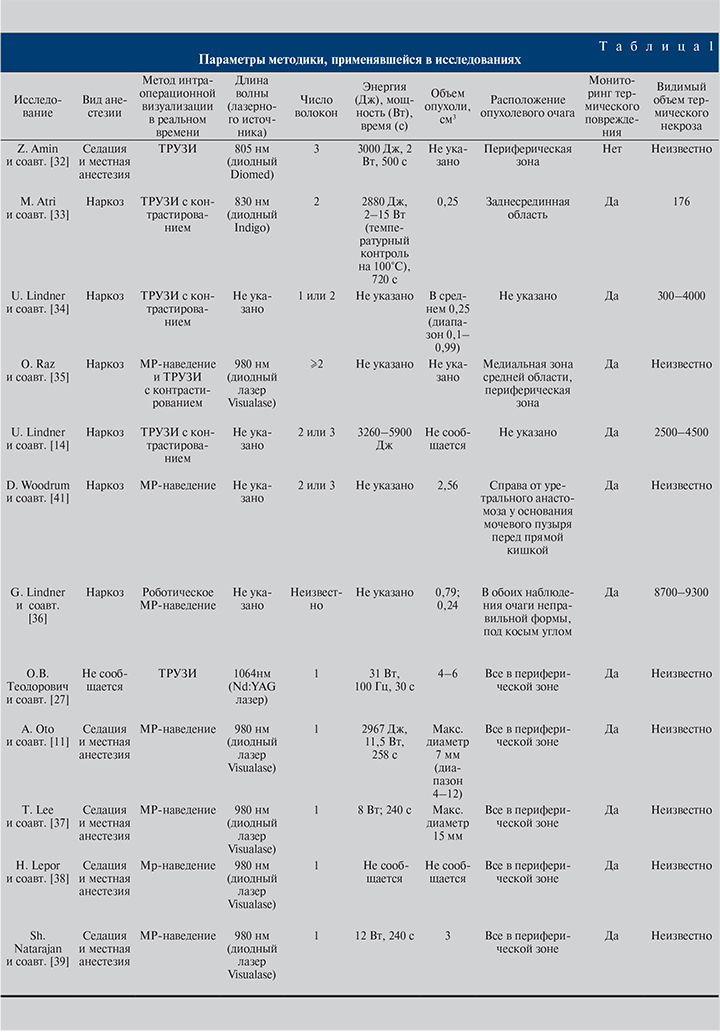
S. Van Nimwegen и соавт. [24] описали гистологические изменения, происходящие в ткани простаты собак ex vivo, в виде функции времени облучения, интенсивности и последующего изменения температуры. Согласно этим данным, температуры, превышающие физиологические (более 42°С), приводят к разрушению ткани при более длительном времени нагревания. Пространственно-временной мониторинг температуры ткани во время приложения лазерной энергии подтвердил линейное увеличение температуры при увеличении продолжительности времени воздействия и интенсивности излучения, так же как и экспоненциальное снижение температуры ткани в зависимости от глубины. Эти взаимоотношения между энергией лазера, температурой ткани и степенью ее «выживания» крайне важны в дозиметрическом планировании термокоагуляции ткани [24].
Минимальное термическое повреждение окружающих тканей и нервно-сосудистых структур достигается посредством мониторинга в режиме реального времени в процессе разрушения ткани. Это может быть достигнуто путем MР-термометрии с исследованием сдвигов частоты протонного резонанса (ЧПР), фиксируемых в GRE-изображениях, для оценки относительного изменения температуры [31].
R. Peters и соавт. [23] показали, что данные МР-термометрии с учетом сдвига ЧПР коррелируют с результатами измерения температуры в гистологически доказанных очагах некроза на моделях предстательных желез собак in vivo.
Кроме того, R. Stafford и соавт. [13] продемонстрировали очень сильную корреляцию (R2=0,94) между реальным повреждением ткани, визуализирующимся при МР-термометрии, и интегралом повреждения Arrhenius. МР-термометрия в реальном времени представляется важным инструментом для оптимизации разрушения целевых очагов с минимальным термическим повреждением окружающей ткани и важных анатомо-физиологических структур.
Концепция ФЛТ основывается на предположении, согласно которому клинически значимый очаг РПЖ можно визуализировать и локализовывать до предполагаемого вмешательства.
Все опубликованные к настоящему моменту исследования по ФЛТ рака простаты представляют собой небольшие по объему нерандомизированные исследования, описывающие только краткосрочные онкологические результаты применения метода (табл. 1, 2).
В 1993 г. Z. Amin и соавт. [32] описали первый опыт лазерной термокоагуляции РПЖ. Для достижения локального контроля после неудачи дистанционной лучевой терапии понадобилось две попытки ФЛТ. Область, подвергнутая лазерной термокоагуляции, на послеоперационной компьютерной томограмме была бессосудистой и не накапливала контрастный препарат, биопсия из данной области показала наличие только некротических масс. Во время вмешательства не наблюдалось клинически значимых осложнений.
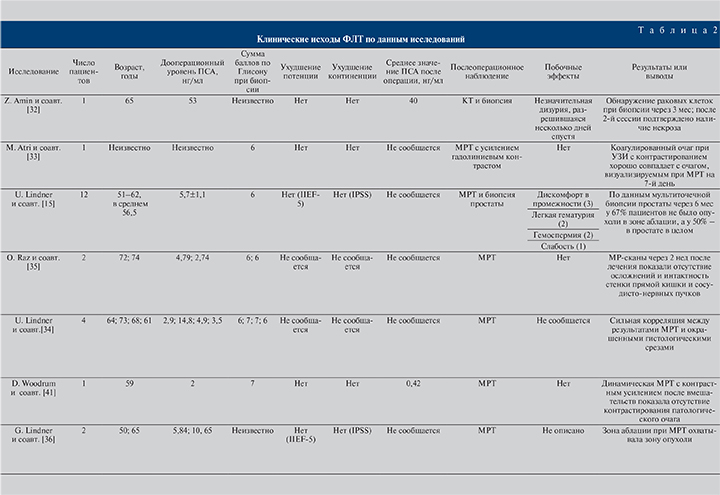
В работе [33] представлен первый опыт применения ФЛТ под контролем ультразвука с контрастным усилением (УКУ), с одновременным термометрическим мониторингом. Очаг, подвергшийся коагуляции, измерили с помощью интраоперационного УКУ, он соответствовал очагу, выявленному на МРТ с применением гадолиниевого контрастного вещества через 7 дней после вмешательства. Это позволило предположить, что интраоперационный УКУ позволяет количественно оценивать эффект лечения.
U. Lindner и соавт. [34] представили результаты первого исследования I фазы (NCT00448695), в котором оценивали выполнимость и безопасность ФЛТ с использованием УКУ. Критерии включения в протокол были следующими: РПЖ низкого риска (T1c или T2a, уровень ПСА<10 нг/мл; индекс Глисона≤6 обнаружение опухолевых клеток только в 1 из 12 столбиков с ≤30%-ным объемом поражения после биопсии под контролем ТРУЗИ); совпадение канцерположительного столбика ткани по карте биопсии с патологическим очагом на мпМРТ (мультипараметрическая МРТ). Фокальную термокоагуляцию РПЖ выполняли под наркозом в литотомическом положении. Трехмерную УЗ-картину высокого разрешения, на которую проецировался планируемый объем разрушения, определяемый при мпМРТ, получали с применением автоматической компьютерной системы. Лазерные волокна вводили в предопределенную зону термокоагуляции, используя модифицированную решетку для брахитерапии и специальное программное обеспечение для планирования лечения. Фототермальную энергию доставляли к ткани с помощью лазера Indigo® Optima («EthiconEndo-Surgery», Cincinnati, OH). Интрапростатическая температура во время вмешательства в зоне лечения вплоть до ее краев превышала 55°C, что контролировалось флюорооптической термометрией. Дополнительные термометрические зонды для замера температуры размещали около важных структур, чтобы не допустить повышения температуры в этих зонах более 42°C. Фототермический эффект мониторировали при помощи УКУ. После ФЛТ, проведенной 12 мужчинам, 2 пациента предъявили жалобы на дискомфорт в промежности, у 2 имела место незначительная гематурия, у 2 – гемоспермия, и 1 жаловался на слабость. Средний объем зоны, подвергаемой разрушению по данным послеоперационной МРТ, составил 2,2 см3. Повторные 10-точечные биопсии под контролем ТРУЗИ с дополнительными двумя вколами в область термокоагуляции производили через 3 и 6 мес. По данным мультиточечных биопсий простаты, через 6 мес у 67% обследованных в зоне лечения не было опухолевого роста, а у 50% его не наблюдалось во всех биоптатах. У двух пациентов появилась опухоль на стороне, противоположной области фокального воздействия. У 2 из 4 пациентов с резидуальной опухолью в целевой зоне наблюдался минимальный опухолевый рост, в то время как у 2 других имелось поражение опухолью градации 6 по Глисону объемом менее 50%. По данным валидизированных опросников после лечения отрицательной динамики мочеиспускания и сексуальной функции отмечено не было [34].
Та же группа исследователей показала, что при ФЛТ происходит полное уничтожение всех жизнеспособных клеток в подвергаемой лечению зоне. Это было подтверждено данными гистологического исследования цельноорганных срезов 4 пациентов, которым после ФЛТ выполнялась РПЭ. Проведение МРТ после лазерной термокоагуляции является эффективным методом оценки объема разрушенной ткани, так как полученные результаты хорошо соотносятся с таковыми гистологического исследования (r=0,89).
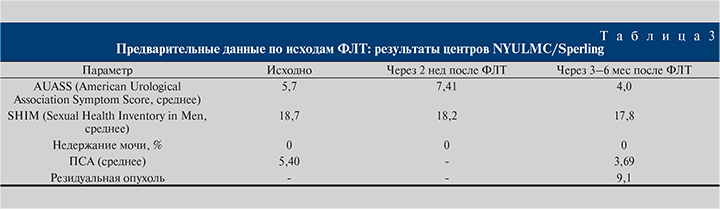
В 2010 г. O. Raz и соавт. [35] описали свой первый опыт ФЛТ под контролем МРТ в режиме реального времени. Преимущества МРТ-контроля многочисленны: улучшение визуализации целевой зоны, наведение лазерного волокна и мониторинг в режиме реального времени; контроль зоны термокоагуляции и окружающей ткани; немедленное подтверждение объема ткани, подвергшейся разрушению.
В данном случае МРТ с контрастным усилением непосредственно после лазерной термокоагуляции позволяла подтвердить отсутствие кровотока в таргетной зоне.
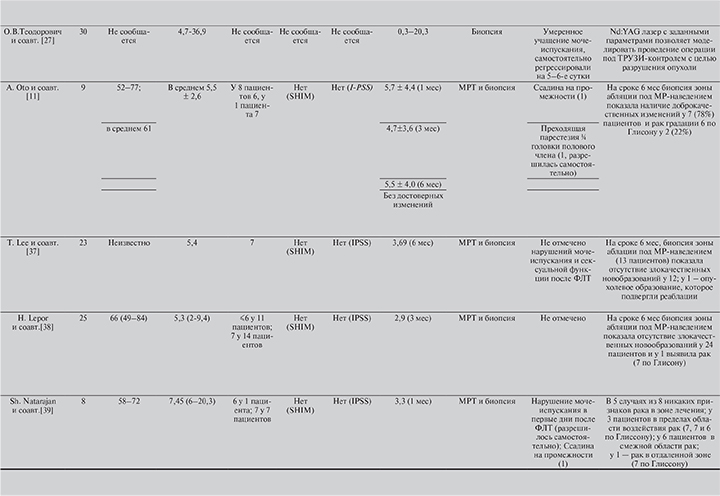
Первое наблюдение роботассистированной ФЛТ под МР-наведением было описано U. Lindner и соавт. в 2011 г. Роботизированный интродьюсер лазерного волокна обеспечивал условия как для точного чреспромежностного размещения, так и для косых поворотов используемых волокон, что позволило сократить продолжительность процедуры и увеличить точность нацеливания на патологический очаг. Усиленные гадолиниевым контрастом МР-сканы после лечения выявили зону разрушения, охватывающую опухоль в двух наблюдениях [36]. A. Oto и соавт. опубликовали результаты исследования I фазы (NCT01192438), в котором изучались техническая выполнимость и безопасность ФЛТ под МР-контролем. Критерии отбора: РПЖ низкого риска (клиническая стадия Т1с–Т2а, уровень ПСА<10 нг/мл, сумма Глисона ≤7); не более 3 канцерположительных образцов при выполнении стандартной 12-точечной биопсии; отсутствие образца с объемом опухолевого поражения более 50%; подозрительный очаг, визуализируемый на МРТ, соответствующий обнаруженному раку по данным биопсии. Для проведения процедуры осуществляли седацию без выключения сознания, после чего пациента укладывали в положение на спине в капсулу 1,5-теслового магнитного томографа. Все МР-изображения получали при совместном использовании сердечной матрицы и эндоректальных катушек. На промежность устанавливали модифицированную решетку для брахитерапии и заполненные раствором хлорида натрия капсулы-ориентиры. Катетер с открытым концом калибра 14 Ch длиной 14 см с МР-совместимым титановым обтуратором устанавливали в целевой очаг через промежность. После подтверждения положения обтуратора по данным Т2-взвешенного сканирования оптическое волокно с рассеивающим кончиком и диодным лазером с длиной волны 980 нм, окруженное охлаждающим катетером 1,65 мм («Visualase, Inc.», Houston, TX), подсоединяли к циркуляционному контуру стерильного раствора хлорида натрия комнатной температуры и вводили в целевой очаг. Температура мониторировалась температурозависимым сдвигом ЧПР по данным фазовочувствительных изображений, получаемых каждые 5 с. Продолжительность всей процедуры варьировалась от 2,5 до 4 ч, а средняя продолжительность лазерной термокоагуляции составляла в среднем 4,3 (1,5–7,5) мин. Через 6 мес область лазерной термокоагуляции подвергали пункционной биопсии. У 7 (78%) пациентов была выявлена доброкачественная гиперплазия простаты, у 2 (22%) – РПЖ (2,5 и 1 мм соответственно) градации 6 по Глисону. При ретроспективном пересмотре картины ФЛТ было обнаружено, что у двух пациентов с резидуальным раком по данным послеоперационной биопсии область патологического очага была неполностью перекрыта зоной термокоагуляции. Через 6 мес после вмешательства значительной динамики показателей I-PSS и индекса половой функции по сравнению с дооперационными значениями не наблюдалось [11]. Схожие данные были получены в работах [37, 38], в которых были использованы те же критерии подбора пациентов, методика проведения процедуры ФЛТ и методы исследования. В исследовании [37] ФЛТ была проведена 23 мужчинам; спустя год только 13 из них были подвергнуты биопсии. При этом у 12 (92,3%) человек рака в области аблации не определялось, у 1 был выявлен опухолевый очаг в целевой зоне градации 7 по Глисону, обнаруженный впервые на мпМРТ через 3 мес после вмешательства; данный пациент был подвергнут повторной ФЛТ. Индекс половой функции и показатели I-PSS, изученные за 2 нед до ФЛТ и спустя 6 мес, не претерпели значительных изменений [37]. В исследовании [38] приняли участие 25 пациентов. Спустя год после вмешательства по результатам биопсии зоны ФЛТ под МРТ-наведением рак отсутствовал у 24 (96%) пациентов, РПЖ градации 7 по Глисону выявлен только у 1 (4%) пациента; уровень ПСА снизился примерно на 40% (с 5,9 до 2,9 нг/мл).
В 2015 г. были опубликованы результаты исследования с применением МРТ-совместимых флюорооптических температурных датчиков [39]. Целью исследования стала оценка безопасности и получение данных об осуществимости метода, а также изучение возможности упрощения ФЛТ путем замены МР-термометрии для осуществления ее в условиях клиники под контролем совмещения МРТ/УЗИ. Критерии отбора: РПЖ низкого риска (клиническая стадия ≤T2b, сумма Глисона ≤7); отсутствие образования с объемом опухолевого поражения более 50%; подозрительный очаг, визуализируемый на МРТ, соответствующий обнаруженному раку по данным биопсии. Процедуру выполняли в условиях седации без выключения сознания. Непосредственно перед ФЛТ трансперитонеально под контролем УЗИ в ткань простаты вводили 2–3 совместимых с МРТ флюорооптических температурных датчика с помощью брахитерапевтических аппликаторов. Не зависимые от МРТ температурные датчики предназначены для оценки изменений температуры внутри простаты. Каждому пациенту был установлен минимум один датчик в периферическую часть простаты возле стенки прямой кишки. Техника выполнения ФЛТ была идентичной таковой, описанной в работе [11]. Во время проведения процедуры температуру в простате измеряли непрерывно. Полная длительность процедуры варьировалась от 2,5 до 4 ч. Информация с флюорооптических температурных датчиков была получена только в 6 из 8 наблюдений в связи с наличием технической погрешности, из-за которой в двух наблюдениях получить информацию с датчиков не удалось. У этих 6 мужчин средние значения температуры были ниже 40°С во всех зонах простаты вне области лечения. У 5 (62,5%) из 8 мужчин уровень ПСА за 6 мес снизился почти вдвое по сравнению с показателем, полученным при первичном скрининге. Ни один пациент не сообщил о возникших у него эпизодах недержания мочи, эректильной дисфункции или изменений эякуляции. В 5 (62,5%) наблюдениях в зоне лечения не было обнаружено никаких признаков рака. У 3 пациентов РПЖ был выявлен в пределах области воздействия (7,5 мм GS3+4, 2,5 мм GS3+4, 1 мм GS6), у 6 пациентов вне зоны лечения, но смежно с ней найдена стабильная опухоль (1,4 мм GS4+4; 5,5 мм GS3+4; 7,5 мм GS3+4; 2,5 мм GS6; 0,5 мм GS6; 8 мм GS6), у 1 пациента при сатурационной биопсии была выявлена опухоль, расположенная отдаленно от зоны действия (градация 7 по Глисону).
Онкологическая эффективность ФЛТ в настоящее время изучается в клинических исследованиях II фазы в Университете Чикаго (NCT01792024), Университете Торонто (NCT01094665), и Национальном институте рака (NCT01377753) [40].
Заключение. В настоящее время нельзя с полной уверенностью предлагать пациентам ФЛТ как метод лечения РПЖ с низким риском, так как, во-первых, проведено недостаточно исследований, во-вторых, отсутствует однозначное мнение касательно критериев отбора кандидатов на проведение данного лечения. Учитывая гетерогенный характер популяции больных РПЖ, недостатки радикальных методов лечения (РПЭ и ЛТ) и активного наблюдения, мы полагаем, что для данного метода есть подходящие пациенты, но они должны быть проинформированы о недостатках вмешательства и наличии ограниченного количества данных по краткосрочным онкологическим результатам лечения и полном отсутствии данных по долгосрочной онкологической эффективности. Выявление маленьких очагов РПЖ, которые не несут клинически значимый злокачественный потенциал, является одной из главных проблем, возникающих вследствие недостаточной специфичности скрининга уровня ПСА и традиционных случайных 12-точечных биопсий. Пациентам с подобным «незначимым» РПЖ следует предлагать активное наблюдение, а не фокальную терапию, а в идеале – не диагностировать такие опухоли, чтобы не выбирать между активным наблюдением, фокальной терапией и др. методами лечения, так как это не влияет на продолжительность жизни пациента и может негативно сказаться на качестве его жизни. Одной из стратегий борьбы с гипердиагностикой опухолей является отказ от традиционной 12-точечной биопсии у пациентов с отсутствием или минимальными изменениями при мпМРТ простаты. Согласно определению ФЛТ, для нее требуется наличие патологического очага на МРТ, который является гистологически верифицированным опухолевым поражением, а также хорошая визуализация целевой зоны, поэтому данный метод исключает возможность лечения пациентов с «микроскопическими» очагами опухоли. Использование мпМРТ до биопсии простаты, программного обеспечения для трехмерного совмещения результатов МРТ/УЗИ и прицельной биопсии всех патологических очагов, визуализируемых на мпМРТ, дает наиболее точные сведения о размере, расположении и потенциальной агрессивности опухоли, что помогает выбрать оптимальный подход к лечению. Если данные первой биопсии после термического лазерного разрушения указывают на наличие остаточной опухоли, технически возможно выполнить повторное фокальное воздействие. Отрицательные результаты мпМРТ и отсутствие очагов рака градации 4 по Глисону занимают важное место в прогнозировании благоприятных результатов после проведенной фокальной терапии. Это дает определенную уверенность в том, что клинически значимые очаги не были «пропущены». Тем не менее пациенты, выбирающие в настоящее время фокальную ФЛТ как метод лечения, должны понимать необходимость активного наблюдения как за зоной воздействия, так и за другими зонами простаты вследствие отсутствия долгосрочных онкологических результатов. Оптимальный режим послеоперационного наблюдения после ФЛТ еще предстоит разработать; он, в частности, будет определяться краткосрочными и среднесрочными онкологическими исходами. На основе результатов уже проведенных исследований можно говорить о том, что выполнение ФЛТ не ухудшает качество жизни пациентов. В связи с этим для мужчин с РПЖ низкого или промежуточного риска с единственным МРТ-визуализируемым очагом, злокачественный характер которого верифицирован гистологически, данный метод является целесообразным вариантом лечения, так как он обеспечивает сохранение половой функции. Несмотря на то что полученные на сегодня предварительные данные дают большую надежду, имеется необходимость в дальнейшей разработке метода ФЛТ рака предстательной железы. Кроме того, следует иметь в виду возможность появления новых лазеров с иной длиной волны, применение которых позволит улучшить процедуру ФЛТ. Ввиду сложностей, сопряженных как с отбором кандидатов, так и с проведением самой процедуры, требуется совместная работа радиолога, который имеет необходимые навыки интерпретации данных мпМРТ, и квалифицированного уролога с достаточным опытом, который и будет осуществлять лазерную термокоагуляцию. На основании анализа статистически достоверных результатов проводимых исследований еще предстоит определить критерии отбора кандидатов для ФЛТ РПЖ, оптимальную методику ее выполнения, а также разработать протокол послеоперационного ведения этих пациентов. Необходимо строго обязательно получать подробные и статистически достоверные данные послеоперационного наблюдения для того, чтобы в итоге можно было четко обозначить ряд критериев для подбора кандидатов на данный вид лечения, оптимальную методику, объем лазерной термокоагуляции ткани рака предстательной железы и предоставить протокол послеоперационного обследования на предмет резидуальных и рецидивных опухолей.
Совершенно очевидно, что данное вмешательство имеет технические ограничения, преодолеть которые непросто. Неясно, смогут ли команды урологов и радиологов эффективно использовать общие усилия для того, чтобы предлагать пациентам данный вид лечения. Урологи уже сейчас имеют хорошие навыки выполнения УЗИ простаты, и, вероятно, в скором времени будет освоен навык выполнения корегистрационной 3D-МРТ/УЗИ биопсии в качестве усовершенствованного метода рискориентированной диагностики РПЖ. Дальнейшая разработка пакетов программного обеспечения позволит урологам осуществлять деструкцию патологических участков, выявляемых при МРТ, с использованием 3D МРТ/УЗИ корегистрации под местной анестезией в небольших хирургических центрах или амбулаторно базированных операционных.
HIFU-терапия, криотерапия, фотодинамическая терапия являются методиками, совместимыми с ультразвуком, в то время как ФЛТ рака предстательной железы позволяет использовать корегистрационные платформы 3D МРТ/УЗ-наведения в сочетании с ультразвуковым мониторингом состояния ткани во время вмешательства. Благодаря многим преимуществам лазера как источника разрушающей энергии, вероятно, ФЛТ будет включена в арсенал урологов, которые используют локальные методы лечения РПЖ.



