Введение. Классические генетико-эпидемиологические исследования четко продемонстрировали, что дисфункция тазового дна у женщин является патологией с наследственной предрасположенностью, развитие которой определяется взаимодействием множественных генетических факторов (мутаций и/или полиморфных аллелей) и факторов внешней среды [1, 2]. Сегодня актуальна расшифровка «генной сети», формирующей наследственную предрасположенность к этой патологии. К настоящему времени глобальная база данных генных заболеваний (HuGENavigator) содержит около 30 публикаций по исследованию конкретных генетических факторов, связанных с дисфункцией тазового дна у женщин. Большинство работ было посвящено изучению роли генов, контролирующих синтез и деградацию соединительной ткани: COL1A1, COL3A1, матриксных металлопротеиназ (MMP1, MMP3, MMP9) и ламинина (LAMC1) [3, 4].
Для сохранения органов малого таза в нормальном положении наиболее важен коллаген I и III типов. Функция удержания тазового дна связана преимущественно с коллагеном I типа, придающим прочность связкам из-за длины и толщины волокон и в меньшей степени – с коллагеном типа III, повышенное количество которого связано с уменьшением механической прочности соединительной ткани.
Роль полиморфизма в гене COL3A1 до сих пор остается спорной. Некоторые исследования и мета-анализы обнаружили прямую корреляцию между генетическими дефектами и пролапсом тазовых органов (ПТО), тогда как другие исследователи этого не подтвердили [5]. Так, K. Kluivers и соавт. [6] исследовали полиморфизм в α1-цепи, кодирующей белок коллагена типа III (rs1800255, COL3A1 2209 G>A). Чтобы обнаружить эти полиморфизмы, авторы использовали для анализа ДНК полимеразную цепную реакцию (ПЦР) с последующим анализом полиморфизма длины рестрикционного фрагмента. Это исследование показало, что гомозиготная форма одного из этих полиморфизмов (rs1800255, COL3A1 2209 G>A) ассоциируется с ПТО с отношением шансов 5,0 (95% доверительный интервал – 1,4–17,1) по сравнению с контрольными пациентками.
H. Chen и соавт. [7] показали аналогичные результаты для пациентов с ПТО, также используя ПЦР.
В то же время в работе [8] на большом материале (354 женщины с ПТО) ассоциации данного гомозиготного полиморфизма не выявлено.
Цель настоящего исследования: изучение ассоциации полиморфизма 1800255 гена COL3A1 с развитием ПТО и недержания мочи (НМ) у женщин.
Материалы и методы. В исследовании участвовали 73 женщины, которые находились на лечении в урологических отделениях университетской клиники с сентября 2016 по май 2017 г. Группа исследования включила 52 пациентки с верифицированным ПТО и стрессовым НМ. Возраст пациенток составил 40–70 лет (в среднем 64,4±2 года).
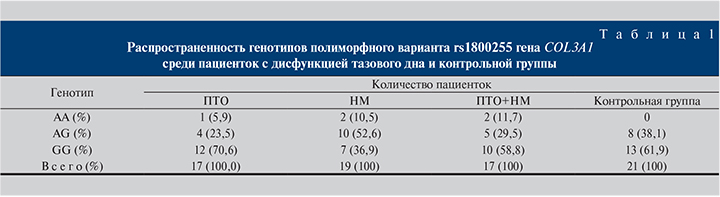
В контрольную группу была отобрана 21 пациентка без дисфункции тазового дна. Пациентки обеих групп соответствовали по возрасту и наличию по крайней мере одного или несколько факторов риска развития дисфункции тазового дна в анамнезе: двое или более родов через естественные родовые пути, травматические роды, роды плодом более 4000 г, чрезмерная физическая активность, заболевания, сопровождающиеся увеличением абдоминального давления (бронхиальная астма, хронический бронхит, хронический запор), наличие операций на органах малого таза.
Критерии исключения из обеих групп: синдромы Марфана и Элерса–Данлоса, а также операции по поводу ПТО или НМ в анамнезе (для контрольной группы).
Университетский комитет по этике одобрил исследование (выписка из протокола № 05–17), и каждая пациентка подписала информированное согласие на участие в исследовании.
У всех женщин были взяты образцы слюны для выявления полиморфизма в локусе rs1800255 гена COL3A1. Этот полиморфизм служит локальной мутацией – замещением гуанина (G) на аденин (А) в последовательности ДНК.
Генотипирование проведено методом секвенирования по Сэнгеру [8] с последующей оценкой чувствительности и специфичности для ПТО и НМ.
Все пациентки собирали слюну в стерильную пластиковую пробирку не ранее чем через час после принятия пищи и питья. Перед сбором слюны пациентки жевали слизистую щеки в течение нескольких секунд, а затем собирали 3–4 мл слюны. Все пробирки были пронумерованы и заморожены до транспортировки в лабораторию.
Для изучения полиморфизма в гене COL3A1 были созданы два праймера – на ~200-350 bp выше по положению и ~200–350 bp ниже необходимого положения для амплификации фрагмента 400–700 bp. Специфичность праймеров подтверждена ПЦР с последующим электрофорезом в агарозном геле.
Последовательность продукта секвенирования ПЦР выполнена на ABI 3730XL (Life Technologies) с одного конца, по одной реакции шаблоном по ABI. Конечными праймерами являлись fTAGTTCCCACCCAGCTGTTC и rACCTTGTCACCCTTTGGACC.
После получения данных о сочетании аллелей для каждой пациентки было произведено вычисление специфичности и чувствительности данного полиморфизма для дисфункций тазового дна. Исходя из этих показателей, была рассчитана площадь под ROC-кривой(AUC).
Результаты. Распределение пациенток в исследуемой и контрольной группе с учетом определенного генотипа представлено в табл. 1.
Как видно из табл. 2, пациентки с гомозиготой (АА) имеют низкую чувствительность и высокую специфичность по отношению к дисфункциям тазового дна. У пациенток с гетерозиготой (AG) чувствительность повышается, специфичность снижается.
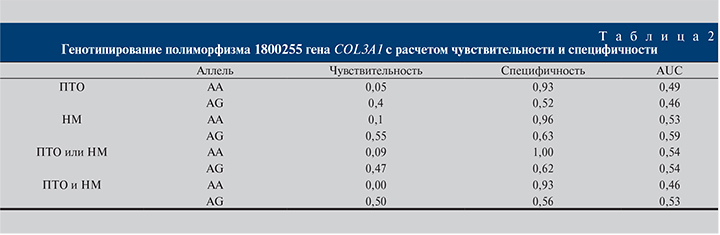
Обсуждение. Настоящее исследование было предпринято с целью выяснения связи ПТО и НМ с полиморфизмом rs1800255 в гене COL3A1 с помощью генотипирования образцов слюны пациенток методом секвенирования по Сэнгеру.
Как было уже показано ранее, развитие ПТО связано с носительством генотипа rs1800255-A/A гена COL3A1, которое увеличивает вероятность его развития в 4,79 раза [9]. По мнению авторов, нуклеотидное замещение 2092G> A (rs1800255) приводит к замещению аланина на треонин (Ala698Thr), что может влиять на прочность коллагеновых волокон.
Мета-анализ [10] не выявил ассоциации полиморфизма rs1800255-A/A COL3A1 с развитием ПТО, но подтвердил корреляцию полиморфного варианта rs1800012 гена COL1A1 с риском развития ПТО.
В обзоре [11], посвященном клиническим исследованиям по наследственным факторам при ПТО, не было выявлено ассоциации полиморфизма COL3A1 и ПТО. H. Chen и соавт. [12] сообщили о наличии ассоциации гомозиготного полиморфизма COL3A1 2209 G>A. В то же время M. Jeon и соавт. [13] обнаружили, что генотип GG этого полиморфизма, а не генотип АА был значимо связан с ПТО. При этом K. Martins и соавт. [14] никакой связи с ПТО не обнаружили.
Наше первоначальное объяснение этих несоответствий состояло в том, что все предыдущие исследования проведены в этнически разных популяциях (корейской, голландской, тайваньской и бразильском) с различными средовыми факторами риска развития ПТО. Эти различия могут также объясняться тем фактом, что методики определения этого полиморфизма не были достаточно точными. Именно секвенирование, использованное в нашем исследовании, является «золотым» стандартом анализа ДНК.
Заключение. Полученные нами статистически значимые данные подтверждают, что носительство генотипа rs1800255-A/A гена COL3A1 ассоциируется с риском развития дисфункции тазового дна у женщин. Небольшое количество включенных пациенток служит основным ограничением данного исследования, что требует дальнейшего изучения на более широкой выборке пациенток.


