Введение. В настоящее время резекция почки – основной метод оперативного лечения больных опухолями почки в стадии Т1 [1–4]. Ранее данная операция по абсолютным показаниям выполнялась при новообразованиях единственной и заболеваниях противоположной почки или при наличии хронической почечной недостаточности. Проведенные исследования показали, что удаление хорошо функционирующей почки с опухолью приводит к развитию почечной недостаточности и увеличивает риск развития сердечно-сосудистых заболеваний [5–8]. В связи с этим органосохраняющие операции стали шире применяться пациентами со здоровой контралатеральной почкой [3]. В пользу резекции при опухолях почки служит и тот факт, что у 20% пациентов новообразования имеют доброкачественную природу [9, 10].
По сравнению с радикальной нефрэктомией после резекции почки наблюдаются хорошие отдаленные функциональные результаты [4, 6–8]. В настоящее время методом выбора при оперативном лечении больных с опухолями почки в стадии Т1 остается лапароскопическая или робот-ассистированная резекция почки. Первоначально лапароскопическая парциальная нефрэктомия (ЛПН) применялась при небольших, экзофитных и поверхностных опухолях. По мере приобретения опыта возможности ЛПН расширялись и к ней стали прибегать при эндофитных или синусных образованиях почки [9–11]. Внедрение новых технологий хирургических приемов и устройств, таких как интракорпоральное завязывание узлов, различные гемостатические средства, новый лапароскопический инструментарий и электрохирургические устройства для гемостаза, в значительной мере облегчило выполнение ЛПН [12–14]. В настоящее время ЛПН становится методом выбора для больных с опухолью почки, которым показано органосохраняющее лечение.
Цель исследования: сравнить результаты лапароскопической и открытой резекции почки.
Материалы и методы. С 2000 по 2016 г. в клинике урологии СЗГМУ им. Мечникова резекция почки по поводу опухоли выполнена 178 больным. Среди них мужчин было 106 (59,5%), женщин – 72 (40,5%). Средний возраст пациентов составил 58,2±12,6 года (36–78 лет). Открытая резекция почки была выполнена 102 (57,3%) (1-я группа), ЛПН – 76 (42,7%; 2-я группа) пациентам. У большинства (92,2%) из них операция проведена по элективным, в 14 (7,8%) – по абсолютным показаниям.

Обследование во всех случаях включило лабораторные исследования, УЗИ и МСКТ органов брюшной полости, которые позволили уточнить размер и локализацию опухоли. 163 (91,6%) пациентам была установлена стадия Т1а, 15 (8,4%) – Т1b. Размеры опухоли в 1-й группе колебались от 2,4 до 6,2 см, во 2-й – от 2 до 5,4 (см. таблицу).
Техника парциальной нефрэктомии (ПН) независимо от доступа заключалась в мобилизации почки и ее сосудов. Далее осуществлено пережатие почечной артерии сосудистым зажимом или турникетом, резекция почки в пределах здоровой паренхимы, отступя от края опухоли до 5 мм. Резекция почки осуществлена ножницами без электрокоагуляции, что позволило хорошо визуализировать ткани в зоне операции. При использовании различных гемостатических устройств в зоне резекции возникают участки некроза, не позволяющие четко определить границы опухоли. После удаления образования накладывали гемостатические швы: при открытом вмешательстве использовны П-образные швы, при лапароскопическом – непрерывный шов нитью V-loc.
 Оценке подлежали следующие параметры: время операции и тепловой ишемии, объем кровопотери, сроки госпитализации, количество осложнений. Осложнения резекции почки нами были разделены на интра- и послеоперационные. Для градации осложнений использована классификация Клавьена. К осложнениям I степени отнесены те, которые были незначительными и требовали консервативного лечения или наблюдения. При осложнениях II степени пациент нуждался в проведении гемотрансфузии и лекарственной терапии. Больным с осложнениями III степени требуется проведение манипуляций без (IIIа) или с (IIIb) общей анестезией. Осложнения IV степени приводили к недостаточности одного или нескольких органов. Послеоперационную смерть больного относили к осложнению V степени по классификации Клавьена.
Оценке подлежали следующие параметры: время операции и тепловой ишемии, объем кровопотери, сроки госпитализации, количество осложнений. Осложнения резекции почки нами были разделены на интра- и послеоперационные. Для градации осложнений использована классификация Клавьена. К осложнениям I степени отнесены те, которые были незначительными и требовали консервативного лечения или наблюдения. При осложнениях II степени пациент нуждался в проведении гемотрансфузии и лекарственной терапии. Больным с осложнениями III степени требуется проведение манипуляций без (IIIа) или с (IIIb) общей анестезией. Осложнения IV степени приводили к недостаточности одного или нескольких органов. Послеоперационную смерть больного относили к осложнению V степени по классификации Клавьена.
Для сравнения результатов резекции почки в обеих группах мы провели статистический анализ демографических, интра- и послеоперационных данных оперированных больных. Статистическую значимость различий в случае параметрического распределения данных оценивали с помощью критерия Стьюдента, непараметрического – Манна–Уитни.
Результаты. Во 2-й группе было 3 случая конверсии. Обе группы оперированных больных были схожими по возрасту и полу, индексу массы тела (см. таблицу). Во всех случаях при ПН использовали тепловую ишемию. При открытом вмешательстве 42 (41,2%) из 102 пациентов сосудистым зажимом пережимали артерию и вену почки, остальным 60 (58,8%) – только артерию. При ЛПН осуществлено пережатие только артерии с помощью резинового турникета. Продолжительность ЛПН была несколько больше, чем при открытой резекции почки, – 125 и 105 мин соответственно (р>0,05). Однако среднее время тепловой ишемии (ВТИ) в группе ЛПН было выше, чем в группе открытой резекции почки (20,8 против 14,5 мин, р<0,05). При ЛПН наблюдался сравнительно меньший объем кровопотери (180 против 365 мл, р<0,05), короткий срок госпитализации (2,5 против 5,6 дня, р<0,05).
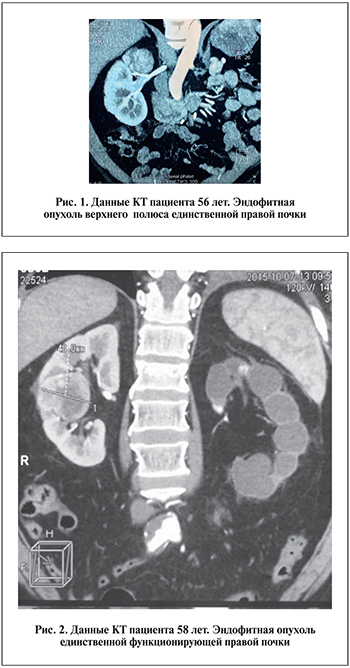
Патоморфологические исследования выявили злокачественные опухоли у 85 (83,3%) пациентов, которым выполнена открытая резекция, и у 62 (81,6%), перенесших ЛПН. Чаще всего диагностировали стадию Т1а – 88,2 и 90,8% случаев в 1-й и 2-й группах соответственно. Опухоли в стадии Т1b выявлены у 7,9% в 1-й группе и 6,6% – во 2-й, Т3, а у 3,9% – в 1-й группе и 2,6% – при ЛПН. Средний размер опухоли в группе открытой резекции почки был больше, чем в группе ЛПН, – 3,6 против 2,8 см (р<0,05). Было выявлено по 1 случаю позитивного хирургического края в каждой группе. Обоим пациентам выполнена открытая операция и повторная резекция в зоне удаленной опухоли. Конверсия при ЛПН потребовалась в 3 (4%) наблюдениях. У одного пациента при выделении расположенной в почечном синусе опухоли диаметром 4,5 см возникло сильное кровотечение, что заставило закончить операцию из открытого доступа. У другого больного при гистологическом исследовании был выявлен положительный хирургический край, поэтому открытым доступом зона резекции была расширена. Третьему пациенту ЛПН выполнена по поводу опухоли верхнего полюса единственной правой почки (рис. 1). При ее мобилизации была повреждена почечная вена, что потребовало конверсии.
 Общее количество интраоперационных осложнений в группах было сопоставимым: 4 (3,9%) при открытой резекции почки и 5 (6,6%) при ЛПН.
Общее количество интраоперационных осложнений в группах было сопоставимым: 4 (3,9%) при открытой резекции почки и 5 (6,6%) при ЛПН.
В каждой из групп у 3 пациентов было кровотечение, потребовавшее гемотрансфузии. При ЛПН имели место два случая конверсии в открытое вмешательство. У одного больного при открытой резекции был травмирован мочеточник, установлен стент. При ЛПН у двух пациентов возникла распространенная подкожная эмфизема. Частота послеоперационных осложнений была выше при открытой, чем при лапароскопическо, резекции почки (28,3 против 19,7%, р<0,05). Число осложнений I cтепени было схожим в обеих группах (11,7 и 9,2%), осложнения II степени в основном наблюдались при открытом доступе (16,6 и 10,5%). Из них наиболее частым было переливание крови, к которому при открытой резекции прибегали чаше, чем при ЛПН (12,7 против 6,5%). Ни в той, ни в другой группе случаев послеоперационного кровотечения, потребовавшего срочного хирургического вмешательства и выполнения нефрэктомии, не было. Послеоперационное подтекание мочи имело место у 4 (3,9%) пациентов 1-й группы и у 3 (4%) – 2-й. Пятерым прооперированным был установлен мочеточниковый стент, двум выполнена пункционная нефростомия.
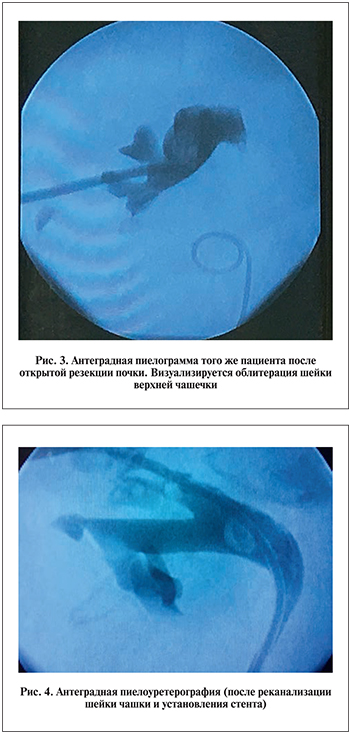
У одного пациента, перенесшего открытую резекцию эндофитной опухоли единственной правой почки (рис. 2), подтекание мочи, несмотря на стентирование мочеточника, сохранялось. При обследовании, по данным КТ-урографии, выявлена облитерация шейки верхней чашки (рис. 3). Вначале выполнено чрескожное пункционное дренирование верхней чашечки, затем – трансуретральная реканализация зоны облитерации и установлен стент (рис. 4).
Изучение почечной функции во время последнего посещения в стационар выявило средний уровень креатинина 102 (76–125) мкмоль/л при открытой резекции почки и 90 (72–108) мкмоль/л после ЛПН. Разница между пред- и послеоперационным уровнями креатинина составила 18 и 7 мкмоль/л соответственно (р>0,05). Средняя продолжительность наблюдения при открытой резекции почки составила 46 мес. (22–74 мес.), а после ЛПН – 38 мес. (8–64 мес.). Рецидива опухоли по данным контрольных исследований не было.
Обсуждение. Открытая резекция почки до внедрения ЛПН была методом выбора для больных с опухолями единственной или заболеванием контралатеральной почки и наличием хронической почечной недостаточности. Широкому внедрению органосохраняющих операций при раке почки способствовали данные исследований, которые показали, что функциональные и онкологические результаты радикальной нефрэктомии и ПН при опухолях менее 4 см сопоставимы [15–18]. Эти работы указывают на целесообразность выполнения органосохраняющих вмешательств при новообразованиях в стадии Т1а у пациентов со здоровой противоположной почкой.
На этапе внедрения эндовидеохирургических операций, даже при небольших опухолях, в основном выполняли лапароскопическую радикальную нефрэктомию. Со временем количество ЛПН постоянно росло [4, 15–17, 19]. Широкое использование УЗИ и СКТ привело к раннему выявлению опухолей почек, в том числе небольших размеров. Этот факт и накопленный опыт в эндовидеохирургии привели к тому, что соотношение выполняемых лапароскопических нефрэктомий и резекций почки сместилось в пользу последних. Так, Европейская ассоциация урологов рекомендует выполнять ЛПН больным опухолью почки в стадии Т1а [4]. За последние годы появились сообщения о хороших результатах лапароскопической и робот-ассистированной резекции почки при новообразованиях размером более 4 см (Т1b) [4, 20, 21]. В нашей работе опухоли в группе открытого доступа были в среднем на 6 мм больше, чем в группе ЛПН. Подобные данные приводятся и в других публикациях, посвященных сравнению результатов открытой и лапароскопической ПН [16, 17].
При ЛПН на инцизию опухоли и ушивание почечной паренхимы уходит больше времени, чем при открытой резекции почки, что приводит к удлинению ВТИ, в особенности при резекции больших эндофитных и синусных опухолей почки. С целью улучшения результатов ЛПН некоторые авторы используют ренальную гипотермию [22, 23], однако она не получила широкого распространения в клинической практике. В связи с этим в большинстве случаев ЛПН выполняли при тепловой ишемии с пережатием почечной артерии. Альтернативой стандартной ишемии служат резекция почки с использованием селективной или безишемической методики. В нашей работе ВТИ при ЛПН было статистически значимо больше, чем при открытой операции, но значимой разницы в показателях креатинина, определяемых в течение периода наблюдения после ЛПН (102/90 мкмоль/л). Увеличение уровня креатинина по сравнению с предоперационным показателем при ЛПН было больше, чем при открытой резекции почки (18/7 мкмоль/л), однако эта разница не была достоверной.
Показатель содержания креатинина крови при наличии обеих почек не позволяет достоверно судить о функции почки после ее резекции. Несмотря на это, у большинства пациентов, которым была выполнена резекция почки, наблюдается небольшое повышение уровня креатинина из-за нормального функционирования противоположной почки. В настоящее время для оценки функционального состояния почек чаще используют скорость клубочковой фильтрации, результаты которой также прежде всего зависят от уровня креатинина в крови. Цель органосохраняющей хирургии при опухоли почки наряду с онкологическим результатом заключается в сохранении максимального количества функционирующих нефронов. Это достигается путем снижения ВТИ или максимального сохранения почечной паренхимы в процессе ее резекции.
Заключение. В настоящее время ЛПН – это метод выбора при опухолях почки стадии Т1-стадии. Несмотря на сравнительно большее время операции и тепловой ишемии, для ЛПН характерны быстрое выздоровление больных и меньшее число осложнений. При больших эндофитных опухолях единственной почки и недостаточном опыте в эндовидеохирургии резекцию почки можно выполнить открытым доступом.



