Введение. Рак предстательной железы (РПЖ) продолжает занимать лидирующие позиции среди злокачественных новообразований у мужчин, за 2005–2015 гг. прирост заболеваемости составил 135,5% [1]. В качестве активного радикального лечения локализованного и местнораспространенного РПЖ выполняются радикальная простатэктомия или дистанционная лучевая терапия. Несмотря на хорошие показатели выживаемости, у 20–30% пациентов после радикальной простатэктомии развивается биохимический рецидив [2]. Вне зависимости от локализации рецидива в качестве методов лечения используются дистанционная лучевая, а также андрогендепривационная терапия и их комбинация либо наблюдение асимптомных пациентов [3]. Таким образом, лечение биохимического рецидива после радикальной простатэктомии в большинстве случаев проводится без подтверждения его наличия визуализирующими методами.
В последние годы лучевые методы диагностики в значительной степени улучшили свои возможности, что нашло отражение в клинических рекомендациях по лечению РПЖ. Согласно рекомендациям Европейской ассоциации урологов при уровне простатспецифического антигена (ПСА) ≥1 нг/мл рекомендуется позитронно-эмиссионная (ПЭТ)/компьютерная томография (КТ) с холином или с простатспецифическим мембранным антигеном (PSMA) [4]. При этом ПЭТ/КТ 68Ga-PSMA существенно более чувствительна при низких значениях ПСА, чем ПЭТ/КТ с холином [5, 6].
PSMA представляет собой мембранный фермент, продукция которого в клетках РПЖ значительно выше, чем в неизмененной ткани простаты. Локализация каталитического сайта PSMA во внеклеточном домене позволяет разрабатывать небольшие специфические ингибиторы, которые захватываются клеточной мембраной и втягиваются в клетку после связывания лиганда. Использование 68Ga-PSMA в качестве внеклеточного PSMA-ингибитора для ПЭТ-изображений повысило специфичность метода [7, 8]. Частота выявления метастазов составляет 58 и 76% для диапазонов уровня ПСА 0,2–1 и 1–2 нг/мл соответственно [4]. Исследование проведено для изучения диагностических возможностей ПЭТ/КТ 68Ga-PSMA для пациентов с рецидивом рака предстательной железы в связи с тем, что возможности традиционных методов визуализации (КТ/МРТ/остеосцинтиграфия) не позволяют определить тактику лечения подобных пациентов при низких значениях ПСА.
Цель: изучить диагностические возможности ПЭТ/КТ 68Ga-PSMA для пациентов с рецидивом РПЖ.
Материалы и методы. С 2016 по 2017 г. в клинике урологии на базе ГКБ им. С. П. Боткина выполнение ПЭТ/КТ 68Ga-PSMA было рекомендовано 19 пациентам с РПЖ. Двум пациентам исследование проведено для стадирования опухолевого процесса, 17 – для рестадирования в связи с биохимическим рецидивом. Исследование носило ретроспективный характер. Критерии включения: наличие гистологически верифицированного РПЖ, выполненное исследование ПЭТ/КТ 68Ga-PSMA. Критерии исключения: отсутствие согласия на выполнение ПЭТ/КТ 68Ga-PSMA и наблюдение. Оценивали возраст, уровень ПСА, проводимую терапию на момент исследования.
ПЭТ/КТ 68Ga-PSMA выполняли на аппарате GE Discovery PET/CT 690 в режиме «все тело» с пероральным и внутривенным болюсным контрастированием. При ПЭТ/КТ-исследовании фиксировались максимальное значение стандартного поглощения (SUVmax), общая радиационная активность. Места ПЭТ/КТ-позитивных очагов разделены на следующие зоны: ложе предстательной железы, тазовые лимфатические узлы, лимфатические узлы вне таза, мягкие ткани, кости. Пациентам с выявленным метастатическим поражением лимфатических узлов малого таза и забрюшинного пространства при согласии на оперативное вмешательство выполнена спасительная лимфаденэктомия, проведено гистологическое исследование операционного материала. Проведенное исследование ограничено числом пациентов, длительностью наблюдений и ретроспективным характером.

Статистическая обработка проведена с помощью программ Microsoft Office Excel и Statistica v.7.0. Для количественных признаков с распределением, отличающимся от нормального, указывались медиана и интерквартильный размах (IQR) – 25%-й и 75%-й процентили.
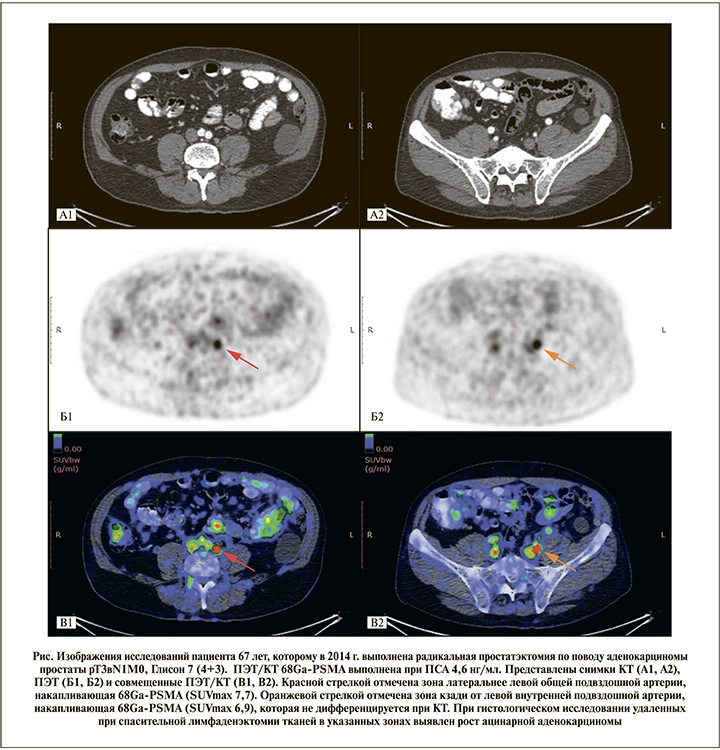
Результаты. Для 17 пациентов, которым ПЭТ/КТ 68Ga-PSMA выполнена для рестадирования по поводу биохимического рецидива, медиана возраста составила 65 лет (IQR – 58,5–70,5). Троим пациентам ПЭТ/КТ выполнены с 68Ga-PSMA и холином. Медиана уровня общего ПСА была 2,36 нг/мл (IQR – 1,5–4,19). У 8 из 17 пациентов уровень ПСА не превышал 2 нг/мл. Медиана времени после радикальной простатэктомии составила 33,2 мес. (IQR – 12–54,5). На момент исследования адъювантная андрогендепривационная терапия пациентам не выполнялась. ПЭТ/КТ-позитивные зоны выявлены у 15 из 17 пациентов. У 9 пациентов ПЭТ/КТ-позитивные очаги отмечены в одной зоне, у 6 – в нескольких (см. рисунок). Результаты ПЭТ/КТ представлены в таблице.
Четырем пациентам с ПЭТ/КТ-позитивными лимфатическими узлами малого таза и/или забрюшинного пространства выполнена спасительная лимфаденэктомия. Медиана уровня ПСА в этой группе пациентов составила 1,1 нг/мл (диапазон – 0,33–4,6 нг/мл). При гистологическом исследовании в 3 из 4 случаев подтверждено наличие злокачественного роста. У 1 пациента с содержанием ПСА 0,33 нг/мл при гистологическом исследовании удаленных тканей злокачественного роста не выявлено.
Обсуждение. В клиническую практику ПЭТ/КТ с 68Ga-PSMA лигандом была введена в 2011 г., однако результаты первого проспективного исследования опубликованы в 2015 г. [5]. Первоначальный опыт применения свидетельствовал о том, что ПЭТ/КТ 68Ga-PSMA может в значительной степени расширить возможности диагностики при РПЖ [14]. В отличие от КТ или МРТ, при которых оценка лимфатических узлов основывается на размерах и форме, при ПЭТ/КТ 68Ga-PSMA возможна визуализация микрометастазов [3]. До недавнего времени ПЭТ/КТ с холином считалась наиболее перспективным методом оценки выявления рецидива РПЖ [10]. Тем не менее этот метод имеет ограничения как при стадировании (недостаточная точность в диагностике поражения лимфатических узлов), так и в случае биохимического рецидива (недостаточная точность при уровне ПСА <2 нг/мл).
Таким образом, при низких значениях ПСА, когда возможно получить наибольшую пользу от таргетного лечения, чувствительность и специфичность ПЭТ/КТ с холином невысоки [11–13].
В 2016 г. проведен мета-анализ данных статей, в которых показана роль ПЭТ/КТ 68Ga-PSMA в стадировании [15]. В 7 исследованиях ПЭТ/КТ 68Ga-PSMA выполнена до радикального лечения. Среднее значение ПСА составило 9,3±2,4 нг/мл. У 203 (74%) из 273 пациентов по результатам ПЭТ/КТ 68Ga-PSMA выявлены подозрительные очаги: у 163 (60%) – в ложе простаты, у 12 (4%) – в тазовых лимфатических узлах, у 28 (10%) очаги более чем в одной зоне. В 4 работах проведена оценка чувствительности и специфичности ПЭТ/КТ 68Ga-PSMA при выявлении поражений, ограниченных предстательной железой. Радикальная простатэктомия с тазовой лимфаденэктомией в качестве референсного стандарта была в 3 исследованиях, в одном использовались результаты биопсии. Общая чувствительность исследований составила 70% (95% ДИ – 53–83%), общая специфичность – 84% (95% ДИ – 24–99%) [15].
Оценка лимфатических узлов у пациентов с первично выявленным РПЖ важна для определения тактики лечения. Особенно это актуально для пациентов с высоким риском метастазирования (местнораспространенный рак, сумма Глисона более 7, ПСА более 20 нг/мл). В настоящее время чаще всего для оценки состояния лимфатических узлов используется КТ или МРТ. Согласно результатам мета-анализа, общая чувствительность и специфичность для КТ составили 42 и 82%, для МРТ – 39 и 82% соответственно [16]. Оценка поражения лимфатических узлов путем лимфаденэктомии связана с рисками лимфореи, формирования лимфоцеле, тромбоэмболических осложнений и увеличением продолжительности оперативного вмешательства [17]. В этом отношении возможность более точной оценки состояния лимфатических узлов представляется актуальной. В сравнительном исследовании [18] при оценке лимфатических узлов для стадирования чувствительность 68Ga-PSMA ПЭТ/КТ составила 65,9%, а специфичность – 98,9%. Отмечена лучшая выявляемость метастазов в лимфатических узлах при использовании 68Ga-PSMA ПЭТ/КТ, чем при КТ или МРТ, при которых чувствительность составила 43,9 и 27,3% соответственно. Кроме того, в нескольких исследованиях показано преимущество 68Ga-PSMA ПЭТ/КТ перед ПЭТ/КТ с холином [19–21].
Наибольшее число статей, в которых описаны возможности 68Ga-PSMA ПЭТ/КТ, посвящены его роли в диагностике рецидива РПЖ. Традиционные методы визуализации, такие как остеосцинтиграфия и КТ, характеризуются низкой частотой выявления зон рецидива при невысоких значениях ПСА. Так, при уровне ПСА менее 7 нг/мл частота выявления рецидива с помощью остеосцинтиграфии составляет 5%, чувствительность КТ при выявлении местного рецидива и метастазов в лимфатические узлы – 11–14% [22]. Согласно данным мета-анализа [23], частота выявления рецидива при ПЭТ/КТ 68Ga-PSMA составляет 76% (66–85%). Чувствительность и специфичность в расчете на пациента составили 86%, в расчете на зону поражения чувствительность составила 80%, специфичность – 97% [23]. В исследовании, включившем более тысячи пациентов, частота обнаружения рецидива с помощью ПЭТ/КТ 68Ga-PSMA составила 97,5% [24]. В двух других крупных работах [7, 15] данный показатель варьировался в пределах от 83 до 90%. В ряде исследований показано преимущество ПЭТ/КТ 68Ga-PSMA при обнаружении зон рецидива по сравнению с КТ и МРТ [5, 7].
Несмотря на рост числа публикаций, посвященных ПЭТ/КТ 68Ga-PSMA, гистологическое исследование в качестве референсного стандарта подтверждения или опровержения злокачественного роста использовано лишь в двух [15].
В работе D. Pfister et al. [25], включившей 28 пациентов, чувствительность ПЭТ/КТ 68Ga-PSMA составила 86,9%, специфичность – 93,1%, а в исследовании I. Rauscher et al. [26], включившем 48 пациентов, эти цифры составили 100 и 50% соответственно. Согласно данным, представленным в обзоре [15], частота выявления рецидива при уровне ПСА 0,2–0,49 нг/мл составила 50%, 0,5–0,99 нг/мл – 53% и далее возрастала при более высоком уровне ПСА на момент исследования. В проведенном нами исследовании 4 из 17 пациентов, которым ПЭТ/КТ 68Ga-PSMA выполнена по поводу рецидива РПЖ, произведена спасительная лимфаденэктомия. У 3 из 4 пациентов гистологически подтвержден рецидив РПЖ.
У пациента, при гистологическом исследовании операционного материала которого злокачественного роста не выявлено, исходно отмечен наименьший уровень ПСА (0,33 нг/мл). Стоит отметить, что в работе [27] показано, что оптимальными cut-off-значениями для выполнения ПЭТ/КТ 68Ga-PSMA являются время удвоения ПСА 6,5 мес. и уровень ПСА 0,83 нг/мл.
Успехи в более ранней и точной диагностике с помощью ПЭТ/КТ 68Ga-PSMA позволили внедрить в клиническую практику таргетную радиоизотопную терапию, которая также основана на возможности концентрировать внутри клетки PSMA-радиоизотопа. В обзоре результатов 9 ретроспективных исследований, включивших 245 пациентов, которым проведена терапия лютецием PSMA (177Lu-PSMA), авторы говорят о значимом ответе от большой части пациентов (снижение уровня ПСА более чем на 50% у 30–70% пациентов с метастатическим РПЖ) при низком уровне токсичности [28].
ПЭТ/КТ 68Ga-PSMA в настоящее время считается наилучшим методом визуализации у пациентов с РПЖ [29], но и он имеет некоторые ограничения. Физические основы получения изображений ПЭТ не позволяют выявлять пораженные лимфатические узлы размером менее 4 мм [18, 30]. Кроме того, пораженные зоны вблизи ложа простаты сложно дифференцировать, если они расположены рядом с мочевым пузырем, который сам интенсивно окрашен по шкале SUV [31, 32].
Заключение. Обнаружение и точная локализация метастазов в лимфатические узлы при рецидиве РПЖ важны для выбора оптимальной стратегии лечения, что в свою очередь может стать определяющим в дальнейшем безрецидивном течении. В случае подтвержденного рецидива в виде олигометастатического поражения лимфатических узлов может быть целесообразной лимфаденэктомия или дистанционная лучевая терапия, которые в свою очередь могут приводить либо к излечению, либо к отсрочке андрогендепривационной терапии. Таким образом, ПЭТ/КТ 68Ga-PSMA позволяет улучшать раннюю диагностику олигометастатического поражения при рецидиве рака предстательной железы. Для более точного определения роли ПЭТ/КТ 68Ga-PSMA в клинической практике требуется проведение дальнейших исследований.


