Актуальность. Около 15% случаев мужского бесплодия связаны с наличием инфекционно-воспалительного процесса в половой системе [1, 2]. С учетом того, что топическая диагностика не всегда оказывает принципиальное влияние на тактику лечения при таких формах бесплодия, для них была предложена отдельная нозологическая единица – «инфекции добавочных половых желез» (MAGI – «male accessory gland infection») [3]. Под этим термином подразумевают широкую группу инфекционно-воспалительных заболеваний, включающую простатит, везикулит, эпидидимит и более редкие состояния, которые объединяет потенциальное негативное влияние на мужскую фертильность. Бесплодие при инфекциях добавочных половых желез может быть связано с прямым повреждающим воздействием бактерий на сперматозоиды, образованием антител к сперматозоидам, нарушением секреторной функции эпителия и влиянием лейкоцитов, продуцирующих активные формы кислорода [4, 5].
Лейкоцитоспермия является наиболее известным маркером MAGI, хотя и не обладает исключительно высокой чувствительностью и специфичностью. В частности, у каждого пятого бесплодного мужчины без лейкоцитоспермии может выявляться значимая бактериоспермия, ассоциированная со снижением концентрации и подвижности сперматозоидов. И наоборот, на практике приходится сталкиваться со случаями стерильной лейкоцитоспермии [6].
Для лейкоцитоспермии были предложены различные критерии, как правило, основанные на концентрации пероксидазо-положительных клеток в эякуляте. С этим связан еще один недостаток этого маркера – прореагировавшие нейтрофилы не окрашиваются на пероксидазу, что приводит к ложноотрицательным результатам анализа. В предыдущей версии руководства Всемирной организации здравоохранения (ВОЗ) по анализу и обработке эякулята за пороговую концентрацию лейкоцитов был предложен показатель в 1 млн/мл. Некоторые авторы считают это значение заниженным, а некоторые, напротив, завышенным [7, 8]. Несмотря на существующие противоречия, актуальная версия руководства ВОЗ по-прежнему определяет лейкоцитоспермию как концентрацию пероксидазо-положительных клеток в эякуляте выше 1 млн/мл, хотя и с уточнением, что это определение носит эмпирический характер и пока не имеет доказательной базы.
Необходимо учитывать, что считается конечной точкой при попытке определения порогового значения: другие показатели спермограммы, вероятность наступления естественной беременности, результаты применения вспомогательных репродуктивных технологий, бактериоспермия или оксидативный стресс сперматозоидов? Обработка эякулята перед ВРТ механически устраняет лейкоциты, но не решает проблемы оксидативного стресса мужских половых клеток, а может даже ее усугубить. Очевидно, что даже кратковременное взаимодействие с гранулоцитами с учетом их физиологической роли может приводить к оксидативному повреждению сперматозоидов и ухудшению результатов ВРТ. Повышение концентрации лейкоцитов в эякуляте часто провоцирует практических врачей на назначение антибактериальной терапии, несколько реже – на проведение культурального исследования. Тем не менее лейкоцитоспермия и MAGI не тождественны друг другу. Антибиотикотерапия не всегда оправданна и не всегда приводит к улучшению мужской репродуктивной функции. Поскольку лейкоцитоспермия практически никогда не ассоциирована с жизнеугрожающими состояниями, необходимо учитывать и риски, связанные с развитием антибиотикорезистентности и селекцией агрессивных штаммов бактерий.
Кроме того, антибактериальная терапия обладает потенциальным неблагоприятным влиянием на сперматозоиды, для нейтрализации которого может потребоваться некоторое время [9]. Это приводит к ненужному и иногда неприемлемому откладыванию сроков применения ВРТ в бесплодной паре.
Актуален поиск альтернативных методов устранения неблагоприятного влияния лейкоцитов на сперматозоиды. Перспективным направлением является цитокинотерапия, поскольку именно цитокины являются главным гуморальным регулятором функции гранулоцитов. Цитокиновый препарат Суперлимф ранее продемонстрировал свою эффективность в терапии хронического простатита, который является частным случаем MAGI [10].
Универсальные механизмы действия цитокинов в отношении различных возбудителей, способность модулировать иммунный ответ, а также неспособность микроорганизмов формировать факторы резистентности по отношению к ним создают перспективу использования цитокиновых препаратов в составе комплексной терапии инфекционно-воспалительных заболеваний. Так, применение препарата Суперлимф при простатите способствует уменьшению выраженности клинических симптомов заболевания в более короткие сроки, уменьшает количество лейкоцитов в секрете простаты, положительно влияет на динамику воспалительного процесса, что приводит к улучшению качества жизни больных данной категории [11].
В связи с этим мы провели исследование, целью которого было сравнение влияния цитокинотерапии и антибактериальной терапии на показатели спермограммы и дополнительных функциональных тестов у пациентов с бесплодием на фоне MAGI, готовящихся к применению ВРТ.
Материалы и методы. На базе отделения андрологии и урологии НМИЦ АГП им. В. И. Кулакова проведено рандомизированное проспективное контролируемое клиническое испытание без ослепления. В исследование вошли 60 мужчин из бесплодных пар с признаками MAGI, готовящихся к применению ВРТ.
Пациенты были разделены на две группы:
- Основная группа: 30 пациентов, применявших суппозитории Суперлимф (25 ед.) 2 раза в сутки на протяжении 20 дней.
- Группа сравнения: 30 пациентов, получавших по поводу MAGI антибактериальную терапию (доксициклин по 100 мг 2 раза в сутки 28 дней).
Критерии включения:
- Мужской пол.
- Возраст от 18 до 60 лет.
- Бесплодный брак (отсутствие беременности у супруги после 12 мес. половой жизни без контрацепции).
- Лейкоцитоспермия, подтвержденная с помощью пероксидазного теста.
- Подписанная форма информированного согласия.
Критерии исключения:
- Лечение MAGI и инфекций, передаваемых половым путем, в анамнезе.
- Выявление полирезистентной микрофлоры (в т.ч. резистентной к доксициклину) при бактериологическом исследовании эякулята.
- Аномалии развития и приобретенные анатомические изменения семенных путей (в т.ч. гиперплазия простаты).
- Аллергия на компоненты препаратов, применяемых в основной группе и группе сравнения.
- Необходимость приема иных лекарственных препаратов на протяжении исследования.
- Женское бесплодие
Дизайн исследования:
- Визит 0 – процедуры скрининга: опрос пациента, общий осмотр, выполнение спермограммы, бактериологическое исследование эякулята, анализ на активные формы кислорода в эякуляте, MAR-тест, определение фрагментации ДНК сперматозоидов методом TUNEL, ультразвуковое исследование органов мошонки и трансректальное ультразвуковое исследование; проверка соответствия критериям включения/исключения; заполнение формы информированного согласия.
- Визит 1 – начало терапии (день 1): выдача пациентам из основной и контрольной групп препарата (Суперлимф или доксициклин), инструкции по его применению, в т.ч. о недопустимости использования иных лекарственных средств и антиоксидантных добавок на протяжении исследования.
- Визит 2 – выполнение контрольных исследований (день 33±3): повторное выполнение спермограммы, MAR-теста, анализа на активные формы кислорода в эякуляте и фрагментацию ДНК сперматозоидов, бактериологического исследования спермы; проведение опроса на предмет нежелательных явлений.
- Визит 3 – контрольный визит (день 120±10): оценка результатов применения ВРТ, опрос на предмет нежелательных явлений.
Значимость различий исходных и финальных показателей оценивалась с помощью парного t-теста Стьюдента или теста Уилкоксона в зависимости от характера распределения данных. Значимость различий показателей между группами оценивалась с помощью U-теста Манна–Уитни или t-теста Стьюдента в зависимости от характера распределения данных. Для оценки характера распределения использовался тест Шапиро–Уилка. Для сравнения категориальных переменных использовался точный тест Фишера.
Результаты. После успешного прохождения процедур скрининга из исследования выбыли 7 пациентов. Причины выхода из исследования описаны в табл. 1. Таким образом, в финальный анализ вошли данные 53 пациентов (28 в основной группе и 25 в группе сравнения).

За исключением параметров подвижности сперматозоидов все оцениваемые показатели по результатам проверки Шапиро–Уилка не подчинялись закону нормального распределения (p<0,05). Для сравнения групп и временных точек по этим показателям использовался U-тест Манна–Уитни и тест Уилкоксона, а сами данные представлены в виде медиан и межквартильных интервалов. Для сравнения показателей подвижности сперматозоидов использовался тест Стьюдента, сами показатели представлены в виде средних значений и стандартного отклонения.

Основная группа и группа сравнения исходно были сопоставимыми по большинству спермиологических показателей (табл. 2). В основной группе медиана концентрации лейкоцитов в эякуляте была выше, чем в группе сравнения (2,1 против 1,8 млн/мл; p=0,049), хотя номинально такая разница вряд ли могла влиять не результаты исследования. Результаты бактериологического исследования эякулята в изучаемых группах представлены на рис. 1.
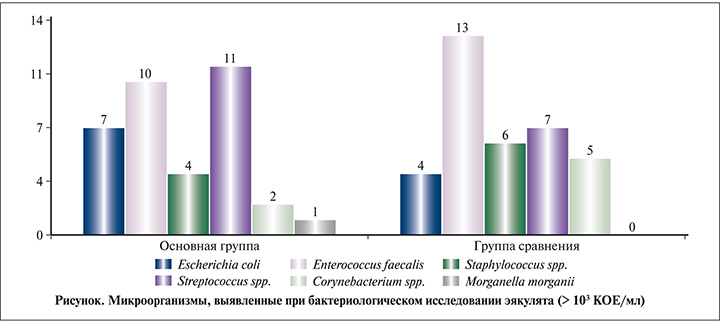
После проведения терапии отмечена статистически значимая разница по уровню генерации свободных радикалов в эякуляте (p=0,031). По остальным спермиологическим показателям разницы не было выявлено (табл. 3). Эрадикация микроорганизмов по данным бактериологического исследования произошла у 57,1% пациентов в основной группе и у 88% пациентов в группе сравнения (p=0,016).
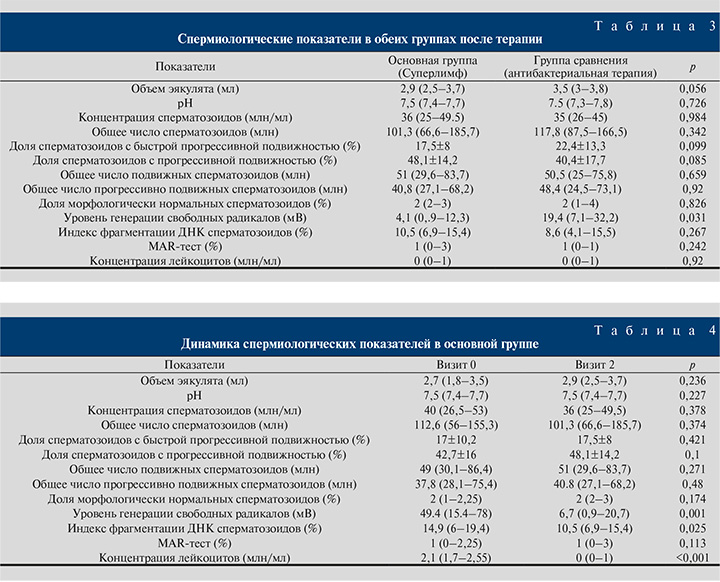
В группе пациентов, получавших монотерапию препаратом Суперлимф, отмечалось статистически значимое снижение уровня генерации свободных радикалов, индекса фрагментации ДНК сперматозоидов и концентрации лейкоцитов в эякуляте (табл. 4).
У пациентов, получавших антибактериальную терапию, отмечалось статистически значимое снижение уровня генерации свободных радикалов и концентрации лейкоцитов (табл. 5).

Все пары, где мужчина окончил курс терапии, вступили в протокол ВРТ. При оценке результатов ВРТ через 3 мес. после окончания терапии выяснилось, что с учетом переносов витрифицированных эмбрионов в 13 парах в основной группе наступила беременность (46,4%). В контрольной группе клиническая беременность наступила в 8 (32%) наблюдениях. Таким образом, отмечалась тенденция в более высокой частоте наступления беременности в парах, где мужчина получал цитокинотерапию по поводу MAGI.
Обсуждение. Наши результаты продемонстрировали, что монотерапия препаратом Суперлимф у бесплодных пациентов с инфекциями добавочных половых желез имеет сопоставимую эффективность со стандартной антибиотикотерапией по ряду конечных точек, а в плане динамики показателей оксидативного стресса и индекса фрагментации ДНК сперматозоидов даже превосходит ее. С учетом отсутствия у цитокинотерапии бактерицидного и бактериостатического эффектов в классическом понимании меньшая частота эрадикации микроорганизмов по посеву эякулята была ожидаемой. Можно предположить, что эрадикация микроорганизмов обусловлена входящими в состав препарата Суперлимф антимикробными пептидами, которые способны нейтрализовать действие липополисахаридов бактериальных клеточных стенок. Комплекс природных цитокинов и антимикробных пептидов сочетает в себе свойства иммуномодулятора и эндогенного антибиотика, что может быть высокоэффективным методом в лечении воспалительных заболеваний бактериального генеза [12–14]. Однако основной целью терапии MAGI при мужском бесплодии является нормализация спермиологических показателей (в частности, снижение уровня оксидативного стресса) и повышение шансов на естественное зачатие, а не устранение микробного агента как такового. Даже с учетом этого частота эрадикации в обеих группах была сопоставимой (57,1 против 88%), что является впечатляющим результатом для терапии без назначения антибиотика. В группу антибиотикотерапии набирались только пациенты с возбудителями MAGI, чувствительными к доксициклину; соответственно, эффективность элиминации закономерно была выше, чем при эмпирическом назначении антибиотиков.
Ранее было показано, что терапия с использованием препарата Суперлимф приводила к улучшению показателей спермограммы, снижению уровня фрагментации ДНК сперматозоидов и снижению уровня оксидативного стресса [15]. Кроме того, описан положительный опыт применения препарата Суперлимф в гинекологии, где доказано его положительное влияние на элиминацию возбудителей, частоту разрешения хронического эндометрита у женщин, нормализацию баланса про- и противовоспалительных цитокинов, частоту наступления беременности и рождения детей [16–18].
Как антибиотикотерапия, так и цитокинотерапия приводили к статистически значимому снижению концентрации лейкоцитов в эякуляте. С одной стороны, можно предположить, что важен сам факт наличия или отсутствия лейкоцитоспермии, чем данный количественный показатель. С другой стороны, с учетом разногласий в определении порогового уровня диагностически значимой лейкоцитоспермии, упомянутых во введении к данной статье, мы предпочли ориентироваться именно на концентрацию лейкоцитов. Немаловажно и то, что общее количество пероксидазо-положительных клеток в эякуляте может отражать тяжесть воспалительного процесса [19].
В обеих группах мы наблюдали значительное снижение генерации свободных радикалов на фоне назначенной терапии. Свободные радикалы и активные формы кислорода в частности способны нарушать функциональную способность сперматозоидов и являются важнейшим фактором риска в развитии мужского бесплодия [20, 21]. Интересно, что в группе пациентов, получавших Суперлимф, снижение выраженности оксидативного стресса было более выраженным, чем на фоне антибиотикотерапии. Это может объясняться тем, что основным источником активных форм кислорода в условиях MAGI являются лейкоциты. Цитокины, входящие в состав препарата Суперлимф, оказывают прямое модулирующее воздействие на их функцию, тогда как влияние антибиотика реализуется через устранение микроорганизма и постепенное угасание воспалительной реакции. Кроме того, нельзя окончательно исключать и неблагоприятного воздействия антимикробного препарата на сперматогенез [22]. Для получения более объективных результатов в это исследование включались только пациенты с чувствительной к доксициклину микрофлорой в эякуляте, но даже в пределах одной фармакологической группы спектр побочных явлений препаратов может различаться [23].
Одной из наиболее уязвимых мишеней для свободных радикалов является ДНК сперматозоида. Именно грубые повреждения ДНК сперматозоидов приводят не только к снижению фертильности мужчины, но и к повышению рисков невынашивания беременности и неудач при применении вспомогательных репродуктивных технологий. Тенденция к снижению индекса фрагментации ДНК сперматозоидов наблюдалась в обеих группах, но только в группе пациентов, получавших цитокинотерапию, она достигла статистической значимости. Немаловажно то, что наблюдалась тенденция к более высокой частоте наступления беременности в результате ВРТ в тех парах, где с целью быстрой и безопасной подготовки при наличии воспалительных изменений в эякуляте назначалась цитокинотерапия. Эффективность препарата Суперлимф в плане снижения выраженности оксидативного повреждения сперматозоидов и степени фрагментации их ДНК была ранее показана на примере пациентов с хроническим простатитом [24].
Заключение. Многие вопросы диагностики и лечения инфекций добавочных половых желез у мужчин недостаточно изучены и плохо стандартизованы. В частности, мало изучены альтернативные варианты терапии, особо актуальные ввиду имеющей глобальный масштаб проблемы антибиотикорезистентности. В контексте MAGI при мужском бесплодии цитокинотерапия (препарат Суперлимф) по большинству конечных точек не уступает длительной антибиотикотерапии и оптимально подходит для быстрой подготовки пары к протоколу ВРТ. В сложных клинических случаях, требующих не только устранения микроорганизма, но и быстрой нормализации показателей оксидативного стресса, перспективна комбинированная терапия с применением антибиотиков и препарата Суперлимф.



