По данным НИИ урологии [1], в последние годы мочекаменная болезнь (МКБ), которую в настоящее время относят к наиболее значимым в медико-демографическом отношении заболеваниям, занимает лидирующие позиции – 33,9%. У 70–80% больных МКБ в составе почечных конкрементов преобладает оксалат кальция. Причиной формирования данного вида почечных конкрементов может быть как избыточное поступление оксалата и его предшественников с пищей, так и врожденное нарушение метаболизма оксалата. В то же время дефицит магния (Mg) является одним из пусковых факторов
развития уролитиаза [2, 3], а сам магний способен играть роль ингибитора формирования кристаллов
оксалата кальция in vitro [4], снижать выраженность экспериментального кальций-фосфатного нефролитиза [5]. Вместе с тем данные литературы, подтверждающие его эффективность при кальций-оксалатном нефролитиазе in vivo, зачастую противоречивы. С одной стороны, в исследованиях [6, 7] показано, что Mg оксид в комбинации с пиридоксином способствовал уменьшению размеров почечных конкрементов, с другой – эти изменения не всегда были статистически достоверными.
Целью настоящего исследования стала оценка влияния Mg хлорида, Mg L-аспарагината и их комбинаций с пиридоксином на течение кальций-оксалатного нефролитиаза.
Материалы и методы. Оценка влияния солей Mg на течение нефролитиаза, вызванного введением оксалата натрия и целекоксиба, проведена согласно методике [8]. Данная методика, по мнению ее авторов, позволяет моделировать гипероксалурию при умеренном повреждении канальцевого аппарата почки. Эксперименты выполнены на 45 белых беспородных крысах-самцах исходной массой 180–254 г. Интактную группу составили шесть животных. У остальных крыс моделировали нефролитиаз путем добавления в пищевой рацион натрия оксалата (3% от массы рациона) и селективного ингибитора циклооксигеназы (ЦОГ)-2 целекоксиба (целебрекс®, “Pfizer”, США) в дозе 100 мг на 1 кг массы тела. Дизайн исследования представлен на рис. 1.
Рисунок 1. Дизайн исследования.
Мочу крыс в течение суток собирали в метаболические камеры после пероральной водной нагрузки
из расчета 4 мл дистиллированной воды на 200 г массы тела животного и хранили при 4°С. Для изучения мочевого осадка и измерения рН отбирали 1 мл из первой трехчасовой порции мочи и изучали 10 мкл осадка под малым (ок. 15, об. 9) и большим (ок. 15, об. 40) увеличением микроскопа Биолам ЛОМО (Санкт-Петербург); рН мочи измеряли ионометром.
Уровень оксалатов в моче определяли титриметрически по методу Сивориновского [9]. Содержание
Mg в плазме, эритроцитах и моче определяли при помощи цветной реакции с титановым желтым [10].
Концентрацию фосфатов, кальция, креатинина в плазме и моче определяли с помощью стандартных
наборов фирмы “Лахема” (Чехия).
Для оценки функции почечных канальцев рассчитывали следующие относительные показатели:
– фракционную экскрецию Mg (ФЭMg) по формуле [11]:
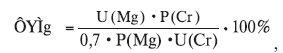
где U(Mg) и U(Cr) – концентрация соответственно Mg и креатинина в моче, мМ/л; P(Mg) и P(Cr) – концентрация соответственно Mg и креатинина в плазме крови, мМ/л;
– фракционную экскрецию кальция/фосфатов (ФЭСа/Р) по формуле [12]:
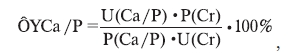
где U(Ca/P), U(Cr) – концентрация соответственно кальция/фосфора и креатинина в моче, мМ/л;
P(Ca/P), P(Cr) – концентрация соответственно кальция/фосфатов и креатинина в плазме крови,
мМ/л.
Для оценки функциональной активности клубочков рассчитывали клиренс креатинина Cl(Cr):
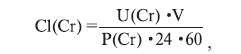
где U(Cr) – концентрация креатинина в суточной моче, мМ/л; P(Cr) – концентрация креатинина в
плазме крови, мМ/л; V – суточный диурез, мл.
Кроме того, оценивали отношение концентрации кальция к концентрации Mg и концентрации креатинина к концентрации оксалата в суточной моче [13]. Последний показатель косвенно характеризует зависимость функциональной активности клубочков от уровня оксалатов в моче.
После того как у животных с моделируемым патологическим состоянием уровни кристаллурии, оксалурии, кальцурии, рН мочи стали достоверно отличаться от контроля, им через зонд вводили соли Mg: Mg L-аспарагинат, Mg хлорид и их комбинации с витамином В6, а также препараты сравнения Mg
сульфат и Магне В6 (Mg лактат с витамином В6) фирмы "Sanofi Aventis" (Франция) в дозе 50 мг элементарного Mg на 1 кг массы тела. Соотношение Mg: пиридоксин составило 10:1. Через 14 дней введения солей животных декапитировали под эфирным наркозом с соблюдением всех норм GLP.
Для морфологических исследований почки в течение 24 ч фиксировали в нейтральном забуференном 4%-ном растворе формалина (рН 7,4), затем их заливали в парафиновые блоки по общепринятым
морфологическим методикам. На санном микротоме изготавливали поперечные срезы почек толщиной 3–5 мкм, окрашивали гематоксилином и эозином. С помощью программы “ВидеоТестМорфо-4”
(Россия) определяли объемную долю кальцификатов и их размеры.
Статистическую обработку полученных результатов проводили с помощью программы Statistika 6.0,
используя однофакторный дисперсный анализ и критерий Дункана.
Результаты. Через 14 дней после начала эксперимента масса тела животных и диурез достоверно не
изменились. У всех крыс отмечалось статистически значимое повышение уровня оксалатов в моче
(с 59,22±2,23 до 85,91±8,75 мкМ/л; р=0,014), кристаллов оксалата кальция (с 1±1 до 25±1 кристалл
в 10 мкл мочевого осадка; р=0,003), снижение рН мочи (с 6,42±0,1 до 6,14±0,11; р=0,061). Произошло
также недостоверное снижение клиренса креатинина с 1,01±0,13 до 0,89±0,12 мл/мин. Уровень Mg
в плазме крови, эритроцитах и моче достоверно не изменился и оставался в пределах физиологиче-
ской нормы. Фракционная экскреция Mg у экспериментальных животных возросла на 20%. Уровень
фосфора в плазме крови, моче и его фракционная экскреция, а также концентрации кальция в плазме
крови и моче статистически значимо не изменились. Фракционная экскреция кальция повысилась
на 22%. Соотношение Ca/Mg в моче статистически значимо не изменилось, а соотношение оксалат/
креатинин в группе, получавшей натрия оксалат и целекоксиб, выросло на 11%. Таким образом, перечисленные выше изменения лабораторных показателей указывали на развитие у животных экспериментального нефролитиаза.
С 15-го дня эксперимента некоторым животным вводили соли Mg через зонд.
В дальнейшем (через 28 дней после начала эксперимента) в группе, получавшей только обогащенную
оксалатами и целекоксибом диету, патологические изменения прогрессировали. Так, уровень оксалатов в моче вырос на 171% (р<0,0001), усилилась кристаллурия до 105 кристаллов в 10 мкл мочевого осадка (р<0,0001), клиренс креатинина снизился на 29% по сравнению с контролем (p=0,087). Возросли фракционная экскреция Mg на 10%, фракционная экскреция фосфора – на 23%, фракционная экскреция кальция – на 35% (p=0,038). Уровень Mg в плазме крови и эритроцитах не изменился. Отмечено увеличение соотношения Ca/Mg и оксалат/креатинин в моче на 16 и 189% соответственно. Масса животных и диурез статистически значимо не различались (см. таблицу).
При микроскопическом исследовании у крыс, получавших обогащенную оксалатами и целекоксибом диету, были выявлены кальцификаты (61,3 мкм2) как в мозговом (наружная и внутренняя зона), так и в корковом веществе, а также собирательных трубочках; объемная доля составила 4%, тогда как у животных интактной группы патологическое отложение солей кальция не отмечалось ни в одном из отделов почечной паренхимы (рис. 2).
У животных, которым вводили соли Mg, нефролитиаз по совокупности лабораторных показателей
протекал в более легкой форме, нежели у животных, которые данные препараты не получали.
На 14-й день введения солей Mg у данных животных отмечен статистически значимо более низкий
уровень оксалатов и кристаллов в моче, более высокие значения рН, чем в группе, получавшей только
натрия оксалат и целекоксиб.
Уровень Mg в эритроцитах животных, получавших соли Mg, стал статистически значимо выше, чем в
норме (1,81±0,03 мМ/л) и при патологических состояниях (1,74±0,05 мМ/л). По уровню Mg в эритроцитах группы, получавшие соли Mg, расположились в следующем порядке по убыванию: Mg L-аспарагинат в комбинации с витамином В6 (2,4±0,07 мМ/л), Mg хлорид в комбинации с витамином В6 (2,3±0,07 мМ/л), Mg L-аспарагинат (2,23±0,08 мМ/л), Магне В6 (2,17±0,05 мМ/л), Mg хлорид (2,1±0,04 мМ/л), Mg сульфат (2,11±0,05 мМ/л). При этом были обнаружены следующие статистически значимые различия: группы, получавшие Mg L-аспарагинат и Mg хлорид в комбинациях с витамином В6, отличались от Mg хлорида, Mg L-аспарагината, препарата сравнения Mg сульфата. Mg L-аспарагинат в комбинации с витамином В6 имел отличия от Магне В6. Mg хлорид и Mg L-аспарагинат также достоверно отличались от Mg сульфата. Необходимо отметить, что, несмотря на статистически значимые межгрупповые различия, в группах животных, получавших препараты Mg, все изменения были в пределах верхних границ физиологической нормы.
Концентрация Mg в моче после введения солей повысилась по сравнению интактной группой и
животными, не получавшими препараты Mg (см. таблицу). Результат ранжирования групп по показателю концентрации Mg в моче выглядит следующим образом: Mg L-аспарагинат в комбинации с витамином В6>Mg хлорид в комбинации с витамином В6>Магне В6>Mg L-аспарагинат>Mg хлорид>Mg
сульфат. Группы животных, получавших Mg L-аспарагинат и Mg хлорид в комбинациях с витамином В6, между собой статистически значимо не различались. Группа Mg L-аспарагината в комбинации с витамином В6 достоверно отличалась от всех других групп, а Mg хлорида в комбинации с витамином В6 – от Mg хлорида. Все соли достоверно отличались от препарата сравнения Mg сульфата.
Концентрация кальция в моче снизилась, что наряду с повышением уровня Mg в моче привело к достоверному снижению соотношения Ca/Mg в моче. В результате введения солей Mg произошло
снижение фракционной экскреции фосфора и кальция. Клиренс креатинина и фракционная экскреция Mg в группах, получавших соли, выросли по сравнению с группами интактного контроля и смоделированного патологического состояния (см. таблицу).
Таблица. Влияние солей Mg на некоторые показатели мочи в условиях диеты, содержащей оксалат натрия и целекоксиб (28-й день эксперимента; M±m).
По степени коррекции гипероксалурии, выделения кристаллов оксалата кальция, повышения рН
исследуемые соли проявили сходную эффективность, за исключением Mg сульфата, меньше всех
способствовавшего компенсации патологических изменений, и по ряду показателей (концентрация
оксалатов в моче и суточная экскреция оксалатов с мочой, клиренс креатинина) отличавшегося от группы не только с смоделированным патологическим состоянием, но и контроля. При этом статистически значимые различия были выявлены только по степени коррекции выделения кристаллов с мочой между Mg L-аспарагинатом в комбинации с витамином В6 и Mg сульфатом.
Морфологическое исследование почек крыс, получавших соли Mg, позволило выявить следующие
изменения (рис. 2).
Рисунок 2. Гистологическая картина препаратов почек крыс на 28 день эксперимента. Окраска гематоксилином и эозином. Ув. 50.
У животных, получавших Mg L-аспарагинат в комбинации с витамином В6, отмечены единичные кальцификаты в корковом веществе и наружной зоне мозгового вещества. Во внутренней зоне мозгового вещества определено небольшое количество кальцификатов, объемная доля которых составила 1% и была достоверно меньше, чем в группе животных, получавших обогащенную оксалатами и целекоксибом диету. В собирательных трубочках патологических отложений солей кальция не отмечено (см. рис. 2).
При применении Mg L-аспарагината в почках отмечено незначительное количество кальцификатов в наружной зоне мозгового вещества (объемная доля – 0,5%). В корковом веществе и внутренней
зоне мозгового вещества патологические включения отсутствовали (см. рис. 2).
У крыс, получавших Mg хлорид в комбинации с витамином В6, выявлены единичные мелкие кальцификаты, расположенные преимущественно в наружной зоне мозгового вещества (объемная доля – 1%). В корковом веществе и внутренней зоне мозгового вещества имели место единичные мелкие кальцификаты размером 93,4 мкм2 (см. рис. 2).
Применение Mg хлорида характеризовалось наличием незначительного количества мелких кальцификатов во всех отделах паренхимы с преимущественной локализацией в наружной зоне мозгового вещества (объемная доля – 1%; размер – 81,2 мкм2). После введения Mg сульфата в почках определены единичные кальцификаты в наружной зоне мозгового вещества, объемная доля которых составила 1,6%, а размеры – 63,8 мкм2.
У крыс, получавших магне В6, кальцификаты обнаруживались преимущественно во внутренней и
наружной зонах мозгового вещества. Объемная доля составила 0,3%, а размеры – 35,8 мкм2 (см. рис. 2).
Необходимо отметить, что во всех группах, получавших соли Mg, объемная доля кальцификатов была достоверно меньше, чем в группе крыс, получавших только обогащенную оксалатами и целекоксибом диету.
Таким образом, данные проведенного морфологического исследования свидетельствуют об уменьшении объемной доли кальцификатов у животных, получавших соли Mg, по сравнению с группой
животных, получавших только натрия оксалат и целекоксиб, который усиливает цитотоксический
эффект оксалата [6, 8]. При этом наиболее эффективными оказались Магне В6 и Mg L-аспарагинат.
Обсуждение. По данным [6], Mg способен оказывать угнетающее влияние на образование кристаллов кальция оксалата. Однако данные, полученные ранее S. Khan и соавт. [7], свидетельствовали о
недостоверности подобных изменений. Возможно, это связано с тем, что в данном исследовании изучалось влияние на формирование кальций-оксалатного нефролитиаза Mg оксида, который, по данным [14], обладает низкой биодоступностью – 4%. Ранее нами [15] было проведено исследование скорости компенсации дефицита Mg различными органическими и неорганическими солями. Было показано, что Mg хлорид и Mg L-аспарагинат наиболее эффективно компенсируют алиментарный дефицит Mg и достоверно превосходят Mg оксид по данному показателю. Mg конкурирует с оксалатами на этапе всасывания в кишечнике [16]. Кроме того, хотя достоверных изменений клиренса креатинина отмечено не было, имела место тенденция к его снижению у крыс, получавших натрия оксалат и целекоксиб, что, возможно, связано с токсическими эффектами целекоксиба и цитотоксическим эффектом оксалата натрия [17]. Одной из распространенных моделей воспроизведения нефролитиаза является комбинация нагрузки оксалатами и гентамицином. Она позволяет добиваться развития умеренной гипероксалурии в сочетании с тубулярной дисфункцией. На примере этой модели показано, что повреждение канальцев также вносит вклад в формирование и рост кристаллов. Кроме того, аминогликозидные антибиотики обладают бактерицидным эффектом по отношению к Oxalobacter formigens, Lactobacillus, нанобактериям, которые играют немаловажную роль в патогенезе нефролитиаза [18]. Поэтому использованная в данной работе модель нагрузки оксалатом и целекоксибом, благодаря селективному воздействию на ЦОГ-2 не вызывающим типичных для неселективных нестероидных противовоспалительных средств гастропатий, позволяет максимально приблизить экспериментально смоделированный нефролитиаз к реальным клиническим условиям. После введения солей Mg происходила частичная нормализация показателей клиренса креатинина. Антилитогенное действие Mg связано с его способностью повышать рН мочи и увеличивать экскрецию цитрата, а также образовывать Mg оксалат, обладающий большей, чем кальция оксалат, растворимостью [7]. Кроме того, результаты настоящего исследования согласуются с данными наших предыдущих исследований, в ходе которых была показана высокая эффективность Mg L-аспарагината и его комбинации с пиридоксином при коррекции нефролитиаза, вызванного интоксикацией этиленгликолем [19].
Заключение. Таким образом, у животных, получавших на протяжении 28 дней натрия оксалат и целекоксиб, сформировался нефролитиаз, о чем свидетельствуют рост концентрации оксалатов в моче, выраженная кристаллурия, кальцификаты в мозговом, корковом веществе, собирательных трубочках, тенденция к снижению клиренса креатинина. В группах животных, которым вводили соли Mg и их комбинации с витамином В6, увеличение концентрации Mg в моче и эритроцитах сопровождалось снижением тяжести нефролитиаза, при этом наиболее эффективными были Магне В6 и Mg L-аспарагинат, так как данные соединения магния наилучшим образом препятствовали развитию нефролитиаза в условиях использованной экспериментальной модели этого заболевания.



