Введение
Несмотря на стремительное развитие и внедрение высокотехнологичных методов в урологическую практику, окончательно решить проблему диагностики и лечения больных органической обструкцией мочеточников до сих пор не удается [1]. Число таких пациентов продолжает расти. Прежде всего это связано с расширением показаний к операциям на органах брюшной полости, малого таза и забрюшинного пространства. В последние десятилетия ятрогенные повреждения мочеточников с последующим образованием рубцовых сужений обусловлены также широким использованием эндоскопических методов лечения. Как первичные, так и вторичные сужения мочеточников могут протекать бессимптомно и в конечном итоге приводить к выраженным функциональным и морфологическим изменениям со стороны верхних мочевыводящих путей и почек, при которых выполнение органосохраняющей операции уже не представляется возможным [2]. Рубцово-склеротические осложнения – это “цена адаптации” организма в ответ на воздействие раздражителя, сила которого превышает пределы нормы [3]. Обструкция лоханочно-мочеточникового сегмента является одной из наиболее частых причин развития гидронефротической трансформации. Данное заболевание встречается у 1% лиц в возрасте от 20 до 40 лет; у женщин в 1,5 раза чаще, чем у мужчин [4].
Помимо медленноразвивающегося органического сужения лоханочно-мочеточникового сегмента изнутри в патогенезе обструктивной уропатии важную роль играет экстрауретеральная и экстрапельвикальная экстравазация лоханочного содержимого. Вследствие окклюзивной дискинезии происходит пропитывание лоханочным содержимым клетчатки синуса с одновременным или последующим воспалением, терминальной стадией которого является выраженная пролиферация соединительнотканных элементов с развитием периуретерального склероза. Лоханочно-мочеточниковый сегмент, вовлеченный в муфтообразный склерозированный футляр, лишается адекватного кровоснабжения; ослабленная сократительная деятельность и постепенное препятствие оттоку мочи ведут к прогрессирующей дилатации лоханки и состоянию, именуемому калькулезным гидронефрозом [5]. Масса больных с врожденными и приобретенными стенозами, а также с облитерациями мочеточников, несвоевременная диагностика указанных состояний, не всегда успешные результаты реконструктивно-восстановительных операций на мочеточниках и проблема профилактики рубцово-склеротических осложнений заставляют постоянно совершенствовать известные и искать новые способы восстановления целостности верхних мочевыводящих путей [1]. Это в свою очередь позволит усовершенствовать тактику ведения данного контингента пациентов [3].
Целью исследования стала оценка терапевтической эффективности ферментной терапии лонгидазой® в комплексной профилактике рубцово-склеротических осложнений после операций на мочевыводящих путях и улучшение отдаленных результатов оперативного лечения больных, перенесших эти вмешательства.
Материалы и методы
Были обследованы 44 пациента: 28 женщин в возрасте от 18 до 73 лет (средний возраст – 37,5±0,5 года) и 16 мужчин в возрасте от 25 до 68 лет (средний возраст – 39,1±0,5 года). В первую подгруппу вошли 20 больных с врожденным гидронефрозом. По данным УЗИ пиелокаликоэктазия от 2 до 4 см наблюдалась у 7 (35%) пациентов, от 4 до 7 см – у 13 (65%). Вторую подгруппу составили 8 пациенток, перенесших акушерско-гинекологические операции, осложнением которых стало развитие уретерогидронефроза в сроки от 6 мес до 2 лет после оперативного вмешательства. Для 3 (37,5%) пациенток пиелокаликоэктазия составила от 2 до 4 см, для 5 (62,5%) – от 5 до 7 см. В третью подгруппу вошли 16 больных мочекаменной болезнью. Среди них расширение чашечно-лоханочной системы (ЧЛС) до 4 см было зарегистрировано у 11 (68,75%) пациентов, свыше 4 см – у 5 (31,25%).
Контрольную группу составили 36 пациентов: 24 женщины в возрасте от 20 до 73 лет (средний возраст – 36,5±0,5 года) и 12 мужчин в возрасте от 26 до 69 лет (средний возраст – 37,2±0,5 года), в анамнезе перенесшие оперативные вмешательства на верхних мочевыводящих путях. Из них 18 пациентов, включенных в первую подгруппу, были оперированы по поводу врожденного гидронефроза. По данным УЗИ пиелокаликоэктазия от 2 до 4 см наблюдалась у 8 (44,4%) пациентов, от 4 до 7 см — у 10 (55,6%). Четыре пациентки второй подгруппы оперированы по поводу гидронефроза, обусловленного ятроген-ным повреждением мочеточников при акушерскогинекологических вмешательствах. Степень пиелокаликоэктазии от 2 до 4 см установлена для 2 (50%) пациенток данной подгруппы, от 4 до 7 см – для 2 (50%). Четырнадцать пациентов, составивших третью подгруппу, подверглись оперативному лечению в связи с длительно стоящими конкрементами мочеточника. Пиелокаликоэктазия до 4 см имела место у 8 (57,1%) пациентов, от 4 до 7 см — у 6 (49,2%).
Обследование осуществлялось в сроки от 3 до 14 мес после перенесенной операции. Диагностика в первой и третьей подгруппах основной группы заключалась в сборе жалоб, анамнеза, объективном обследовании; выполнении обзорной, экскреторной урографии, УЗИ почек с допплеровским исследованием почечного кровотока на уровне сегментарных артерий [6]. Также проводились общеклинический, биохимический анализы крови; общеклинический анализ мочи, бактериологический анализ мочи с определением антибиотикограммы [7]. Второй подгруппе пациенток выполнены обзорная, экскреторная урография, УЗИ почек с допплерографией почечного кровотока в сегментарных артериях, акушерское и гинекологическое обследование; лабораторные исследования [8]. В качестве метода деривации мочи у больных 2-й подгруппы использована чрескожная пункционная нефростомия.
В дальнейшем всем пациентам основной группы выполнено оперативное лечение. Пациенты контрольной группы в анамнезе также подверглись оперативному лечению. Метод оперативного лечения в подгруппах пациентов был выбран в зависимости от этиологического фактора, данных инструментального и лабораторного обследования и определялся индивидуально в каждом наблюдении.
Дренирование почки после операции осуществле-но с помощью внутреннего стента сроком на 4 нед.
У 41 (93,2%) пациента основной и у 31 (91,6%) пациента контрольной групп интраоперационно выявлены педункулит и периуретерит, подтвержденные гистологически 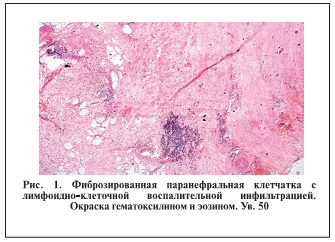 . Препараты окрашивали гематоксилином и эозином, заливку производили в целлоидин. Для фотографирования использовались видеокамера AxioVision Rel. 4.2 фирмы Карл Цейс, Германия; микроскоп Axioplan 2 imaging фирмы Карл Цейс, Германия.
. Препараты окрашивали гематоксилином и эозином, заливку производили в целлоидин. Для фотографирования использовались видеокамера AxioVision Rel. 4.2 фирмы Карл Цейс, Германия; микроскоп Axioplan 2 imaging фирмы Карл Цейс, Германия.
В пред- и послеоперационном периоде всем пациентам основной и контрольной групп проведена антибиотикопрофилактика препаратами группы фторхинолонов.
Со 2–3-х суток после операции 44 пациента основной группы получали курс наружной магнитно-лазерной терапии, положительное воздействие которой на пораженный орган опосредовано влиянием на микроциркуляцию, реологические свойства крови, проницаемость клеточных мембран сосудистой стенки, лимфоотток. На системном уровне воздействие низкоинтенсивного лазерного излучения проявляется сложным комплексом ответных реакций со стороны нервной, эндокринной, симпатико-адреналовой и иммунной систем с активацией нейрорефлекторных и нейрогуморальных реакций [9]. При этом магнитно-лазерная терапия оказывает противовоспалительное, противоотечное, десенсибилизирующее, иммуномодулирующее, спазмолитическое, анестезирующее, репаративное и антиоксидантное действия [10].
В своей работе мы использовали магнитно-инфракрасно-лазерный терапевтический аппарат РИКТА-01. Установка предназначена для неинвазивного терапевтического применения и обеспечивает одновременное проникающее воздействие узкополосного лазерного, широкополосного светодиодного инфра-красного диапазона в невидимый для глаза области спектра и красного видимого излучения, общей импульсной мощностью инфракрасного светодио-дного излучения не менее 120 мВт при постоянном магнитном поле (индукция) напряженностью от 25 до 35 мТл с частотой следования лазерных импульсов 1000 Гц. Лазеротерапия проводилась двумя полями на проекцию послеоперационной области. Время экспозиции – 10 мин [11]. Количество сеансов определялось индивидуально, в среднем составило 10.
Кроме этого через 2 нед после оперативного лечения всем 44 пациентам основной группы назначали ферментную терапию лонгидазой® 3000 МЕ по схеме: 10 инъекций внутримышечно 1 раз в 3 дня. Через 3 мес осуществлено контрольное обследование с выполнением экскреторной урографии, УЗИ почек с определением допплерографических показателей почечного кровотока. При сохранении расширения ЧЛС, повышенной систолической скорости кровотока и индекса резистивности (RI) в сегментарных артериях проведен повторный курс ферментной терапии лонгидазой® и магнитно-лазерной терапии. Пациентам контрольной группы активная профилактика послеоперационных рубцово-склеротических осложнений в послеоперационном периоде не проводилась, они получали только стандартную терапию.
Фармакологические эффекты лонгидазы®
Препарат обладает гиалуронидазной активностью пролонги-рованного действия, хелатирующими, антиоксидантными и умеренно выраженными противовоспалительными свойствами. Лонгидаза® уменьшает тяжесть течения острой фазы воспаления, регулирует синтез медиаторов воспаления, повышает гуморальный иммунный ответ и резистентность организма к инфекции. Выраженные противофиброзные свойства лонгидазы® обеспечиваются конъюгацией гиалуронидазы с физиологически активным высокомолекулярным носителем (сополимер N-оксида 1,4-этиленпиперазина и (N-карбоксиметил)-1,4-этиленпиперазиний бромида), что значительно увеличивает устойчивость фермента к денатурирующим воздействиям и действию ингибиторов; также носитель способен связывать освобождающиеся при гидролизе компоненты матрикса, ингибиторы фермента и стимуляторы синтеза коллагена. Специфическим субстратом тестикулярной гиалуронидазы являются гликозаминогликаны, составляющие основу матрикса соединительной ткани. В результате деполимеризации гликозаминогликаны изменяют свои основные свойства: снижается вязкость, уменьшается способность связывать воду, увеличивается эластичность соединительной ткани, что проявляется уменьшением отечности ткани, уплощением рубцов, уменьшением контрактур и предупреждением их формирования, уменьшением спаечного процесса. Биохимическими, иммунологическими, гистологическими и электронно-микроскопическими исследованиями доказано, что лонгидаза® не повреждает нормальную соединительную ткань, а вызывает деструкцию измененной по составу и структуре соединительной ткани в области фиброза.
Результаты и обсуждение
Оценка результатов лечения проводилась через 3, 6, 9 и 12 мес после оперативного вмешательства.
Допплерографическое исследование почечного кровотока обследованных больных основной и контрольной групп выявило, что скорость кровотока находилась в прямой зависимости от выраженности гидронефроза (степени пиелоэктазии) и длительности обструкции. Таким образом, для 15 больных основной и контрольной групп с врожденным гидронефрозом и степенью пиелоэктазии до 4 см систолическая скорость кровотока составила в среднем 53,67±0,20 см/с, RI – 0,67±0,12. Для 23 пациентов основной и контрольной групп с врожденным гидронефрозом и степенью пиелоэктазии свыше 4 см систолическая скорость кровотока составила 51,76±0,20 см/с, RI – 0,69±0,13. Показатели систолической скорости кровотока и RI 12 пациенток обеих групп с ятрогенными повреждениями мочеточников были близки к норме после отведения мочи из почки путем чрескожной пункционной нефростомии и составили 45,03±0,43 и 0,58±0,03 см/с соответственно. При исследовании почечного кровотока у 30 пациентов с мочекаменной болезнью выявлены следующие показатели: систолическая скорость кровотока 11 пациентов основной группы и 8 контрольной при степени пиелоэктазии до 4 см составила в среднем 59,67±0,20 см/с, а RI – 0,67±0,12. Длительность стояния конкремента составила от 1 до 3 мес. Систолическая скорость кровотока 5 пациентов основной и 6 контрольной групп с пиелоэктазией от 4 до 7 см достигла 60,12±0,11 см/с, RI – 0,68±0,14.
После начала ферментной терапии лонгидазой® у пациентов основной группы было отмечено прогрессивное снижение пиковой систолической скорости кровотока, которая в сроки до 6 мес снизилась примерно в 1,3 раза и достигла своего нормального значения в пределах 44,01±0,56 см/с (p<0,05), при этом RI приблизился к норме, уменьшившись в 1,2 раза, и составил 0,57±0,04 (p<0,05). В контрольной группе было отмечено менее интенсивное снижение исследуемых допплерографических показателей. Так, пиковая систолическая скорость кровотока в сроки до 12 мес с 60,76±0,20 см/с снизилась лишь до субнормальных значений 50,83±0,31 см/с, уменьшившись в 1,1 раза. Незначительное снижение RI у пациентов контрольной группы с 0,69±0,13 всего лишь до 0,64±0,01 также было отмечено за 12-месячный срок, что служит косвенным свидетельством имеющегося рубцово-склеротического процесса как в окружающей клетчатке, так и в стенке мочеточника в месте анастомоза.
При ультразвуковом мониторинге нами выявлены различия в степени пиелокаликоэктазии в основной и контрольной группах после оперативного вмешательства. В основной группе на фоне терапии лонгидазой® в сроки до 3 мес лишь у 3 (6,8%) пациентов было отмечено появление пиелокаликоэктазии до 3 см и у 1 (2,3%) – свыше 3 см, что потребовало повторной госпитализации. При этом в контрольной группе в сроки до 3 мес повторному лечению под-верглись 6 (16,7%) пациентов в связи с выявленной пиелоэктазией до 3 см и 5 (13,9%) больных зарегистрированной пиелоэктазией свыше 3 см.
В ранний послеоперационный период улучшение секреторно-эвакуаторной функции почки на стороне оперативного вмешательства наблюдалось у 38 (86,4%) пациентов, получавших лонгидазу®, в то время как в контрольной группе улучшение наступило лишь в 21 (58,3%) случае. При этом проходимость лоханочно-мочеточникового сегмента на стороне операции и сегмента мочеточника в зоне анастомоза была удовлетворительной у 40 (90,9%) пациентов основной группы, что подтверждалось данными экскреторной урографии – свободный пассаж контрастного вещества по верхним мочевыводящим путям.
Из 20 пациентов основной группы, оперированных по поводу врожденного гидронефроза, рубцово-склеротические осложнения в сроки до 3 мес после операции развились у 2 (10%) больных и через 6 мес – у 1 (5%). Из 8 пациентов основной группы, перенесших операции по поводу ятрогенных повреждений мочеточника, и 16 больных, оперированных по поводу мочекаменной болезни, склеротические изменения развились лишь в 12,5 и 6,25% наблюдениях соответственно в сроки до 3 мес, что потребовало повторной госпитализации и проведения повторного курса антисклеротической терапии. Через 6 мес после операции по поводу мочекаменной болезни 1 (6,25%) больному и через 9 мес после операции по поводу ятрогенного повреждения мочеточника 1 (12,5%) пациентке потребовался повторный курс ферментной терапии лонгидазой® в сочетании с магнитно-лазерной терапией, в то время как в контрольной группе повторная госпитализация потребовалась 13 (37,2%) больным. Через 12 мес после оперативного лечения у пациентов основной группы развития рубцово-склеротических осложнений не наблюдалось, а 8 (22,9%) больных контрольной группы нуждались в проведении повторного оперативного вмешательства в связи с формированием склеротических изменений.
Приводим клиническое наблюдение
Б о л ь н а я Н. 34 лет поступила в клинику урологии РУДН на базе ГКБ № 29 с жалобами на тянущие боли в поясничной области справа. При обследовании выявлены гидронефроз справа (толщина паренхимы правой почки – 1,3 см, дилатация лоханки справа – до 7 см, чашечек – до 5 см; выявлен добавочный сосуд, идущий к нижнему сегменту правой почки), умеренное расширение ЧЛС слева (лоханка – 2,8 см, толщина паренхимы левой почки – 1,4 см). Пиковая систолическая скорость кровотока на уровне сегментарных артерий правой почки – 58,76 см/с, RI – 0,65; в левой почке – 50,81 см/с и 0,64 соответственно. По данным экскреторной урографии выделение контрастного вещества левой почкой своевременное, удовлетворительное, справа несколько замедлено. Слева определяется умеренное расширение ЧЛС. На отсроченном снимке отмечено значительное расширение ЧЛС справа 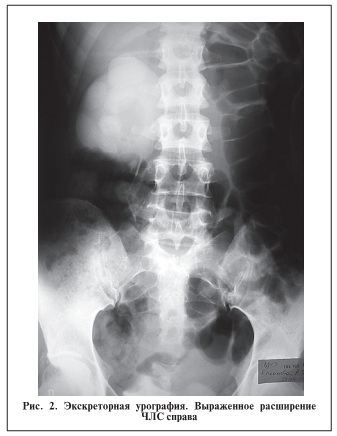 . Пассаж контрастного вещества по верхним мочевыводящим путям сохранен с обеих сторон. В июле 2012 г. выполнена операция: антевазальная пластика лоханочно-мочеточникового сегмента по Хайнсу—Андерсену, дренирование почки (установка уретерального стента). Интраоперационно были выявлены педункулит и периуретерит, подтвержденные гистологически
. Пассаж контрастного вещества по верхним мочевыводящим путям сохранен с обеих сторон. В июле 2012 г. выполнена операция: антевазальная пластика лоханочно-мочеточникового сегмента по Хайнсу—Андерсену, дренирование почки (установка уретерального стента). Интраоперационно были выявлены педункулит и периуретерит, подтвержденные гистологически 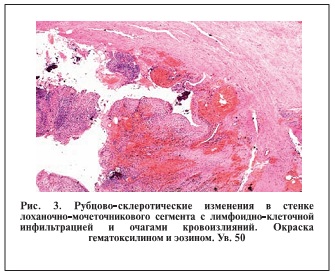 .
.
В пред- и послеоперационном периоде пациентке проведена антибактериальная терапия препаратами группы фторхинолонов, со 2-х суток послеоперационного периода выполнена магнитно-лазерная терапия на область послеоперационной раны (10 сеансов). Через 2 нед после оперативного лечения пациентка получала лонгидазу® по вышеописанной схеме. При контрольном обследовании через 3 мес показатели биохимического анализа крови в пределах нормы, бактериологический анализ мочи микрофлоры не выявил. По данным УЗИ почек отмечено незначительное расширение ЧЛС справа, толщина паренхимы правой почки – 1,4 см, ЧЛС левой почки не расширена, толщина паренхимы слева – 1,5 см. Систолическая скорость кровотока на уровне сегментарных артерий правой почки и RI приблизились к нормальным показателям и составили 46,02 и 0,57 см/с соответственно. В левой почке систолическая скорость кровотока снизилась до 45,01 см/с, RI – до 0,56. По данным экскреторной урографии выделение контрастного вещества своевременное, удовлетворительное с обеих сторон. ЧЛС правой почки незначительно расширена, левой — не расширена. Пассаж контрастного вещества по верхним мочевыводящим путям не нарушен с обеих сторон 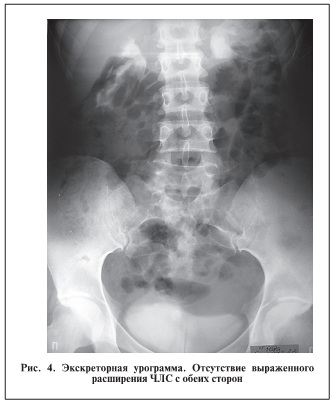 .
.
Следующее контрольное обследование пациентки запланировано на февраль 2013 г.
Заключение
Таким образом, результаты проведенного исследования свидетельствуют о высокой клинической эффективности ферментной терапии препаратом лонгидаза® 3000 МЕ в комбинации с магнитно-лазерной терапией в комплексной профилактике рубцово-склеротических осложнений после операций на мочевыводящих путях. Данный комплекс профилактических мероприятий позволяет улучшить результаты лечения больных и может с успехом применяться в клинической практике.


