Введение. Силодозин является антагонистом α1A-адренорецепторов с различной селективностью в отношении подтипов α1-адренорецепторов (соотношение уровней связывания с подтипами адренорецепторов α1A и α1В составляет 162:1) [1]. Силодозин зарегистрирован для лечения аденомы предстательной железы (АПЖ) в Европе, США и Японии. Как и для многих других лекарственных препаратов, рекомендованные дозировки в Европе и США отличаются от таковых в Японии. В Европе и США препарат назначают в виде капсул 8 мг 1 раз в день (стартовая доза для пациентов с нарушением функции почек средней степени составляет 1 капсулу 4 мг); в Японии препарат назначают в виде капсул 2 или 4 мг 2 раза в день.
Клиническая фармакология
Значение селективности силодозина в отношении α1A-адренорецепторов
В функциональном отношении подтипы α1-адренорецепторов существенно отличаются: α1A-рецепторы играют главную роль в обеспечении сокращения предстательной железы (уретра человека содержит только α1A-адренорецепторы) [2, 3], в то время как α1B-адренорецепторами опосредована дилатация кровеносных сосудов [4]. Соответственно, высокая селективность силодозина в отношении рецепторов подтипа α1A обеспечивает лучшую его переносимость с точки зрения
нежелательных эффектов со стороны сердечно-сосудистой системы без потери эффективности в отношении облегчения расстройств мочеиспускания по сравнению с другими препаратами этой группы, обладающими меньшей селективностью к α1-адренорецепторам. Действительно, в моделях на животных и в исследованиях на здоровых добровольцах документально зафиксировано, что воздействие силодозина на сердечно-сосудистую систему весьма незначительно. В исследовании на собаках, которые получали силодозин внутрь однократно в дозе, в 200 раз превосходящейстандартную терапевтическую дозировку для человека, продемонстрировано умеренное влияние на уровень артериального давления и отсутствие влияния на реполяризацию сердца [5]. В исследовании на здоровых добровольцах, которые получали силодозин в дозе, в 3 раза
превышающей стандартную терапевтическую (24 мг/сут), не было отмечено влияния на частоту сердечных сокращений, пульс и длительность интервала QRS [6].
Фармакокинетика
Фармакокинетический профиль силодозина позволяет принимать его 1 раз в день. Корректировка стандартного режима дозирования требуется лишь пациентам с умеренным нарушением функции почек. Силодозин хорошо всасывается из желудочно-кишечного тракта. Пиковая концентрация в плазме (Cmax) и площадь под кривой (AUC) зависимости концентрации в плазме от времени увеличиваются линейно с увеличение дозы [7]. Абсолютная биодоступность составляет около 32%
[8]. Прием пищи замедляет время достижения Cmax приблизительно на 1 ч, не влияя при этом на AUC. Эта особенность дает возможность рекомендовать прием силодозина вместе с пищей, оптимально – во время завтрака, что позволяет избегать пиковых значений концентрации в плазме, которые потенциально могут способствовать появлению нежелательных эффектов [7–9].
Силодозин метаболизируется глюкуронированием с помощью алкогольдегидрогеназы, альдегидегидрогеназы и окислительных путей с участием системы CYP3A4. Основным продуктом метаболизма в плазме является активный метаболит глюкуронидконъюгат, концентрация которого достигает значений, в 3–4 раза превышающих таковую исходного соединения. Периоды полувыведения силодозина и глюкуронидконъюгата составляют около 11 и 18 ч соответственно, что обеспечивает кратность приема 1 раз в сутки [8–10].
В исследованиях на популяциях пациентов установлено, что в зависимости от возраста фармакокинетический профиль силодозина существенно не меняется, клиренс силодозина не уменьшается (даже для пациентов старше 85 лет) [11]. В связи с этим стандартную дозу (1 капсула 8 мг) можно назначать даже пожилым пациентам, что является важным фактором, так как
распространенность АПЖ увеличивается с возрастом. Корректировка режима дозирования не является проблемой для пациентов с умеренным нарушением функции почек или незначительным и умеренным нарушением функции печени. Начальная доза для пациентов с умеренным нарушением функции почек составляет 1 капсулу 4 мг ежедневно, через неделю дозу можно повысить. Не рекомендуют назначать силодозин пациентам с выраженным нарушением функции почек или печени [8].
Фармакологическое взаимодействие
Силодозин можно назначать вместе с другими, обычно используемыми пациентами с АПЖ, лекарственными препаратами, например ингибиторами фосфодиэстеразы 5-го типа (ФДЭ-5) и антигипертензивными препаратами, при условии, что у пациентов отслеживают появление нежелательных реакций [8]. В плацебоконтролируемом открытом перекрестном испытании на
22 здоровых добровольцах в возрасте 45–78 лет, которые принимали 8 мг силодозина в сутки на протяжении 21 дня, при ортостатическом тесте показано минимальное снижение систолического и/или диастолического давления после совместного назначения силодозина с ингибиторами ФДЭ-5 (силденафил 100 мг или тадалафил 20 мг) [12].
У 7 (1,4%) из 500 пациентов с артериальной гипертензией, участвовавших в клиническом исследовании III фазы, отмечены эпизоды ортостатической гипотензии. Они принимали различные антигипертензивные препараты: ингибиторы АПФ (24%), β-адреноблокаторы (13%), антагонисты кальция (8,7%) и диуретики (7,5%). Частота возникновения ортостатической гипотензии
была сопоставимой с таковой у 1081 пациента, не принимавшего гипотензивных препаратов, – 13 (1,2%). Не рекомендуют принимать силодозин пациентам, получающим ингибиторы CYP3A4, например кетоконазол и соединения анти-ВИЧ-протеаз, так как пути метаболизма этих препаратов задействованы в метаболизме силодозина [8].
Не рекомендуют принимать силодозин пациентам, получающим ингибиторы CYP3A4, например кетоконазол и соединения анти-ВИЧ-протеаз, так как пути метаболизма этих препаратов задействованы в метаболизме силодозина [8].
Эффективность
В плацебо-контролируемом 6-недельном исследовании, посвященном подбору дозы силодозина,
было показано, что прием 8 мг 1 раз в день способствовал более существенному улучшению состояния,
оцениваемому по шкале симптомов мочеиспускания Американской урологической ассоциации (-6,8±5,8
балла; n=90), чем прием 4 мг 1 раз в день (-5,7±5,5 балла; n=88) или плацебо (-4,0±5,5 балла; n=86)[1]. В последующем было проведено 3 больших двойных слепых рандомизированных клинических исследования III фазы с выбранным режимом дозирования (8 мг 1 раз в день) с участием более 800 пациентов [8]. Целью двух плацебо-контролируемых двойных слепых испытаний, проведенных в США, была демонстрация преимуществ силодозина по сравнению с плацебо. В европейском плацебо-контролируемом двойном слепом исследовании демонстрировали преимущества по сравнению с плацебо и сопоставимую эффективность силодозина по сравнению с активным препаратом
сравнения (тамсулозин 0,4 мг 1 раз в день). Пациенты были рандомизированы в группы плацебо и активного 12-недельного лечения после 4-недельного вводного периода приема плацебо. Рандомизацию осуществляли в отношении 1:1 в США и 2:2:1 (1 – в группу плацебо) в европейском исследовании.
Основные критерии включения во все эти исследования были одинаковыми: оценка по Международной
шкале симптомов заболеваний простаты IPSS 13 и более баллов, максимальная скорость потока мочи (Qmax) – 4–15 мл/с, минимальный объем остаточной мочи – 125 мл и более. Три клинических испытания имели общую конечную точку: изменение суммы баллов по шкале IPSS по сравнению с исходными значениями. В качестве вторичных конечных точек выступали изменения по вопросам шкалы IPSS, связанным с симптомами накопления и опорожнения, в дополнение к уровню ответа на лечение (который определяли только в европейском исследовании как число пациентов, достигших улучшения на 25% и более общей суммы баллов по шкале IPSS по сравнению с исходными значениями) и Qmax.
Во всех трех исследованиях силодозин существенно превосходил плацебо по своему влиянию на симптомы, оцениваемые по шкале IPSS (по всем симптомам p<0,001). Средняя разница суммы баллов по шкале IPSS по сравнению с плацебо всегда была клинически значимой с колебаниями от 2,3 до 2,9 балла (табл. 1) [8]. При анализе по симптомам накопления и опорожнения результаты тоже были одинаковыми, наблюдалась тенденция к большей эффективности в отношении симптомов опорожнения. Улучшение по сравнению с плацебо по вопросам, связанных с симптомами накопления, составило -0,9 (95% ДИ; -1,4; -0,4) и 1,0 (95% ДИ; -1,5; -0,6) в двух исследованиях в США (в обоих p<0,001) [13] и до -0,7 (95% ДИ; -1,1; -0,2) в европейском исследовании (p=0,002) [14]; улучшение по сравнению с плацебо по выраженности симптомов опорожнения было -1,9 (95% ДИ; -2,6; -1,2) и -1,8 (95% ДИ; -2,5; -1,1) в исследованиях в США и -1,7 (95% ДИ; -2,2; -1,1) в европейском исследовании (везде p<0,001). Уровень ответа в группах силодозина был существенно выше по сравнению с плацебо: 52,8 и 53,6% пациентов отвечали на лечение силодозином против 31,6 и 32,8% в группе
плацебо соответственно в двух исследованиях в США (по всем симптомам p<0,0001). В европейском исследовании уровень ответа был 68% в группе силодозина и 53% в группе плацебо (p<0,001) [14].
Таблица 1. Результаты оценки по шкале IPSS в двух основных клинических испытаниях III фазы.
В европейском исследовании силодозин оказался несколько эффективнее тамсулозина в отношении снижения общего балла по шкале IPSS за счет и подшкалы накопления (-0,7 против -0,6), и подшкалы опорожнения (-1,7 против -1,4) [14]. Следует принимать во внимание, что это исследование было разработано для демонстрации преимуществ по сравнению с плацебо и не меньшей эффективности по сравнению с тамсулозином; в отсутствие предварительного прямого сравнения выявление преимуществ над тамсулозином не было задачей исследования. Частота ответа на лечение составила 68% в группе силодозина и 65% в группе тамсулозина, что выше, чем 53% в группе плацебо (p<0,001 для силодозина и p=0,005 для тамсулозина) [14].
Измерение Qmax после приема первой дозы силодозина в исследованиях, проведенных в США, показало, что его действие наступает уже через 2–6 ч, а определение суммы баллов по шкале IPSS во время первой недели после начала лечения продемонстрировало, что изменение общего показателя IPSS по сравнению с исходным наступает через 3–4 дня [13]. Всего 661 пациент в США и 500 – в Европе продолжили участие в открытом долговременном исследовании на протяжении 12 мес.
Пациенты, получавшие ранее плацебо, отметили большее снижение общего балла по шкале IPSS (-4,5; -6,7) по сравнению с пациентами, получавшими силодозин, у которых сохранялась прежняя динамика улучшения (-1,6; -6,0) [15].
Были проведены эксплоративные post-hoc-анализы для оценки эффективности силодозина в зависимости от выраженности симптомов (“средние” или “выраженные” соответственно при оценке по шкале IPSS менее 20 или 20 и более баллов) и ноктурии (в свете потенциальных осложнений этого симптома, например обморока). В дополнение оценивали число пациентов (в процентах), отметивших сравнительное улучшение по трем наиболее беспокоящим симптомам: неполное опорожнение мочевого пузыря, учащенное мочеиспускание, ноктурия. Эти симптомы в действительности можно рассматривать как взаимосвязанные. Ощущение неполного опорожнения мочевого пузыря указывает на то, что выделено малое количество мочи, соответственно, пациент вынужден мочиться чаще, чтобы опорожнить свой мочевой пузырь (учащенное мочеиспускание) и вставать для этого ночью (ноктурия).
Результаты были одинаковыми, несмотря на разную выраженность симптомов. Силодозин оказался гораздо эффективнее плацебо в снижении как умеренных, так и выраженных симптомов АПЖ, что было продемонстрировано во всех трех исследованиях (p<0,001). Тамсулозин также был эффективнее, чем плацебо (p<0,01), в обеих подгруппах наблюдали небольшое превосходство силодозина по сравнению с тамсулозином (среднее различие изменений общего балла по шкале IPSS против плацебо: умеренные симптомы – -0,4; выраженные симптомы – -0,3). После объединения баз данных трех исследований было выявлено, что среднее количество эпизодов ноктурии значимо снижалось на 0,2 за ночь (95% ДИ; -0,3, -0,1; p<0,001); также доля пациентов, которые отметили улучшение, была значимо выше в группе силодозина (53,4 против 42,8%; p<0,001). Эти данные были одинаковыми в подгруппе пациентов, которые отмечали 2 и более эпизодов ноктурии при определении исходных
параметров: среднее различие в баллах между видами лечения было -0,2 (95% ДИ; -0,3; 0,1; p<0,001), коэффициент улучшения составил 60,6% в группе силодозина против 48,7% в группе плацебо (p<0,0001). В европейском исследовании доля пациентов, включенных в исследование и отметивших уменьшение количества эпизодов ноктурии в среднем минимум на 1 по сравнению с исходными значениями, была существенно выше в группе силодозина, чем в группе плацебо (59 против 45%; p=0,01), в то время как различия между группами тамсулозина и плацебо были не так существенны (54 и 45% соответственно). В подгруппе пациентов, отметивших минимум 2 эпизода мочеиспускания ночью, наблюдали сходные результаты (силодозин – 67%, тамсулозин – 63%, плацебо – 55%; p<0,05 только для силодозина против плацебо; рис. 1).
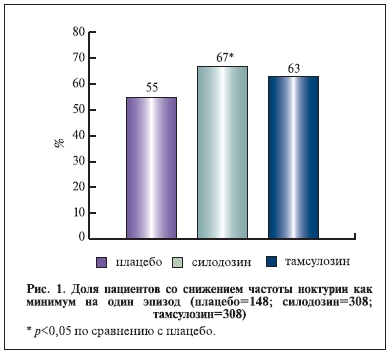
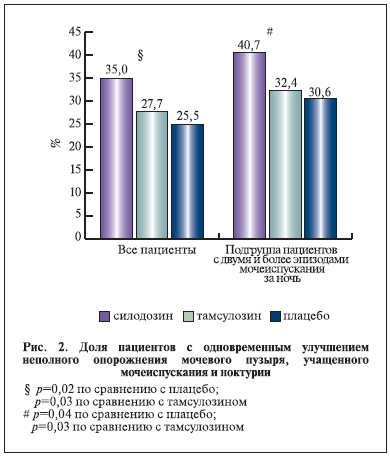
В объединенной базе данных доля пациентов с улучшением в отношении трех наиболее беспокоящих симптомов нарушенного мочеиспускания (неполное опорожнение мочевого пузыря, учащенное мочеиспускание и ноктурия) была гораздо выше в группе силодозина по сравнению с плацебо (30,5 против 20,2%; p<0,0001) и в подгруппе пациентов, которые изначально отмечали 2 и более эпизодов мочеиспускания за ночь (34,9 против 23,2%; p<0,0001).
В европейском исследовании доля таких пациентов была значимо выше в группе силодозина по сравнению с тамсулозином (p=0,03) и плацебо (p=0,02; рис. 2) [1].
Безопасность
Всего 1581 пациент длительное время получал силодозин в дозе 8 мг 1 раз в день. Из них 961 (62,4%) принимал препарат в течение 6 мес и 384 (24,9%) – на протяжении 12 мес [8]. В плацебо-контролируемых исследованиях нежелательные реакции, связанные с приемом препарата, отметили 28,8% пациентов, которые получали силодозин, и 9% пациентов группы плацебо. В целом одно или несколько нежелательных реакций отметили 31,8% пациентов, принимавших силодозин (табл. 2).
Таблица 2. Профиль безопасности силодозина.
Существуют отдельные сообщения об интраоперационном синдроме “дряблой” радужки (ИСДР), который заключается в сокращении зрачка, дряблости и деформации стромы радужки с тенденцией к пролапсу радужки во время оперативного вмешательства по поводу катаракты, но этот синдром характерен для всех α-адреноблокаторов, особенно для тамсулозина. Указанный синдром связан с расслаблением мышцы – дилататора зрачка [20]. Несколько случаев ИСДР наблюдали в Японии, один случай имел место в открытом исследовании в США до того, как исследователь был предупрежден о риске такой нежелательной реакции. После того как пациентов стали предупреждать о возможности
развития ИСДР, в Европе он зарегистрирован не был.
Выводы
Силодозин – это новейший α1-адреноблокатор, высокоселективный в отношении α1A-адренорецепторов, которые отвечают за сократимость мышечных структур простаты и уретры. Режим дозирования 8 мг 1 раз в день более эффективен по сравнению с плацебо в контролировании расстройств мочеиспускания и не менее эффективен по сравнению с тамсулозином. Кроме того,
силодозин существенно более эффективен в отношении одновременного улучшения наиболее часто беспокоящих симптомов (неполного опорожнения мочевого пузыря, учащенного мочеиспускания, ноктурии). При длительном применении (на протяжении 1 года) силодозин безопасен и хорошо переносится больными. Уроселективность силодозина обеспечивает минимальное количество нежелательных реакций со стороны сердечно-сосудистой системы. Наиболее частым побочным
эффектом силодозина является анэякуляция, которая, однако, для подавляющего большинства пациентов не служит причиной отказа от приема препарата. ИСДР, характерный для препаратов этого класса, встречается редко и его можно избежать, предупредив пациента, чтобы он сообщил о лечении α1-адреноблокаторами своему офтальмологу.
2010 Европейская ассоциация урологов. Опубликовано Elsevier B.V. Все права защищены.



