Введение. Вопросы профилактики острой задержки мочеиспускания (ОЗМ) после оперативных вмешательств крайне актуальны не только для урологов, но и для хирургов, поскольку данное состояние является довольно частым осложнением оперативных вмешательств. По данным разных авторов, ишурия возникает у 3,8–25% мужчин, оперированных на органах брюшной полости [1, 2], а после операций на прямой кишке ее частота достигает 44,5% [3].
Только у 44% пациентов однократная катетеризация мочевого пузыря приводит к восстановлению самостоятельного мочеиспускания [4]. При этом следует отметить, что сам процесс катетеризации инвазивен и может повлечь за собой ряд дополнительных осложнений, в том числе инфекционных. Так, многократное проведение катетера по уретре, а также дренирование мочевого пузыря постоянным катетером обусловливают развитие инфекционных осложнений у 70% пациентов.
У 17% пациентов в отдаленном периоде формируется стриктура уретры [5].
К сожалению, ишурия – это не только местный процесс, заключающийся в развитии препятствия для мочеиспускания. При возникновении ОЗМ в организме больного возникают серьезные изменения, связанные с нарушением функции различных органов и систем. Часто задержке сопутствует пузырно-мочеточниковый рефлюкс, что увеличивает риск возникновения острого пиелонефрита, повышается артериальное давление [6], возможно развитие сердечной недостаточности, происходят патологические сдвиги в свертывающей и противосвертывающей системе крови. В связи с этим состояние больного после оперативного вмешательства на фоне ОЗМ может усугубиться развитием как геморрагических, так и тромбоэмболических осложнений [7, 8]. Вследствие вышеперечисленных нарушений возникновение ОЗМ существенно влияет на течение послеоперационного периода и ухудшает результаты оперативного лечения больных. В современных условиях это приводит к увеличению стоимости лечения наряду с более длительной реабилитацией пациентов [9].
К сожалению, отсутствие единой программы профилактики послеоперационной задержки мочеиспускания способствует тому, что в течение нескольких десятков лет частота послеоперационной задержки мочеиспускания не уменьшается.
В нашей клинике была проведена работа, посвященная в том числе и изучению патогенеза ОЗМ [10]. В результате исследований были выделены две особенности, характерные для пациентов, страдающих ишурией: повышение внутриуретрального давления в простатическом отделе уретры и значительная гипотония детрузора. Таким образом, в основе патогенеза ОЗМ лежит сочетание спастического сокращения гладкой мускулатуры простатического отдела уретры и снижение детрузорного давления. Применительно к послеоперационной ишурии патогенез выглядит следующим образом. Являясь стрессом, хирургическое вмешательство сопровождается повышением тонуса симпатической нервной системы, увеличением выброса катехоламинов, вследствие чего возрастает стимуляция α1-адренорецепторов задней уретры и предстательной железы. Это может приводить к возникновению послеоперационной ишурии при сочетании еще с одним фактором патогенеза, наблюдаемым в наших исследованиях у всех пациентов, –гипотонией детрузора. Все это в сочетании с гипотонией детрузора, который мы наблюдаем у всех наших пациентов, может способствовать послеоперационной ишурии. Вследствие снижения давления в мочевом пузыре становится невозможным сокращение детрузора [11]. Причиной данных изменений может быть как обычное переполнение мочевого пузыря, так и прием холинолитиков, наркотических средств, некоторых обезболивающих препаратов, которые снижают чувствительность рецепторов мочевого пузыря, результатом которого является увеличение его физиологического и абсолютного объема. Выявление патофизиологических механизмов ишурии позволило задуматься о мерах профилактики этого грозного осложнения. Ввиду избыточной стимуляции α1-адренорецепторов резонно было предположить, что для профилактики ишурии может оказаться эффективным применение α1-адреноблокаторов. Во-первых, влияние этих препаратов на динамический компонент инфравезикальной обструкции известно давно и сомнений не вызывает [12, 13]. Во-вторых, исследования О. Б. Лорана и соавт. продемонстрировали улучшение адаптации волокон детрузора к процессу перерастяжения, а также нормализации биоэнергетики его гладкомышечных структур. Данные изменения происходят в связи с улучшением кровотока и уменьшением гипоксии детрузора под действием этих препаратов [14].
Материалы и методы. Для оценки эффективности, безопасности и экономической целесообразности сотрудниками клиники урологии Первого МГМУ им. И. М. Сеченова было проведено исследование, в котором приняли участие 180 больных, 86 из них в пред- и послеоперационном периоде получали α1-адреноблокаторы (основная группа), а 94 больных – плацебо (контрольная группа) [10, 15].

Все больные были оперированы в факультетской хирургической клинике им. Н. Н. Бурденко Первого МГМУ и урологической клинике Первого МГМУ. Сведения о выполненных вмешательствах представлены в табл. 1.
Возраст больных в обеих группах был примерно одинаковым и составил в среднем 62,8 (45–85) года в основной группе и 60,6 (50–82) – в контрольной (табл. 2).
Все больные в предоперационном периоде были осмотрены урологом. Для систематизации симптомов расстройств мочеиспускания использованы анкеты I-PSS и QoL. В предоперационном периоде всем больным дважды выполняли урофлоуметрию при разном наполнении мочевого пузыря, а также УЗИ предстательной железы, мочевого пузыря с определением объема остаточной мочи. Всем больным, включенным в исследование, рекомендовали раннее вставание, а перед операцией тренировали мочиться лежа.
Ранее ОЗМ возникала у 3 больных основной группы, и ранее регистрировалась послеоперационная ишурия. Среди них у 1 дважды (после резекции печени и грыжесечения), у 2 других однократно (после бронхоскопии и операции на печени соответственно). Ни у одного из пациентов контрольной группы ОЗМ не возникала.
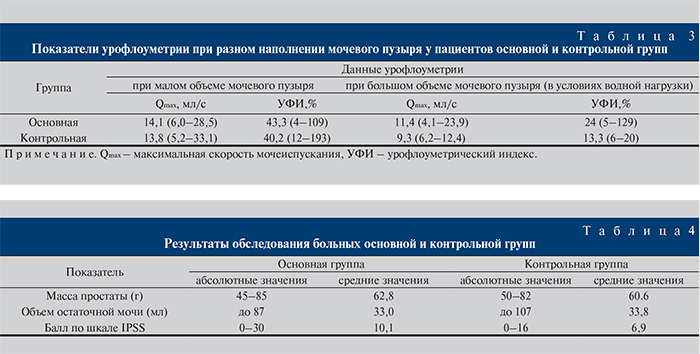
Показатели мочеиспускания в обеих группах были примерно одинаковыми (табл. 3).
У 65 (75,6%) пациентов основной группы диагностирована доброкачественная гиперплазия предстательной железы (ДГПЖ) либо рак простаты.
По показателям массы предстательной железы, объема остаточной мочи и суммы баллов по шкале I-PSS группы также были сопоставимыми (табл. 4).

Таким образом, эти группы были сравнимы по возрасту, характеру выполненных оперативных вмешательств, количеству пациентов, страдавших ДГПЖ (или раком простаты), параметрам мочеиспускания, весу простаты, объему остаточной мочи.
Установленная для тамсулозина способность на 5-й день курсового приема увеличивать концентрацию активного вещества в плазме крови на 60–70% больше, чем после однократного приема препарата, а также данные А. В. Сивкова и соавт. [16] об уменьшении симптоматики более чем на 30% у 92,3% пациентов, принимавших тамсулозин 5 дней, обусловили сроки предоперационной терапии. Заканчивать прием α1-адреноблокаторов сразу после выполнения операции мы считали преждевременным, так как, являясь стрессом, оперативное вмешательство обусловливает выброс катехоламинов, которые, воздействуя на адренорецепторы пузырно-уретрального сегмента, могут способствовать возникновению ишурии. Таким образом, оптимальный срок терапии α1-адреноблокаторами был определен нами как 5 дней до операции и 3 дня после нее.
Тамсулозин, учтя его незначительное влияние на сердечно-сосудистую систему и, следовательно, более редкое, чем при приеме других α-адреноблокаторов, возникновение побочных эффектов, мы рекомендовали принимать с начала курса по 0,4 мг в сутки.
Учтя данные о побочных эффектах, возникающих при высокой стартовой дозе неселективных α1-адреноблокаторов, в частности доксазозина, мы рекомендовали больным начинать прием этого препарата с 2 мг в сутки с постепенным возрастанием дозы на 3-й день до 4 мг, сохраняя данную дозировку до окончания курса. Кроме того, с той же целью мы рекомендовали пациентам принимать данное лекарство на ночь – перед сном.
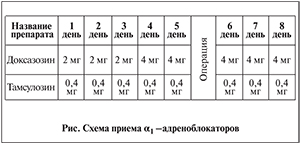 Тамсулозин в течение всего курса приема назначали по 0,4 мг в сутки. Схема приема препаратов представлена на рисунке.
Тамсулозин в течение всего курса приема назначали по 0,4 мг в сутки. Схема приема препаратов представлена на рисунке.
Результаты. Все пациенты в целом отметили хорошую переносимость α1-адреноблокаторов. Лишь у 1 пациента в ответ на прием доксазозина была отмечена выраженная артериальная гипотония, препарат был отменен, и больной выбыл из исследования. Кроме того, анестезиологи и хирурги, проводившие операции, не отметили каких-либо трудностей, которые можно было связать с приемом α1-адреноблокаторов.
В послеоперационном периоде ишурия зарегистрирована у 2 пациентов основной группы, что составило 2,3%. Это были больной, перенесший резекцию почки по поводу мультилокулярной кисты, а также пациент, оперированный по поводу косой паховой грыжи. В контрольной группе ишурия возникла у 16 пациентов, что составило 17%. Из них 3 больным были выполнены комбинированные операции, 3 – операции на почках, надпочечнике и верхних мочевых путях, по 2 пациента перенесли операции на сосудах, ампутации бедра и вмешательства на желчном пузыре и печени, по 1 – операции по поводу грыж передней брюшной стенки, на легких и на околоушной железе.
У обоих пациентов основной группы мочеиспускание восстановилось после однократной катетеризации мочевого пузыря, в то время как в контрольной группе самостоятельное мочеиспускание после подобной процедуры возобновилось лишь у 4 (25%) пациентов. Еще 3 (18,75%) понадобилась двукратная катетеризация, 5 (31,25%) – дренирование мочевого пузыря постоянным катетером 4–24 сут. В отношении 4 (25%) больных подобные мероприятия не привели к восстановлению мочеиспускания, им была выполнена цистостомия.
Не менее важным аспектом профилактики служит его экономическая составляющая. Курс терапии α1-адреноблокаторами на 8-й дней (5 дней до операции и 3 дня после нее) составил 182 руб. в среднем на человека.
Общее количество затрат на профилактику ишурии для 86 пациентов составило 15 600 руб. Послеоперационная ишурия зарегистрирована у 2 больных. Мочеиспускание восстановилось у обоих мужчин после однократной катетеризации, что потребовало дополнительных затрат в размере 900 руб. Таким образом в группе пациентов, получавших альфа-1-адреноблокаторы, экономические затраты составили всего 16 500 руб., или 191,8 руб. на человека, – это общая сумма затрат на профилактику ОЗМ в этой группе. В контрольной группе денежные средства на профилактику послеоперационной ишурии не использовались. Однако задержка мочеиспускания была отмечена у 16 пациентов, которым потребовался значительно больший комплекс мероприятий по борьбе с данным осложнением, включивший дренирование мочевого пузыря, антибактериальную и противовоспалительную терапию, цистометрии, ультразвуковые исследования. Четверым пациентам потребовалась цистостомия. В итоге суммарные расходы на обследование и лечение пациентов контрольной группы составили примерно 112 450 руб. (без учета стоимости аденомэктомии, последующей за цистостомией у одного пациента, и лечения абсцесса простаты у другого больного). В среднем стоимость затрат на устранение последствий ОЗМ в контрольной группе с среднем составило 1196 руб.
Обсуждение результатов. Таким образом, применение α1-адреноблокаторов в пред- и послеоперационном периодах позволяет существенно снизить риск возникновения послеоперационной ишурии, способствует восстановлению мочеиспускания после однократной катетеризации больных, у которых возникла задержка мочеиспускания. Применение α1-адреноблокаторов улучшает течение послеоперационного периода и способствует скорейшему выздоровлению пациентов.
Фармакоэкономический анализ выявил, что применение α1-адреноблокаторов в пред- и послеоперационном периодах позволяет существенно (более чем в 6 раз) снижать затраты на лечение больных в среднем на одного пациента. Уменьшение расходов при профилактике задержки мочеиспускания связано со снижением частоты развития послеоперационной ишурии, а следовательно, с уменьшением расхода средств на восстановление мочеиспускания (в том числе на оперативные вмешательства), а также на ликвидацию инфекционных осложнений, возникших вследствие дренирования мочевого пузыря [17].
В отношении безопасности применения данной профилактической терапии следует заметить, что имеющийся в распоряжении врачей тамсулозин с орально контролируемой формой абсорбции, возможно, наиболее предпочтителен для профилактического приема с целью предотвращения возможного развития острой задержки мочи. Лекарственная форма тамсулозина ОКАС (OCAS – oral controlled absorption system) позволяет создавать в плазме крови равномерную концентрацию действующего вещества, что обусловлено возможностью высвобождения тамсулозина из таблетки на протяжении всего желудочно-кишечного тракта вне зависимости от приема пищи и содержания жидкости в просвете кишечника.
ОКАС – это запатентованная технология модифицированного высвобождения лекарственного вещества, содержащая в основе гелевый матрикс, включая гелеобразующий и гелеусиливающий компоненты. Форма ОКАС обеспечивает равномерное высвобождение действующего вещества вне зависимости от физиологических параметров, связанных с приемом пищи: pH среды, концентрации пищеварительных ферментов и др. Степень высвобождения тамсулозина в различных условиях (в средах с различным содержанием соляной кислоты, фосфатного буфера, воды) была изучена in vitro и впоследствии подтверждена in vivo, на основании чего было сделано заключение, согласно которму фармакокинетика препарата не зависит от приема пищи [18].
Фармакокинетический профиль лекарственной формы ОКАС в клинической практике обеспечивает как удобство применения (в любое время суток вне зависимости от приема пищи), так и улучшенный профиль безопасности. Так, на фоне приема Омника ОКАС по сравнению с тамсулозином в традиционных лекарственных формах констатировали значительно меньше побочных эффектов, в частности, со стороны сердечно-сосудистой системы [18]. Удобство и безопасность терапии в свою очередь определяют высокую комплаентность пациентов к лечению симптомов нижних мочевых путей на фоне ДГПЖ.
В клинической практике использование формы ОКАС позволит пролонгировать лечебный эффект (независимо от времени приема и приема пищи) и значительно снизить частоту побочных эффектов.
Исходя из вышеперечисленного, для пациента и врача наиболее эффективна, удобна и безопасна пери- и постоперационная профилактика ОЗМ уроселективным препаратом тамсулозин с системой контролируемого высвобождения ОКАС.
Полученные данные позволяют нам рекомендовать α1-адреноблокаторы как эффективное средство для снижения частоты послеоперационной ишурии, а также с позиции снижения затрат на лечение больных, подвергающихся оперативному вмешательству на органах брюшной и грудной полости, верхних мочевых путях и сосудах нижних конечностей.



