Введение. Установлено, что инфекционные заболевания мужских половых органов могут приводить к бесплодию [1]. В то же время данных о влиянии на мужскую фертильность вируса простого герпеса 1-го и 2-го типов (ВПГ-1, -2), одного из самых распространенных вирусов в человеческой популяции, недостаточно.
ВПГ обнаружен в эякуляте человека, однако частота его выявления варьирует от 2,1 до 49,5% [2–4]. Неоднозначны также данные о влиянии ВПГ на качество спермы и фертильность [3–6]. Противоречия в результатах исследований, скорее всего, обусловлены различиями выборок пациентов и разной чувствительностью применяемых методов детекции вируса.
 Показано, что ВПГ не способен проникать в сперматозоиды и инфицировать их [7], однако ДНК и белки ВПГ, а также вирусные капсиды обнаружены непосредственно в сперматозоидах человека [8, 9]. Это дает основание предполагать, что ВПГ заражает половые клетки на более ранних этапах дифференцировки. В инфицированных ВПГ эякулятах часто увеличено число дегенеративных незрелых половых клеток [10–12], что косвенно свидетельствует о нарушении нормального развития мужских половых клеток – сперматогенеза. В то же время о путях проникновения ВПГ в яички, степени нарушения сперматогенеза, развитии инфекционного процесса в мужских половых клетках известно крайне мало.
Показано, что ВПГ не способен проникать в сперматозоиды и инфицировать их [7], однако ДНК и белки ВПГ, а также вирусные капсиды обнаружены непосредственно в сперматозоидах человека [8, 9]. Это дает основание предполагать, что ВПГ заражает половые клетки на более ранних этапах дифференцировки. В инфицированных ВПГ эякулятах часто увеличено число дегенеративных незрелых половых клеток [10–12], что косвенно свидетельствует о нарушении нормального развития мужских половых клеток – сперматогенеза. В то же время о путях проникновения ВПГ в яички, степени нарушения сперматогенеза, развитии инфекционного процесса в мужских половых клетках известно крайне мало.
Целью настоящей работы было оценить влияние ВПГ на сперматогенез мыши после инокуляции ВПГ непосредственно в семенные канальцы, что имитирует один из вероятных путей проникновения вируса в яички у человека – ретроградный – через семявыносящие протоки к сети семенника rete testis и далее в семенные канальцы.
Материалы и методы. В работе использовали 2-месячных самцов мышей линии C57Bl/6. Животных содержали в стандартных условиях вивария.
Инфицирование семенников мышей проводили ВПГ-1 (штамм F), полученным от проф. Л. Перейра (США). Пассирование и титрование ВПГ осуществляли на перевиваемой культуре клеток Vero. При разработке модели ретроградного введения ВПГ в семенные канальцы использовали методику введения жидкости в семенные канальцы через сеть семенника [13]. В каждый семенник вводили по 15 мкл вируссодержащей жидкости.
Животные были разделены на две группы. Мышам первой группы в каждый семенник инъецировали ВПГ с инфекционной множественностью 104 бляшкообразующих единиц (БОЕ) (высокая доза), мышам 2-й группы – 102 БОЕ (низкая доза). Мышам контрольной группы в семенники инъецировали культуральную среду в том же объеме. Отбор материала проводили на 3-и, 6, 10, 14, 21 и 45-е сутки после инфицирования ВПГ. В каждой группе на каждую экспериментальную точку отбирали материал от 3–5 животных.
Иммуногистохимический анализ. Для выявления белка ВПГ в реакции иммунофлюоресценции (РИФ) готовили криосрезы семенников толщиной 4 мкм и окрашивали их первичными моноклональными антителами (МКА) к позднему белку ВПГ gB, а затем – соответствующими вторичными ФИТЦконъюгированными антителами («Dako», Дания). Срезы просматривали и фотографировали на микроскопе Leica DMRXA2 (США). На трех криосрезах семенников подсчитывали количество семенных канальцев, окрашенных МКА, и выражали в процентах от общего числа канальцев. Для проведения конфокальной микроскопии готовили криосрезы семенников толщиной 25 мкм, окрашивали их первичными антителами anti-HSV («Abcam», Великобритания), затем – соответствующими вторичными ФИТЦ-конъюгированными антителами («Jackson ImmunoResearch», США); просматривали и фотографировали на конфокальном микроскопе Leica TCS SP5 STED.
 Для выявления инфекционно активного вируса применяли быстрый культуральный метод. Гомогенаты семенников наслаивали на монослой клеток Vero, инкубировали в течение 1 ч при температуре 37oС в атмосфере 5% СО2, затем отмывали клетки Vero и культивировали их в течение 24 ч. Клетки фиксировали и на цитологических препаратах проводили идентификацию белков ВПГ в РИФ с помощью МКА.
Для выявления инфекционно активного вируса применяли быстрый культуральный метод. Гомогенаты семенников наслаивали на монослой клеток Vero, инкубировали в течение 1 ч при температуре 37oС в атмосфере 5% СО2, затем отмывали клетки Vero и культивировали их в течение 24 ч. Клетки фиксировали и на цитологических препаратах проводили идентификацию белков ВПГ в РИФ с помощью МКА.
Полимеразная цепная реакция (ПЦР). Для выявления ВПГ методом ПЦР из гомогенатов семенников выделяли ДНК с помощью комплекта реагентов ДНК-сорб-B (ФБУН ЦНИИЭ Роспотребнадзора, Россия) в соответствии с рекомендациями производителя. Для проведения ПЦР в реальном времени (ПЦРрв) использовали комплект реагентов АмплиСенс® HSV I, II-FL (ФБУН ЦНИИЭ Роспотребнадзора) и амплификатор Rotor-Gene Q5 («QIAGEN», Германия). Для количественной оценки использовали два калибратора, содержащих 105 и 103 копий ДНК на пробу. Количество копий ДНК ВПГ в пробе нормировали на массу использованного в анализе фрагмента семенника.
Гистологический анализ. Семенники фиксировали в модифицированном фиксаторе Дэвидсона, проводили через восходящий градиент спиртов и ксилол и заключали в парафин. Готовили срезы толщиной 7 мкм и окрашивали их гематоксилином и эозином. Срезы просматривали и фотографировали на микроскопе Leica DM5000B (США). На трех срезах семенника подсчитывали общее количество канальцев и определяли количество морфологически нормальных семенных канальцев, т.е. канальцев, содержащих все типы половых клеток, и выражали в процентах.
Иммунофлюоресцентное окрашивание на маркер клеток Сертоли Wt1 проводили на криосрезах семенников толщиной 4 мкм с помощью поликлональных антител к Wt1 («LifeSpan Bioscience», США) и ФИТЦ-конъюгированных вторичных антител («Jackson ImmunoResearch»), фотографировали на микроскопе Leica DMRXA2. На трех криосрезах семенников подсчитывали процент семенных канальцев, содержащих Wt1+-клетки, от общего количества канальцев.
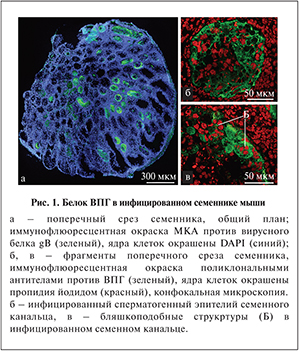
 Результаты. Как показали исследования, вирусный белок в инфицированных семенниках локализовался только в семенных канальцах и не проникал в интерстиций (рис. 1, а). Антиген ВПГ выявлялся по всей толще сперматогенного эпителия вплоть до базальной мембраны (рис. 1, б). Характерным проявлением ВПГ-инфекции в семенных канальцах являлись бляшкоподобные структуры (рис. 1, в). Первые семенные канальцы, в сперматогенном эпителии которых детектировался вирусный белок gB, появлялись уже на 3-и сутки после инокуляции ВПГ (5,4% от общего числа семенных канальцев на гистологический срез для высокой дозы ВПГ; 4,4% – для низкой дозы). Их доля достигала максимума на 6-е сутки инфекции (23,5 и 18% соответственно), снижалась на 10-е сутки (5,5 и 3,8%), на 21-е и 45-е сутки после начала инфекции вирусный белок не обнаруживался (рис. 2). Эти результаты согласуются с данными, полученными с помощью быстрого культурального метода: инфекционно активный вирус присутствовал в гомогенатах семенников с 3-х по 10-е сутки после введения ВПГ в обеих дозах и не выявлялся начиная с 14-х суток после инфицирования.
Результаты. Как показали исследования, вирусный белок в инфицированных семенниках локализовался только в семенных канальцах и не проникал в интерстиций (рис. 1, а). Антиген ВПГ выявлялся по всей толще сперматогенного эпителия вплоть до базальной мембраны (рис. 1, б). Характерным проявлением ВПГ-инфекции в семенных канальцах являлись бляшкоподобные структуры (рис. 1, в). Первые семенные канальцы, в сперматогенном эпителии которых детектировался вирусный белок gB, появлялись уже на 3-и сутки после инокуляции ВПГ (5,4% от общего числа семенных канальцев на гистологический срез для высокой дозы ВПГ; 4,4% – для низкой дозы). Их доля достигала максимума на 6-е сутки инфекции (23,5 и 18% соответственно), снижалась на 10-е сутки (5,5 и 3,8%), на 21-е и 45-е сутки после начала инфекции вирусный белок не обнаруживался (рис. 2). Эти результаты согласуются с данными, полученными с помощью быстрого культурального метода: инфекционно активный вирус присутствовал в гомогенатах семенников с 3-х по 10-е сутки после введения ВПГ в обеих дозах и не выявлялся начиная с 14-х суток после инфицирования.
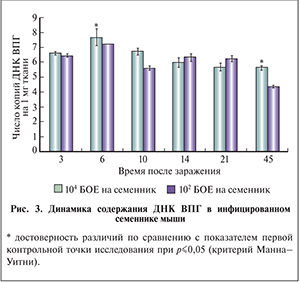
ДНК ВПГ обнаружена в гомогенатах инфицированных семенников на всех сроках инфекции; ее содержание не зависело от дозы вводимого вируса. Снижение количества ДНК ВПГ происходило на 45-е сутки инфекции, при высокой дозе инфицирования было статистически значимо (рис. 3).
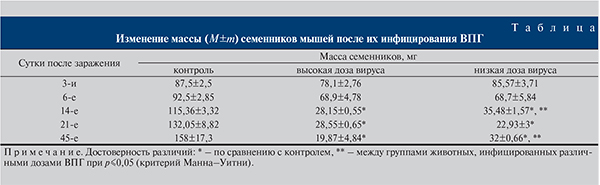
Так как важным показателем, свидетельствующим о дегенеративных процессах, является снижение массы семенников, для оценки влияния ВПГ измеряли массу семенников мышей на разных сроках после инфицирования (см. таблицу). Показано, что масса инфицированных ВПГ семенников начинает снижаться уже на 6-е сутки после инокуляции ВПГ вне зависимости от дозы. Начиная с 14-х суток после заражения масса инфицированных семенников была значительно ниже массы контрольных и к 45-м суткам уменьшалась в 7,9 раза при высокой дозе ВПГ и в 4,9 – при низкой. Отметим, что на 14-е и 45-е сутки масса семенников, зараженных низкой дозой ВПГ, была больше массы семенников, инокулированных высокой дозой ВПГ (p<0,05). Это свидетельствует о дозозависимом эффекте вируса.
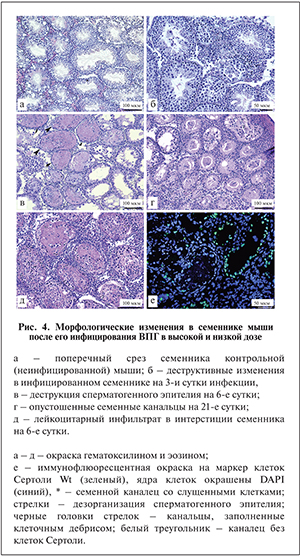
Гистологический анализ инфицированных семенников показал, что первые деструктивные изменения в структуре сперматогенной ткани (слущивание половых клеток, дезорганизация сперматогенного эпителия) появлялись на 3-и сутки после введения вируса как в высокой, так и в низкой дозе (рис. 4, а, б). На 6-е и 14-е сутки часть семенных канальцев была заполнена клеточным дебрисом, в других канальцах гибель половых клеток приводила к понижению высоты сперматогенного эпителия (рис. 4, в). На 21-е и 45-е сутки после инфицирования бо́льшая часть канальцев уже не содержала половых клеток (рис. 4, г). В интерстициальной ткани на ранних сроках инфекции обнаружены скопления лейкоцитов, что свидетельствует о воспалительном процессе – орхите (рис. 4, д); на поздних сроках наблюдались признаки фиброза – часть интерстиция замещалась соединительной тканью (см. рис. 4, г).
Анализ маркера клеток Сертоли Wt1 в РИФ показал, что на 14-е и 21-е сутки после инфицирования в части семенных канальцев отсутствовали клетки Сертоли (рис. 4, е). Доля таких канальцев от общего числа была высокой и составила 46,5%.
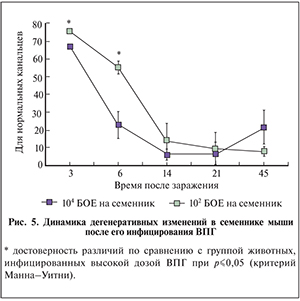
По данным количественного анализа доля морфологически нормальных канальцев в инфицированных ВПГ семенниках статистически значимо снижалась с 67 и 76% (для высокой и низкой доз ВПГ соответственно) на 3-и сутки после заражения до 6 и 15% соответственно на 14-е сутки. В дальнейшем этот показатель продолжал оставаться на низком уровне (рис. 5). В случае инфицирования высокой дозой ВПГ снижение числа нормальных канальцев происходило быстрее, чем при инфицировании низкой дозой ВПГ (p≤0,05).
Обсуждение. В настоящее время в ряде исследований показана связь между присутствием ВПГ в эякуляте, снижением показателей спермограммы и мужским бесплодием [3–5]. Однако механизмы влияния ВПГ на мужскую фертильность оставались невыясненными. Наличие ВПГ непосредственно в сперматозоидах [7, 8], а также присутствие в ВПГ-положительных эякулятах слущенных половых клеток на ранних стадиях дифференцировки [10–12] свидетельствуют о том, что ВПГ проникает в яички и приводит к нарушению сперматогенеза. Однако пути проникновения ВПГ в яички до сих пор не были исследованы. В работах на экспериментальных животных (мышах) показано, что герпес-вирусы не способны проникать в семенники половозрелых животных при внутрибрюшинном введении и через кровь [14]. Кроме того, при введении в интерстиций семенника вирус не обнаруживается в семенных канальцах и половых клетках [15]. Наиболее вероятной причиной представляется наличие гематотестикулярного барьера у половозрелых животных. В пользу этого предположения свидетельствуют недавно полученные данные о том, что при внутрибрюшинном введении ВПГ неполовозрелым животным, у которых еще не сформирован гематотестикулярный барьер, вирус способен проникать в семенные канальцы и инфицировать половые клетки [16].
Таким образом, для проникновения ВПГ в семенники половозрелых организмов остается только один путь – восходящий, через наружные половые органы и мужской половой тракт. В настоящей работе на экспериментальных животных нам удалось смоделировать этот путь инфицирования. ВПГ, который вводили в сеть семенника мыши, ретроградно проникал в семенные канальцы. Такой способ введения вируса позволил нам изучить непосредственное действие ВПГ на сперматогенез половозрелых животных.
Результаты изучения динамики инфекционного процесса показали, что он протекал довольно быстро при введении ВПГ как в высокой, так и в низкой дозе, достигая максимума уже на 6-е сутки после инокуляции ВПГ. На 21-е сутки после инокуляции инфекционная активность вируса в семенниках не определялась. По данным РИФ, вирусный белок локализовался строго в семенных канальцах и никогда – в интерстициальной ткани. По-видимому, стенка семенных канальцев не проницаема для ВПГ, что подтверждают и результаты других исследований [14, 15].
Интерес представляет также тот факт, что ДНК ВПГ не исчезала из семенников на протяжении всего эксперимента и даже на 45-е сутки после инокуляции ВПГ ее уровень продолжал оставаться достаточно высоким. Это наводит на мысль, что семенник может быть тем резервуаром, в котором вирус находится в латентном или персистентном состоянии. Экспериментальное подтверждение этого предположения еще предстоит получить.
 Для того чтобы оценить влияние ВПГ на сперматогенез, были проведены качественный и количественный гистологический и иммунофлюоресцентный анализы. Нами впервые установлено, что при ретроградном введении ВПГ в семенные канальцы половозрелых животных происходят значительные изменения сперматогенной ткани: повреждается структура сперматогенного эпителия, половые клетки дегенерируют и слущиваются в просвет канальцев. Дегенерация семенных канальцев сопровождается значительным снижением массы семенников и развитием воспалительного процесса – орхита. К 45-м суткам большая часть поврежденных канальцев замещается соединительной тканью, сперматогенез в большинстве оставшихся семенных канальцев нарушен.
Для того чтобы оценить влияние ВПГ на сперматогенез, были проведены качественный и количественный гистологический и иммунофлюоресцентный анализы. Нами впервые установлено, что при ретроградном введении ВПГ в семенные канальцы половозрелых животных происходят значительные изменения сперматогенной ткани: повреждается структура сперматогенного эпителия, половые клетки дегенерируют и слущиваются в просвет канальцев. Дегенерация семенных канальцев сопровождается значительным снижением массы семенников и развитием воспалительного процесса – орхита. К 45-м суткам большая часть поврежденных канальцев замещается соединительной тканью, сперматогенез в большинстве оставшихся семенных канальцев нарушен.
В ходе ВПГ-инфекции почти на 50% уменьшается число канальцев, содержащих клетки Сертоли. Клетки Сертоли – соматические клетки семенника, поддерживающие развитие половых клеток. Они являются основой структуры семенных канальцев, источником многих факторов роста и дифференцировки для половых клеток, выполняют трофическую функцию. Без этих клеток развитие половых клеток невозможно. Так как у половозрелых животных клетки Сертоли являются невозобновляемой популяцией, факт их гибели в ходе ВПГ-инфекции свидетельствует о необратимости дегенеративных изменений в сперматогенной системе.
Выводы
- Разработана модель ретроградного введения ВПГ в семенные канальцы половозрелых мышей.
- ВПГ способен инфицировать клетки семенных канальцев in vivo у половозрелых животных.
- Заражение ВПГ сопровождается значительными нарушениями структуры сперматогенной ткани, гибелью половых клеток и остановкой сперматогенеза.
- ВПГ-инфекция приводит к развитию орхита. 5.Гибель клеток Сертоли под действием ВПГ свидетельствует о необратимости деструктивных изменений в семенниках.


