В течение длительного времени методом выбора лечения клинически локализованного почечно-клеточного рака являлась радикальная нефрэктомия. Резекция почки принципиально изменила подход к оперативному лечению данной категории больных и с энтузиазмом была принята в качестве стандартной тактики, несмотря на отсутствие доказательств 1-го уровня, обосновывающих онкологическую безопасность и функциональную целесообразность применения органосохраняющего лечения больных с нормально функционирующей контралатеральной почкой [1–3]. В большинстве ретроспективных исследований, посвященных сравнению результатов радикальной нефрэктомии и органосохраняющих операций, продемонстрировано преимущество резекции почки в отношении сохранения почечной функции и снижения общей летальности, в том числе за счет уменьшения риска летальных сердечно-сосудистых заболеваний [4–7]. Активные дискуссии, противопоставляющие радикальную нефрэктомию и резекцию почки, вспыхнули с новой силой после публикации обескураживающих результатов единственного рандомизированного исследования, посвященного данному вопросу, выявившего снижение общей выживаемости при использовании органосохраняющего подхода [8]. Целью настоящей работы стала оценка безопасности и целесообразности использования резекции почки при клинически локализованном почечно-клеточном раке у больных с нормально функционирующей контралатеральной почкой путем сравнительного анализа результатов радикальной нефрэктомии и органосохраняющего хирургического лечения.
Материалы и методы. В исследование включены 453 больных клинически локализованным раком почки, подвергнутых оперативному лечению. Соотношение мужчин и женщин составило 1,3:1, медиана возраста – 58 (23–81) лет. Поражение правой почки имело место у 49,4% пациентов, левой – у 50,6%. Медиана размеров опухоли составила 3,9 (1–12,5) см. Регионарных и отдаленных метастазов не выявлено ни в одном наблюдении. Заболевания, неблагоприятно влияющие на функцию почек (артериальная гипертензия, сахарный диабет, хронический пиелонефрит, подагра), выявлены у 174 (42%) больных. Медиана индекса сопутствующих заболеваний Чарльсона составила 4, медиана индекса массы тела (ИМТ) – 28,9. Первый класс операционного риска по шкале Американского общества анестезиологов (ASA) определен у 6,8% пациентов, II – у 58,5%, III – у 32,5%, IV – у 2,2% пациентов (табл. 1).
Радикальная нефрэктомия выполнена 226 больным (лапаротомным доступом – 104 [46%], трансперитонеальным лапароскопическим доступом — 122 [54%]), резекция почки – 227 (лапаротомным доступом — 164 [72,2%], трансперитонеальным лапароскопическим доступом — 63 [27,8%]). Выполняя радикальную нефрэктомию, производили удаление почки с паранефрием в пределах фасции Герота в 226 (100%) наблюдениях, регионарную лимфаденэктомию — в 104 (46%), ипсилатеральную адреналэктомию – в 84 (37,2%). Резекция включала удаление части почки с опухолью и прилежащим паранефрием в пределах визуально неизмененных тканей. У 200 (88,1%) больных резекцию почки выполняли в условиях ишемии почечной паренхимы, из них в условиях холодовой – у 73 (32,2%). Среднее время ишемии составило 21,2 мин (тепловой – 19,2 мин, холодовой – 24,9 мин).
Во всех случаях гистологически подтверждено наличие почечно-клеточного рака (светлоклеточный — 88,7% случаев, несветлоклеточный – 11,3%). Степень анаплазии опухоли G1 имела место в 24,9% cлучаев, G2 — в 66,9%, G3 — в 8,2%. У большинства (90,1%) пациентов верифицирован локализованный (рТ1а–Т2а) рак почки, в 9,9% случаев опухоль прорастала в паранефрий (рТ3а). Для всех 104 пациентов, подвергнутых лимфодиссекции, морфологически подтверждена категория N0. Ни в одном из 84 удаленных неизмененных надпочечников метастазов не обнаружено.
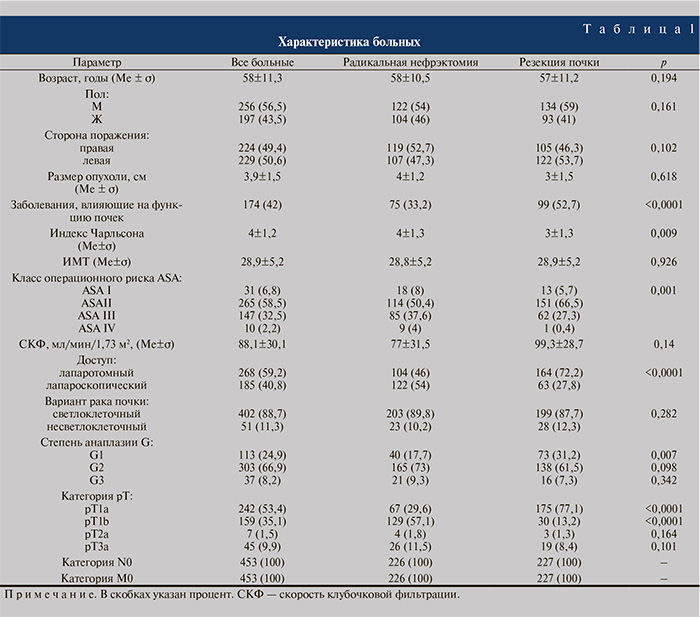
Группы пациентов, подвергнутых операциям разного объема, были сопоставимы по полу, возрасту, ИМТ, стороне поражения, размерам опухоли, исходной СКФ (р>0,05 для всех). Исходная медиана индекса Чарльсона и частота операционного риска ASA III–IV были достоверно выше у кандидатов для радикальной нефрэктомии (p<0,05 для всех), частота заболеваний, влияющих на функцию почек, категории рТ1а и степени анаплазии G1 – в группе резекции почки (р<0,0001; см. табл. 1).
Ни один из 453 пациентов не получал дополнительного лечения. Медиана наблюдения составила 50 (12–224) мес; в течение не менее 60 мес прослежена у 195 (43,1%) больных, не менее 120 мес – у 123 (27,2%).
Статистический анализ полученных результатов проведен с помощью общепринятых статистических методов, используя блок программ SPSS 13.0 for Windows. Продолжительность жизни рассчитана от даты оперативного вмешательства до последнего дня наблюдения или смерти. Почечную функцию оценивали по СКФ, которую рассчитывали до операции, в раннем (≤28 дней) и позднем (>28 дней) послеоперационном периодах; до операции и в позднем послеоперационном периоде почечную функцию классифицировали по системе KDOQI [9], в раннем послеоперационном периоде – по системе RIFLE [10]. Для оценки качества жизни использована анкета EORTC QLQ-30.
Результаты. Резекция почки по сравнению с радикальной нефрэктомией ассоциирована с увеличением медианы продолжительности операции (160 и 130 мин соответственно; р = 0,031) и объема кровопотери (620 и 300 мл соответственно; p<0,0001). Показания к гемотрансфузии во время резекции почки и радикальной нефрэктомии возникали одинаково часто – по 14 (6,2%) больных (р=0,368).
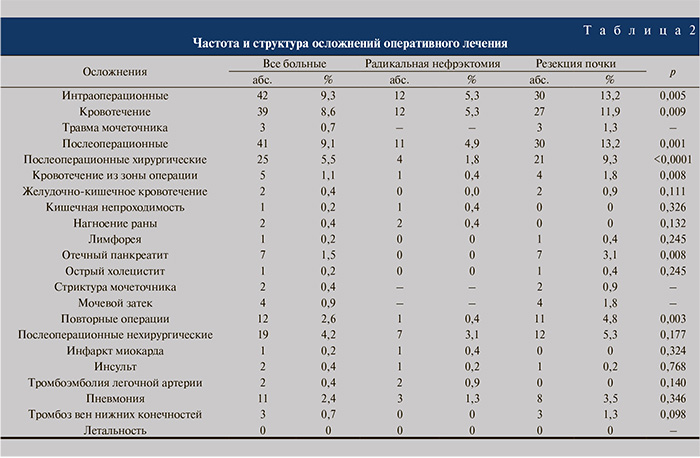
Осложнения резекции почки регистрировали достоверно чаще, чем радикальной нефрэктомии (OR=2,8 [95% CI: 1,6–4,7]; р<0,0001), в том числе интраоперационные (OR=2,5 [95% CI: 1,1–4,5]; р=0,005). Самым распространенным видом интраоперационных осложнений в обеих группах служило кровотечение (11,9 и 5,3% соответственно; р=0,009). Специфическим интраоперационным осложнением резекции поч-ки стало ранение мочеточника – 3 (1,3%) наблюдения.
Послеоперационные осложнения отмечены у 30 (13,2%) больных, подвергнутых органосохраняющим операциям, и у 11 (4,9%) пациентов, которым была выполнена радикальная нефрэктомия (OR=3 [95% CI: 1,5–6,1]; р=0,001). Резекция почки достоверно чаще, чем радикальная нефрэктомия (OR=5,7 [95% CI: 1,9–16,8]; р<0,0001), была ассоциирована с хирургическими осложнениями. Наиболее распространенными осложнениями органосохраняющих операций оказались кровотечения (из зоны резекции почечной паренхимы – 1,8%, из острой язвы желудка – 0,9%) и отечный панкреатит (3,1%); помимо этого в группе отмечены лимфорея (0,4%) и острый холецистит (0,4%). Специфические осложнения резекции почки развились у 6 (2,7%) из 227 пациентов: стриктура мочеточника – у 2 (0,9%), мочевой затек – у 4 (1,8%). К осложнениям радикальной нефрэктомии относились кровотечение из ложа удаленной почки (0,4%), кишечная непроходимость (0,4%), а также нагноение раны (0,8%). Показания к повторным операциям или эндоскопическим манипуляциям чаще возникали после выполнения резекции почки (OR=11,5 [95% CI: 1,5–89,5]; р=0,003). Повторные вмешательства после органосохраняющих операций потребовались 11 (4,9%) больным, из них с целью остановки кровотечения – 5 (2,2%), для восстановления оттока мочи – 6 (2,7%). Только в 1 (0,4%) наблюдении после радикальной нефрэктомии выполнена повторная операция (разделение спаек и назоинтестинальная интубация у пациента со спаечной кишечной непроходимостью). Частота нехирургических осложнений не зависела от объема операции и составила 5,3% для больных, подвергнутых резекции почки, и 3,1% – радикальной нефрэктомии (OR=1,7 [95% CI: 0,7–4,5]); р=0,177). В обеих группах пациентов регистрировали пневмонии (3,5 и 1,3%), тромботические (1,3 и 0,9%) и сосудистые (0,2 и 0,6%) осложнения (р>0,05 для всех). Летальных исходов не было (табл. 2).
Различия продолжительности операции, объема кровопотери и частоты осложнений между группами пациентов, подвергнутых операциям разного объема, сохранялась независимо от стороны поражения, размеров опухоли, ИМТ и оперативного доступа (р<0,05 для всех подгрупп).
Частота прогрессирования заболевания не зависела от объема операции и составила 4% (9 из 227) в группе больных, подвергнутых резекции почки, и 5,3% (12 из 226) – радикальной нефрэктомии (р=0,324). Медиана времени до рецидива после органосохраняющих операций оказалась в 2,3 раза больше, чем после радикальной нефрэктомии (71,5 и 30,7 мес соответственно; р=0,029).
Местные рецидивы недостоверно чаще регистрировались после резекции почки, чем после радикальной нефрэктомии (4 [1,8%] и 1 [0,4%] больной соответственно; р=0,13) и локализовались за пределами зоны резекции (3), в области предшествовавшей операции (1). Единственный местный рецидив после радикальной нефрэктомии развился в забрюшинных лимфоузлах. Отдаленные метастазы появились у 5 (2,2%) больных, подвергнутых резекции почки, и у 11 (4,9%) перенесших радикальную нефрэктомию, из них солитарные – у 1 (0,4%) и у 4 (1,8%) больных соответственно. Радикальное удаление рецидивов выполнено в 9 наблюдениях (нефрэктомия по поводу местного рецидива – 3, забрюшинная лимфаденэктомия по поводу местного рецидива – 1, удаление солитарных метастазов из легких – 2, печени – 1, головного мозга – 1, адреналэктомия – 1), системная терапия цитокинами проводилась в 12 случаях прогрессирования рака почки после оперативного лечения (максимальный эффект — стабилизация опухолевого процесса).

Из 453 больных 436 (96,3%) живы, из них 427 (94,3%) – без признаков болезни, 9 (2%) – с опухолевыми очагами. Семнадцать (3,8%) пациентов умерли: 3 (0,7%) – от прогрессирования рака почки, 14 (3,1%) – от других причин без признаков рака почки (сердечно-сосудистые заболевания – 9 (2%), кровотечение из язвы двенадцатиперстной кишки – 1 (0,2%), метахронная злокачественная опухоль другой локализации – 4 [0,9%]). Десятилетняя общая, специфическая, безрецидивная и кардиоспецифическая выживаемость всех больных составила 88,6, 98,5, 92 и 94,9% соответственно (табл. 3).
Однофакторный анализ выявил небольшое преимущество по показателю безрецидивной выживаемости больных, подвергнутых резекции почки, по сравнению с пациентами, которым выполнена радикальная нефрэктомия (93,9 и 90,4% соответственно; р=0,038); в многофакторном анализе разница результатов между группами утратила статистическую значимость (HR=5,9 [95% CI: 0,9–38,3]; p=0,061). У пациентов, подвергнутых резекции почки и радикальной нефрэктомии, не выявлено достоверных различий специфической (96,3 и 100% соответственно; р=0,4 [HR=0,1 (95% СI: 0 –12555,9]), кардиоспецифической (95,5 и 92,2% соответственно; р=0,901 [HR=1,1 [95% CI: 0,3–4,6]) и общей (88,3 и 91,3%, р=0,644 (HR=0,8 [95% CI: 0,2–2,5]) выживаемости, в том числе при стратификации больных по демографическим характеристикам, признакам опухоли и послеоперационной почечной функции (р>0,05 для всех).
Частота острого нарушения почечной функции (ОНПФ) в течение 28 сут после вмешательства оказалась достоверно выше у пациентов, подвергнутых резекции почки (46,3%), чем у больных, которым выполнена радикальная нефрэктомия (26,1%; р<0,0001). При этом после органосохраняющих операций в подавляющем большинстве (45%) случаев зарегистрировано транзиторное увеличение концентрации креатинина сыворотки крови, не потребовавшее интенсивной терапии (классы нарушений R и I); только у 3 (1,3%) пациентов отмечена олигурия или анурия (класс нарушений F), которая в 1 наблюдении стала показанием к проведению острого гемодиализа. Напротив, в группе больных, перенесших радикальную нефрэктомию, ОНПФ достоверно чаще проявлялось олигурией и анурией (10,1%), в том числе длительной (0,8%); почечно-заместительная терапия после нефрэктомии потребовалась 6 (2,7%) больным. В 1 (0,4%) наблюдении развилась терминальная почечная недостаточность (табл. 4). К независимым факторам риска ОНПФ относились резекция почки (OR=0,2 [95% CI: 0,1–0,3]; р<0,0001) и время ишемии (OR=0,1 [95% CI: 0 – 0,1]; p=0,004).
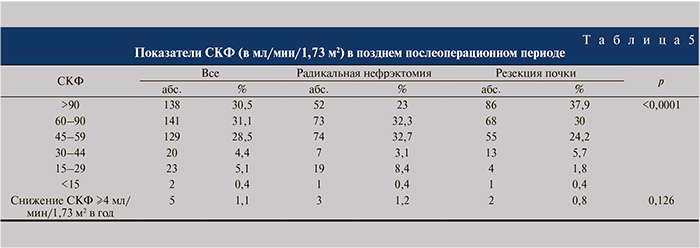
Частота развития хронической болезни почек (ХБП) 3-й стадии и выше в позднем послеоперационном периоде оказалась достоверно выше среди пациентов, подвергнутых радикальной нефрэктомии, по сравнению с больными, которым выполнялась резекция почки (45,3 и 32,1% соответственно; р<0,0001), при этом СКФ<30 мл/мин/1,73 м2 после удаления почки регистрировали в 4 раза чаще, чем после органосохраняющих вмешательств (р<0,0001). Частота продолжающегося снижения СКФ со скоростью ≥4 мл/мин/1,73 м2 в год в группах была одинаковой – 3 (1,2%) и 2 (0,8%) пациента соответственно (р=0,126) (табл. 5). По данным регрессионного анализа, независимыми факторами неблагоприятного прогноза состояния почечной функции в отдаленном послеоперационном периоде являлись низкая исходная СКФ (OR=0,003 [95% CI: 0,002–0,005]; p<0,0001), радикальная нефрэктомия (OR=0,195 [95% CI: 0,093–0,298]; p<0,0001) и ОНПФ в раннем послеоперационном периоде (OR=0,281 [95% CI: 0,187–0,376]; p=0,0001).
При анализе результатов анкетирования 30 больных, подвергнутых радикальной нефрэктомии (по 15 [50%] больных, оперированных открыто и лапароскопически), и 30 пациентов, которым была выполнена резекция почки (также по 15 [50%] пациентов), установлено, что субъективная оценка собственного состояния относительно боли, физических способностей, возможности осуществлять квалифицированную трудовую деятельность, социальной адаптации и качества жизни до лечения, на 1-е, 3-и, 7-е сутки, а также через 1, 3, 6 и 12 мес после оперативного вмешательства не зависела от объема операции (р>0,05 для всех).

Обсуждение. В настоящее время предложено два основных метода оперативного лечения клинически локализованного почечно-клеточного рака – радикальная нефрэктомия и резекция почки. Мы провели сравнительный анализ результатов радикальной нефрэктомии и резекции почки у относительно сопоставимых групп больных раком почки сТ1–2N0M0. Представленная работа имеет ряд недостатков, включая ретроспективный отбор пациентов, нерандомизированный выбор вида лечения, несопоставимость групп больных по некоторым параметрам, включая ключевой фактор – категорию рТ. Однако полученные нами результаты позволяют сделать ряд выводов, имеющих некоторую клиническую ценность.
Удаление почки выгодно отличается от органосохраняющих операций технической простотой, что позволяет достоверно сокращать длительность оперативного вмешательства в среднем на 30 мин, а объем кровопотери – на 320 мл. Тем не менее как операционное время (160 мин), так и объем кровопотери (620 мл) во время резекции почки приемлемы. Органосохраняющее лечение не ассоциировано с увеличением частоты показаний к гемотрансфузии по сравнению с радикальной нефрэктомией.
По нашим данным, технические особенности резекции почки закономерно обусловливали существенное увеличение риска периоперационных осложнений по сравнению с радикальной нефрэктомией с 4,9 до 23,8%. В крупной серии наблюдений W. Lowrance [11] частота осложнений у больных, подвергнутых резекции почки (n=1061), также оказалась выше, чем среди пациентов, перенесших радикальную нефрэктомию (n=51) (20 и 14% соответственно). Тем не менее, по данным некоторых авторов, частота осложнений резекции почки и радикальной нефрэктомии значимо не различается. Так, в исследовании National Veterans Administration Surgical Quality Improvement Program [12] частота осложнений 1373 радикальных нефрэктомий и 512 резекций почки была одинаковой – 15 и 16,2% соответственно (р=0,52). Противоречивые результаты, полученные в разных центрах, помимо разницы в опыте выполнения резекции почки могут быть отчасти объяснены существенной разнородностью анатомических характеристик опухолей у больных, получавших органосохраняющее лечение.
По нашим данным, наиболее распространенным видом интраоперационных осложнений оперативного лечения рака почки было кровотечение, которое вдвое чаще регистрировали во время органосохраняющих вмешательств. В исследовании EORTC 30904 резекция почки была сопряжена с увеличением частоты сильных интраоперационных кровотечений с 1,2 до 3,1%, а массивной кровопотери — с 4 до 12,8% [13].
По сравнению с радикальной нефрэктомией резекция почки была ассоциирована с увеличением частоты послеоперационных хирургических осложнений на 7,5%; частота нехирургических осложнений в группах не различалась. Специфическими осложнениями органосохраняющих операций стали кровотечение из зоны резекции почечной паренхимы (1,8%), стриктура мочеточника (0,9%) и мочевой затек (1,8%); неспецифическим осложнением, развивающимся после резекции левой почки чаще, чем после радикальной нефрэктомии, – отечный панкреатит, обусловленный длительным сдавлением поджелудочной железы во время манипуляций на почке. Среди пациентов, включенных в протокол EORTC-30904, частота неспецифических осложнений резекции почки и радикальной нефрэктомии также не различалась; мочевые свищи развились у 4,4% больных после органосохраняющих вмешательств. Повторные операции выполнены в группе резекции почки почти в 2 раза чаще, чем в группе нефрэктомии (4,4 и 2,4% соответственно) [13], что согласуется с нашими данными. Несмотря на высокую частоту осложнений, резекция почки является относительно безопасным оперативным вмешательством. В нашей серии наблюдений все осложнения органосохраняющего лечения были полностью излечены, не привели к утрате функции резецированной почки и летальному исходу ни в одном наблюдении.
По нашим данным, применение органосохраняющего подхода не приводит к ухудшению онкологических результатов лечения клинически локализованного рака почки. Показатель безрецидивной выживаемости больных, подвергнутых резекции почки, по сравнению с пациентами, которым выполнена радикальная нефрэктомия, оказался несколько выше. Необходимо отметить, что частота рецидивов в группах не различалась, однако продолжительность периода до рецидива была в 2,3 раза больше после органосохраняющего лечения, чем после удаления почки. Вероятно, это и послужило причиной увеличения расчетной безрецидивной выживаемости при использовании органосохраняющего лечения. Преимущество безрецидивной выживаемости в группе больных, подвергнутых резекции почки, не транслировалось в увеличение специфической выживаемости по сравнению с пациентами, которым выполнена радикальная нефрэктомия. Это обусловлено высокой частотой радикального удаления рецидивных опухолей всех локализаций в обеих группах и как следствие – низкой частотой смертей от прогрессирования рака почки. По данным мета-анализа 36 исследований [14], органосохраняющее лечение не приводит к увеличению риска прогрессирования рака почки. У больных, подвергнутых резекции, отмечено снижение риска смерти, обусловленной почечно-клеточным раком, на 29% (HR=0,71; p=0,0002) по сравнению с пациентами, которым выполнена радикальная нефрэктомия. Следует отметить, что низкое качество доказательной базы и существенная гетерогенность исследований, включенных в мета-анализ, требуют критического осмысления его результатов.
В связи с низкой частотой рецидивов клинически локализованного рака почки после оперативного лечения большинство пациентов данной категории умирают от причин, не связанных с прогрессированием основного заболевания. Смерть 2/3 умерших больных в нашей серии наблюдений была обусловлена болезнями сердечно-сосудистой системы. Хроническая болезнь почек является общепризнанным независимым фактором риска патологических изменений сердечно-сосудистой системы и кардиоваскулярной летальности [15]. Теоретически резекция почки, снижающая риск развития тяжелой ХБП по сравнению с радикальной нефрэктомией, может редуцировать риск летальных сердечно-сосудистых заболеваний. Однако наши результаты не подтвердили данной гипотезы. При медиане наблюдения 50 мес почечная функция в позднем послеоперационном периоде не влияла на риск смерти от сердечно-сосудистых заболеваний. Мы не выявили значимых различий кардиоспецифической выживаемости пациентов, подвергнутых резекции почки и радикальной нефрэктомии (HR=1,1; 95% CI: 0,3–4,6), что согласуется с результатами крупного регистрового исследования [5]. По данным [7], напротив, послеоперационная СКФ стала фактором прогноза общей и кардиоспецифической выживаемости, а органосохраняющее лечение снизило риск смерти от сердечно-сосудистых заболеваний, которое, по мнению исследователей, и является причиной увеличения общей выживаемости после резекции почки по сравнению с радикальной нефрэктомией. Несомненно, проблема влияния тяжелой послеоперационной ХБП на риск кардиоваскулярной летальности требует дальнейшего изучения в проспективных исследованиях с длительными сроками наблюдения.
В нашей серии наблюдений общая выживаемость не зависела от объема оперативного вмешательства. По данным Cleveland Clinic, при медиане наблюдения 4,1 года радикальная нефрэктомия (n=111) оказалась ассоциированной с увеличением риска смерти в 2,5 раза (HR=2,5; 95% CI: 1,3–5,1) по сравнению с органосохраняющим лечением (n=388) [7]. В крупном мета-анализе больных, подвергнутых резекции почки, доказано уменьшение риска смерти от любой причины на 19% (HR=0,81, p<0,00001) по сравнению с пациентами, которым выполнена радикальная нефрэктомия [14]. Напротив, в рандомизированном исследовании EORTC-30904 (n=541) при медиане наблюдения 9,3 года анализ общей выживаемости по намерению лечить продемонстрировал достоверно более высокую 10-летнюю общую выживаемость в группе радикальной нефрэктомии (81,1%) по сравнению с органосохраняющим лечением (75,7%) (HR=1,50 [95% CI: 1,03–2,16]; р=0,03). По мнению авторов, увеличение общей выживаемости после удаления почки не было обусловлено снижением риска смерти от прогрессирования опухолевого процесса, так как почечно-клеточный рак стал причиной только 12 из 117 смертей (4 –после нефрэктомии, 8 – после резекции почки) [8]. Многочисленные недостатки исследования, включая недостаточное количество включенных в него пациентов и переходы больных между лечебными группами, требуют критического отношения к его результатам.
Основным преимуществом резекции почки по сравнению с радикальной нефрэктомией принято считать сохранение почечной функции. Однако частота ОНПФ оказалась достоверно выше у пациентов, подвергнутых резекции почки (р<0,0001). Парадоксальная разница результатов объясняется различием механизма развития ОНПФ при использовании разных оперативных методов лечения. Основной причиной ОНПФ после радикальной нефрэктомии является необратимая острая утрата половины функционирующих нефронов. Ведущую роль в развитии ОНПФ после резекции почки играют обратимые процессы: ишемическое повреждение, обусловленное вазоспазмом и гипоперфузией почечной ткани в ответ на отсутствие притока артериальной крови, и реперфузионный синдром, включающий реактивацию кислородного окисления, повреждение клеток эндотелия и обструкцию микрососудов [16]. Именно поэтому ОНПФ после органосохраняющих операций в подавляющем большинстве случаев проявляется только эскалацией уровня креатинина (45%) и крайне редко требует проведения острого гемодиализа (0,4%), в то время как радикальная нефрэктомия достоверно чаще ассоциирована с развитием анурии (10,1%), в том числе являющейся показанием к почечно-заместительной терапии (2,7%). Косвенным подтверждением гипотезы о различии механизмов ОНПФ после удаления части почки или всей почки служат результаты регрессионного анализа, подтвердившие достоверное увеличение риска ОНПФ после резекции почки с длительным периодом ишемии.
Частота развития ХБП ≥3 стадии в позднем послеоперационном периоде достоверно выше у пациентов, подвергнутых радикальной нефрэктомии (45,3%), по сравнению с больными, которым выполнялась резекция почки (32,1%), при этом СКФ<30 мл/мин/1,73 м2 после удаления почки зарегистрирована в 4 раза чаще, чем после органосохраняющих вмешательств (р<0,0001). Причиной снижения почечной функции в позднем послеоперационном периоде служит гломерулосклероз, обусловленный повреждением гломерулярных клеток и облитерацией клубочковых артериол в ответ на адаптивную клубочковую гиперперфузию и гиперфильтрацию, вызванные утратой части функционально значимой почечной паренхимы [17]. Радикальная нефрэктомия ассоциирована с удалением значительно большего числа функционирующих нефронов, чем резекция почки, что приводит к более выраженным нежелательным изменениям почечной паренхимы и увеличению риска прогрессирования ХБП. Преимущество резекции почки по сравнению с радикальной нефрэктомией в отношении отдаленных функциональных результатов подтверждается не всеми исследовательскими группами [12, 18]. Однако большинство авторов указывает на снижение риска ХБП у больных, подвергнутых органосохраняющим операциям [19, 20]. Так, при сравнительном анализе результатов 10 123 (93%) радикальных нефрэктомий и 763 (7%) резекций почки выявлено достоверное снижение частоты неблагоприятных функциональных исходов органосохраняющего лечения по сравнению с органоуносящим (16,4 и 21,8% соответственно) [5]. В мета-анализе 9 исследований у больных, подвергнутых резекции почки, продемонстрировано снижение риска развития тяжелой ХБП на 61% (р<0,0001) по сравнению с пациентами, которым выполнена радикальная нефрэктомия [14]. По нашим данным, независимыми факторами неблагоприятного прогноза почечной функции в отдаленном послеоперационном периоде ожидаемо являлись низкая исходная СКФ, радикальная нефрэктомия и ОНПФ.
Используя анкетный метод (EORTC QLQ-30), мы не выявили зависимости качества жизни больных клинически локализованным раком почки от объема оперативного вмешательства как в раннем, так и в позднем послеоперационном периоде, что согласуется с данными ряда авторов [21, 22]. Тем не менее опубликованы работы, свидетельствующие о преимуществе резекции почки в отношении физических способностей [23] и самочувствия при длительных сроках наблюдения [24].
Заключение. Резекция почки при клинически локализованном почечно-клеточном раке у больных с нормально функционирующей контралатеральной почкой сопоставима с радикальной нефрэктомией по показателям отдаленной специфической и общей выживаемости. Органосохраняющие вмешательства относительно безопасны. Однако технические особенности резекции почки закономерно приводят к увеличению длительности операции, объема кровопотери и риска периоперационных осложнений, включая ОНПФ. Осложнения резекции почки в большинстве случаев излечимы, не увеличивают риск снижения почечной функции и летального исхода. Органосохраняющее лечение снижает риск отсроченного развития ХБП 3-й стадии и выше в 1,4 раза по сравнению с радикальной нефрэктомией, однако это не приводит к увеличению кардиоспецифической выживаемости. Существенным преимуществом резекции почки является возможность избежать ренопривного состояния в случае развития метахронной опухоли контралатеральной почки. Влияния объема операции на качество жизни не выявлено.
Таким образом, выбор метода оперативного лечения у больного раком почки делается с учетом его индивидуальных характеристик, с соблюдением баланса между уменьшенным риском осложнений раннего послеоперационного периода при выполнении нефрэктомии и вероятностью долгосрочных преимуществ, ассоциированных с сохранением функционирующей почечной паренхимы при ее резекции.


