Введение. До последнего времени общепринятой считалась парадигма о стерильности мочи здорового человека [1, 2]. В то же время воспалительная реакция мочи с присутствием в ней бактерий свидетельствовала об инфекции мочевых путей (ИМП). Отсутствие же воспалительной реакции при наличии бактерий в моче расценивали как асимптомную бактериурию. Последняя и в настоящее время рассматривается как предвестник ИМП и по сути означает состояние асимптомного носительства с неизвестным влиянием на здоровье и качество жизни [3].
Дифференцировка ИМП и асимптомной бактериурии – клинически не решимая задача. Инфекцию мочевых путей, если она симптомная, всегда надо лечить и дополнительно обследовать, а лечение асимптомной бактериурии ограничено узкими показаниями, признанными далеко не всеми [4, 5]. С другой стороны, что есть на самом деле лечение асимптомной бактериурии? Не является ли она состоянием, присущим здоровым людям? Таким образом, мы возвращаемся к основному вопросу: стерильна ли моча в норме?
С целью ответа на подобные вопросы прежде проводились исследования, связанные с культивированием мочи, результаты которых играли ключевую роль в дифференциации стерильных и инфицированных образцов мочи. Последние считали таковыми, когда концентрация тех или иных уропатогенов достигала определенного уровня. Однако, как оказалось, даже в условиях клинически бесспорной острой инфекции верхних и нижних мочевых путей метод культивирования мочи при использовании стандартной питательной среды демонстрировал ее стерильность у значительной части больных, т.е. не выявлял этиологический фактор ИМП [6]. Это послужило причиной применения в клинической практике понятия «некультивируемые бактерии» [7–9]. В связи с этим ограниченные возможности стандартного культурального исследования мочи побудили исследователей к применению с той же целью новейших методик, не связанных с культивированием, таких как ПЦР и метагеномное секвенирование по гену 16S pPHK [10–15].
Инициированный в 2008 г. Национальным ин- ститутом здоровья США фундаментальный исследовательский проект «Human microbiome project» с использованием детекции 16S pPHK бактерий во многом поколебал существующие представления о «стерильности» различных биотопов человека и расширил знания о микробном спектре желудочно-кишечного, урогенитального трактов, кожи и других локусов организма человека (http://nihroadmap.nih.gov/hmp/, www/human-microbiome.org). Были опубликованы работы не только по микробиому бактерий, но и по вирусному микробиому здорового человеческого организма [16]. Вместе с тем метод полнообъемного секвенирования генов, к сожалению, трудоемок, дорог и недоступен в рутинной клинической практике. Поэтому до сих пор бактериологическое исследование по праву считается «золотым» стандартом микробиологической диагностики, на наш взгляд, недоизучен и нуждается в дальнейшем совершенствовании.
Целью настоящего исследования было определить микробиоту мочи здоровых людей бактериологическим методом с помощью расширенного набора питательных сред, предназначенных для культивирования факультативно-анаэробных и неклостридиальных анаэробных бактерий.
Материалы и методы. Группу исследования составили 24 здоровые сексуально активные женщины в возрасте 18–25 лет и 28 мужчин 20–25 лет. Критерии включения в исследование: возраст до 25 лет, отсутствие гинекологических и урологических заболеваний, инфекций, передающихся половым путем в анамнезе и на момент обследования, а также отсутствие инфекционных заболеваний в течение года, генетических, системных, аутоиммунных поражений, факторов риска (радиоактивное облучение и т.д.), отсутствие патологических изменений почек, мочевой системы, внутренних половых органов при ультразвуковом исследовании, приема лекарственных препаратов, в том числе антибиотиков, кортикостероидов последние 2 месяца, формально нормативные показатели общего анализа крови и мочи, согласие обследуемых на участие в исследовании.
После соответствующей гигиенической процедуры образцы мочи в исследуемых группах собирал специально обученный медицинский персонал при самостоятельном мочеиспускании пациентов. Образцом для бактериологического исследования стала средняя порция утренней мочи, отобранная в стерильный одноразовый контейнер. Пробы кодировали идентификационным номером и разделяли на две аликвоты: одну – для стандартного анализа (определение количества лейкоцитов, эритроцитов и т.д.), другую – для бактериологического исследования микробиоты мочи, осуществленного троекратно с интервалом 3 дня. Всего проведено 156 бактериологических исследований проб мочи. Исследование каждого образца мочи и определение уровня бактериурии проведены на расширенном наборе питательных сред для идентификации факультативно-анаэробных (ФАБ) и неклостридиальных анаэробных (НАБ) бактерий: MacConkey agar, HiCrome Candida differential agar, HiCrome Enterococcus faecium agar base, HiCrome Aureus agar base, кровяной агар, приготовленный на основе Mueller Hinton agar с добавлением бараньих эритроцитов, Bacteroides bile esculin agar, Schaedler agar, Schaedler broth, MRS agar. Питательные среды с исследуемым материалом инкубировали в аэробных (24–48 ч) и анаэробных (48–72 ч) условиях (10% СО2, 10% Н2, 80% N2). Изучали характер роста микроорганизмов на питательных средах с определением гемолитических свойств на кровяном агаре. Микроорганизмы идентифицировали по морфологическим свойствам. Из колоний, выросших на питательных средах, готовили мазки, фиксировали их нагреванием и окрашивали по Граму с использованием стандартного протокола. Просматривали 10–15 репрезентативных участков с масляной иммерсией (х900). Окончательную идентификацию микроорганизмов провели по биохимическим свойствам с помощью энтеро-, стафило-, анаэротестов («Lachema», Чехия).
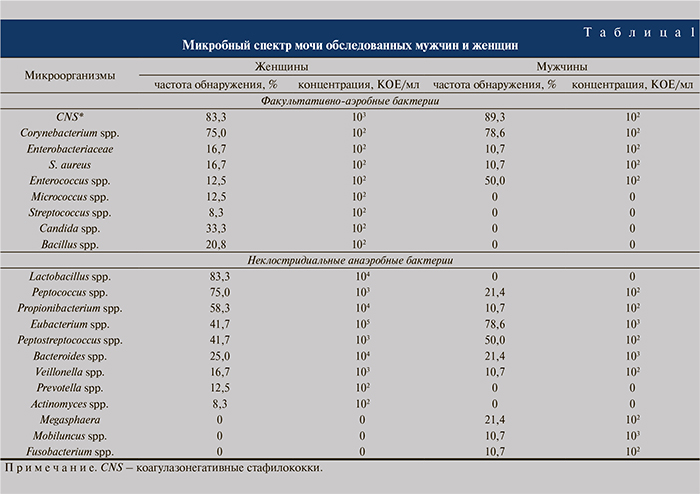
Результаты. Стерильных посевов по результатам троекратного бактериологического исследования мочи ни в одном случае получено не было. Оказалось, что в моче здоровых женщин и мужчин микроорганизмы присутствуют в виде различных вариантов многокомпонентных ассоциаций ФАБ и НАБ (табл. 1).
Паттерн ФАБ обследуемых женщин был значительно шире по сравнению с мужчинами. Доминирующими кластерами в обеих группах были коагулазоотрицательные стафилококки и Corynebacterium sрp. В моче здоровых мужчин отсутст- вовали Micrococcus sрp., Streptococcus sрp., Candida sрp., Bacillus sрp., присутствовавшие в моче женщин. В моче женщин и мужчин обнаружен широкий паттерн из 9 родов НАБ, но с различиями в доминирующих кластерах. У женщин среди НАБ преобладали Lactobacillus sрp., Peptococcus sрp., Propionibacterium sрp., у мужчин – Eubacterium sрp. В моче здоровых женщин отсутствовали Megasphaera, Mobilluncus sрp., Fusobacterium sрp., а в моче здоровых мужчин – Lactobacillus sрp., Prevotella sрp., Actinomyces sрp.
Уровень бактериурии ФАБ был низким (102 КОЕ/мл) в обеих группах, за исключением Corynebacterium sрp. у женщин. Следует отметить, что Eubacterium spp., Lactobacillus spp., Propionibacterium spp., Bacteroides spp., Peptococcus spp., Peptostreptococcus spp., Veillonella spp. у женщин и Eubacterium spp., Bacteroides spp. и Mobiluncus spp. у мужчин определены в титре ≥103 КОЕ/мл, который, как известно, диагностически значим при остром цистите.
В табл. 2 представлено несколько примеров выделения микроорганизмов из мочи на расширенном наборе питательных сред.
Данные примеры свидетельствуют о том, что спектр выделенных из мочи микроорганизмов довольно широк и вариабелен. У женщин количество ассоциантов в моче варьировалось от 3 до 10 (в среднем 5,8), у мужчин – от 6 до 9 (в среднем 7,1), а также строго индивидуален – у каждого обследуемого в моче обнаружен оригинальный спектр микроорганизмов, не повторяющийся ни в одном другом случае.
При троекратном исследовании мочи женщин в 12,5% случаев и мужчин – в 14,2% спектр выделенных микроорганизмов был идентичным, но с колебаниями концентрации некоторых видов. В остальных случаях имело место непостоянство композиции микробных сообществ и их концентрации по 1–3 видам микроорганизмов.
У 21,7% женщин в моче обнаружен широкий спектр дрожжеподобных грибов рода Candida: C. tropicalis (12,5%), C. krusei (8,3%), C. glabrata (4,2%), C. parapsilosis (4,2%), C. albicans (4,2%).
Среди энтерококков, выделенных из мочи всех обследованных, преобладал E. faecium (8,3 и 35,7% у мужчин и женщин соответственно).

Обсуждение. Проведенные нами ранее исследования [17–22] по изучению этиологической структуры возбудителей инфекций верхних и нижних мочевых путей выявили в моче всех больных бактериальную микст-инфекцию, где постоянными ассоциантами фигурировали НАБ в различном количественном диапазоне. Установленные нами факты стали предпосылкой к изучению микробиоты мочи здоровых людей. Результаты настоящего бактериологического исследования убедительно доказывают, что моча здоровых сексуально активных женщин и мужчин не есть стерильная среда.
Так, из мочи здоровых сексуально активных мужчин и женщин практически во всех случаях микроорганизмы были выделены в составе аэробно-анаэробных ассоциаций, за исключением редких случаев (8,3%) отсутствия аэробов в моче у женщин. Количество видов микроорганизмов имело широкие колебания (среднее количество выделенных видов 5,8 у женщин и 7,1 у мужчин) и значительные половые различия широты спектра и концентрации микроорганизмов. Аналогичные значительные различия в микробиоте сексуально активных и неактивных здоровых женщин были выявлены нами ранее [23, 24].
Таким образом, постоянное присутствие широкого спектра микроорганизмов в различной концентрации в моче доказывает, что бактериурия – это естественное состояние мочи здорового человека. И по сути эта бактериурия асимптомна.
Хорошо известно, что принятый в мире подход к бактериологическому исследованию мочи позволяет обнаруживать в ней только быстрорастущие в присутствии кислорода микроорганизмы. Апробированная же нами методика с использованием расширенного набора питательных сред позволила получить ранее неизвестные данные о нестерильности мочи у здоровых людей. Большинство (7) из этих сред ранее не применялись для исследования мочи, но использовались в других исследованиях (бактериологическое исследование микрофлоры влагалища, кишечника) [25, 26]. Нами впервые показано, что предложенная комбинация сред оптимизирует выделение аэробных и анаэробных микроорганизмов в моче. При этом полагаем, что набор питательных сред, применяемый нами в последние годы, не должен восприниматься как некий стандарт, так как, исходя из научных и клинических целей, этот набор может и должен меняться и дополняться. Тем не менее с практической точки зрения необходимым условием достоверной оценки должно быть обязательное использование нескольких сред для выделения НАБ и ФАБ.
Результаты проведенного нами бактериологиче- ского анализа мочи здоровых людей согласуются с данными использования метагеномного секвенирования мочи по гену 16S pPHK. Так, в микробиоме мочи здоровых женщин было обнаружено 45 различных родов микроорганизмов с доминированием Lactobacillus, Prevotella, Gardnerella, которые относят к трем чаще выявляемым филам: Firmicutes, Bacteroides, Actinobacteria [27]. Последовательности 16S pPHK филов Firmicutes и Bacteroides выявили во всех пробах мочи. В моче женщин авторы обнаружили фил Fubrobacteres, впервые выявленный в человеческом микробиоме по данным каталога «Human microbiome project». Исследователи сделали вывод, согласно которому состав мочи у женщин носит полимикробный и вариабельный характер: широкий бактериальный паттерн включал как виды, вызывающие патологические состояния, так и те, которые являются частью здоровой микрофлоры мочи. Наши данные также свидетельствуют: в моче женщин доминируют Lactobacillus spp. и микробиота мочи в норме носит полимикробный характер.
D. Fouts и соавт. [3], используя метод секвенирования 16S pPHK, в микробиоме мочи здоровых мужчин выявили доминирующую роль Corynebacterium spp. Ими установлено, что частота присутствия в моче здоровых людей Lactobacillus spp., Gardnerella spp., Prevotella spp. и Enterococcus spp. отражает половые различия. Исследователи указали, что состояние нормальной мочи – это фактически состояние «асимптоматической бактериурии». В контексте данного вывода интересен и дискутабелен обзор [5] по асимптомной бактериурии. Наши бактериологические исследования мочи здоровых сексуально активных мужчин также выявили преобладание среди ФАБ коагулазоотрицательных стафилококков (89,3%) и Corynebacterium spp. (78,6%).
В работе A. Wolfe [8] описан спектр бактерий в моче, собранной при самостоятельном мочеиспускании с помощью трансуретрального катетера (ТУК) и путем надлобковой аспирации (НЛА). Наибольший интерес представляют результаты по анализу спектра бактерий, выделенных из мочи, взятой с помощью ТУК и НЛА. Из 14 идентифицированных родов в мочевом пузыре чаще присутствовали Lactobacillus spp. Самые распространенные роды, обнаруженные в образцах ТУК, были аналогичными таковым, выявленным в образцах мочи, взятых путем НЛА. Авторы установили, что в мочевом пузыре некоторых женщин присутствуют различные таксоны микроорганизмов, в частности Lactobacillus spp., и подчеркнули, что стандартный микробиологический метод не учитывает медленнорастущие анаэробные бактерии. Именно на это обстоятельство мы неоднократно указывали в своих работах ранее [28–31]. В контексте наших исследований по выделению и причастности анаэробных бактерий к развитию инфекции верхних и нижних мочевых путей считаем необходимым процитировать авторов этой работы: «Доказательства того, что анаэробные организмы со сложными питательными потребностями, которые трудно культивировать, являются причиной заболеваний мочевыводящих путей, создают прецедент для будущих исследований такого рода».
На наш взгляд, эти исследования бесспорно привносят новый взгляд в понятие «норма», а также позволят с иных позиций рассматривать инфекционные агенты при воспалительных заболеваниях мочевой системы.
Бесспорно метод пиросеквенирования генов некий промежуток времени будет доступным только научным лабораториям. Кроме того, следует понимать, что этот метод не позволяет определять уровень бактериурии и антибиотикочувствительность выделенных микроорганизмов, что имеет большое значение для практической медицины. Поэтому бактериологический метод следует считать «золотым» стандартом диагностики, его необходимо совершенствовать, расширив набор питательных сред для культивирования.
Заключение. На основании данных расширенного бактериологического исследования мочи здоровых сексуально активных мужчин и женщин нами установлено, что моча не есть стерильная среда. У мужчин и женщин в группе ФАБ доминируют кластеры коагулазоотрицательных стафилококков и Corynebacterium spp., в группе НАБ у женщин – кластеры Lactobacillus spp., Peptococcus spp., у мужчин – Eubacterium spp. Результаты наших исследований не только расширяют представления о нормальных микробных сообществах мочи, но они должны и изменить стандартные подходы к диагностике инфекции мочевых путей.



