Согласно данным мировой статистики, в 2008 г. было зарегистрировано 899 тыс. новых случаев рака предстательной железы (РПЖ), а также 258 тыс. случаев смерти от этого заболевания. Это ставит рак простаты на 2-е место по распространенности и на 6-е – по смертности среди всех онкологических заболеваний у мужчин [1]. Нельзя отрицать социальную значимость РПЖ, однако обращает на себя внимание ощутимый перевес числа вновь выявленных случаев РПЖ над уровнем раково-специфической смертности. Так, по данным американского онкологического общества, в 2013 г. в США это соотношение для РПЖ составило 8:1, тогда как для рака легкого и рака толстой кишки оно составило 1,4:1,0 и 2:1 соответственно [2].
Высокая выявляемость РПЖ во многом объясняется внедрением в клиническую практику в начале 1990-х гг. теста на простатспецифический антиген (ПСА). Безусловно, ПСА показал себя как один из наиболее эффективных скрининг-маркеров РПЖ. Однако в настоящее время целесообразность скрининга РПЖ на основании уровня ПСА служит предметом многочисленных дискуссий. Рак предстательной железы относится к заболеваниям с длительным латентным периодом. Кроме того, широкое использование анализа на ПСА привело к существенному росту частоты выявления высокодифференцированных опухолей, расположенных в пределах простаты. С учетом этих обстоятельств возникает вопрос о влиянии ПСА-скрининга на смертность от РПЖ. Опубликованные данные наиболее крупных исследований в рассматриваемой области PLCO и ERSPC показали неоднозначные результаты [3]. Согласно Кокрановскому обзору, в который вошло 5 рандомизированных контролируемых исследований, скрининг не влияет на раково-специфическую выживаемость [4].
Подобные работы не подразумевают отказ от программы ПСА-скрининга РПЖ. Речь идет об оптимизации стратегии раннего выявления данного заболевания. Тем не менее смысл совершенно ясен – следует по возможности свести к минимуму случаи гипердиагностики. Эта проблема также усугубляется тем, что существует ряд доброкачественных состояний, имитирующих аденокарциному простаты. В свете растущего числа выполняемых биопсий простаты как следствия ПСА-скрининга проблема канцеромимикрии приобретает все большую актуальность. Среди различных морфологических типов РПЖ абсолютно подавляющее большинство принадлежит аденокарциноме, поэтому в дальнейшем речь будет идти о дифференциальной диагностике именно с данным типом злокачественных новообразований.
К главным диагностическим критериям для постановки диагноза «аденокарцинома простаты» относятся нарушение клеточной архитектоники, отсутствие слоя базальных клеток, наличие видимых ядрышек, а также изменения тинкториальных свойств клеток ацинусов. Существует также ряд дополнительных критериев, свидетельствующих об аденокарциноме простаты, – фигуры митоза, наличие эозинофильных включений, кристаллоидов, базофильного муцина в просвете желез и ряд других.
Для оценки степени дифференцировки аденокарциномы простаты используется шкала Глисона, в основе которой лежит оценка тканевой атипии с использованием малого и среднего увеличения.
 Наиболее часто дифференциальную диагностику с мелкоацинарной аденокарциномой приходится проводить в случае атрофии (полной или частичной), постатрофической гиперплазии, аденоза, а также при наличии в исследуемом материале ткани семенных пузырьков.
Наиболее часто дифференциальную диагностику с мелкоацинарной аденокарциномой приходится проводить в случае атрофии (полной или частичной), постатрофической гиперплазии, аденоза, а также при наличии в исследуемом материале ткани семенных пузырьков.
Атрофия
Атрофия простатических желез – довольно распространенный процесс у пожилых мужчин, однако может также встречаться среди пациентов более молодого возраста. Атрофия часто ассоциирована с хроническим воспалением в простате. Кроме того, атрофия может быть результатом лучевой и антиандрогенной терапии. Данное явление чаще всего наблюдается в периферической зоне простаты.
Различают четыре формы атрофии: дольковую (простую), склеротическую, кистозную и линейную [5]. Зачастую отмечается сочетание этих форм. В случае простой атрофии мелкие железы объединены в округлой формы гнезда. При склеротической атрофии между мелкими железами расположены в большом количестве волокна стромы, в результате чего ацинусы имеют угловатую, неправильную форму. Для кистозной атрофии характерна дилатация ацинусов. При этом рядом, как правило, располагаются более характерные для атрофии железы. Наконец при линейной атрофии мелкие, темные ацинусы располагаются в линию, создавая впечатление проникновения в строму.
Несмотря на различия в клеточной архитектуре, отличительные черты самих клеток схожи. При атро- фии клетки уменьшены в размерах, сжатые и темные. Ядерно-цитоплазматическое отношение высокое, однако ядерная мембрана правильной формы, а изменения ядерного хроматина отсутствуют. Также нет видимых ядрышек. Базальные клетки обычно присутствуют, но базальный слой может быть прерывистым.
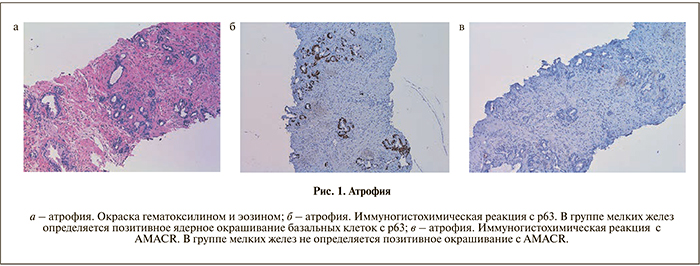
Главными отличиями атрофии от мелкоацинарной аденокарциномы служит частично сохраненное дольковое строение, особенно заметное при малом увеличении, одинаковое строение клеток, а также отсутствие видимых ядрышек. В ряде случаев, таких как сочетание с явлениями воспаления при малом количестве подозрительных фокусов, а также наличие клеточных изменений, характерных для лучевой терапии, постановка правильного диагноза может вызывать значительные затруднения. В этой ситуации следует прибегнуть к использованию красителей, содержащих высокомолекулярные антитела к цитокератину (34bE12), p63 (рис. 1).
Постатрофическая гиперплазия
Постатрофическая гиперплазия – довольно редкий гистологический процесс. Чаще всего трудно сказать, является ли постатрофическая гиперплазия результатом атрофии предшествующей гиперплазии ацинусов (частичная атрофия) или же, наоборот, произошла гиперплазия атрофических ацинусов (гиперпластическая атрофия). Тем не менее вне зависимости от генеза наблюдается комбинация атрофических ацинусов, а также ацинусов с объемной, светлой или амфофильной цитоплазмой, которая создает видимость гиперплазии. Дольковое строение обычно сохранено. Кроме того, наблюдается отпочкование «неоацинусов», которые выстилают клетки кубической формы со светлой цитоплазмой. Иногда может иметь место увеличение ядер.
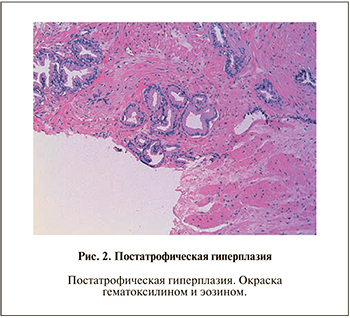
Своеобразная архитектоника постатрофической гиперплазии в ряде случаев может напоминать мелкоацинарную аденокарциному. Стоит отметить, что практически во всех случаях базальный слой клеток сохранен. Наличие ядрышек у значительного числа клеток также не характерно для постатрофической гиперплазии. Однако базальный слой может быть прерывистым, а в редких случаях могут выявляться кристаллоиды или небольшое количество голубого муцина. В связи с этим во всех неясных ситуациях следует прибегать к иммуногистохимическим методам исследования (рис. 2).
Аденоз
Аденоз, или атипическая аденоматозная гиперплазия, – это патологический процесс, для которого характерно наличие скоплений мелких ацинусов, образующих округлой формы узлы, что в свою очередь может симулировать мелкоацинарную аденокарциному. Аденоз чаще всего наблюдается в материале, полученном после трансуретральной резекции простаты или радикальной простатэктомии, хотя иногда он встречается в материале биопсии простаты. Фокус аденоза чаще всего имеет диаметр менее 5 мм и представлен скоплением относительно мелких ацинусов, незначительно отличающихся по форме и размеру, которые, как правило, локализуются рядом с гиперплазированными ацинусами. Сами ацинусы расположены близко друг от другу, но тенденции к слиянию нет. Эпителиоциты по форме могут быть кубическими или цилиндрическими с незначительно или умеренно выраженной эозинофилией. Слой базальных клеток в большинстве случаев прерывистый. Граница клеток со стороны просвета желез неровная или зубчатая. Просветы ацинусов обычно пусты, но могут содержать амилоидные тельца, эозинофильные кристаллоиды, а также базофильный муцин. Ядра, как правило, овальные или круглые, содержат однородный хроматин. Ядрышки встречаются редко, однако они чаще небольших размеров.
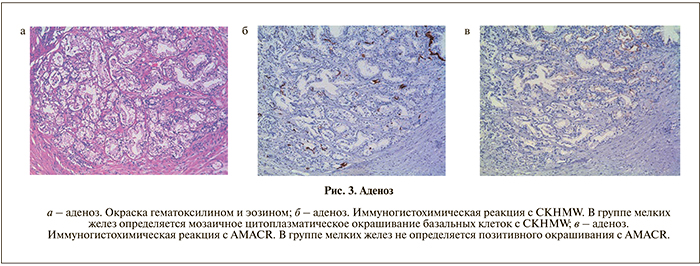
Главными отличиями от аденокарциномы считаются отсутствие больших ядрышек, частично сохраненный слой базальных клеток, а также неровная внутренняя граница ацинусов. Как и в предыдущих случаях, при возникновении сомнений в правильности заключения следует использовать иммуноги- стохимические методы диагностики (рис. 3).
Ткань семенных пузырьков
При выполнении биопсии простаты в материал биоптата может попасть фрагмент семенных пузырьков. Морфологически ткань семенных пузырьков представляет собой ветвящиеся мелкие железы, окруженные гладкой мышечной тканью, что может напоминать аденокарциному, особенно при касательном направлении биопсийной иглы. К отличительным особенностям от мелкоацинарной аденокарциномы относится наличие ядерной гиперхромазии и плеоморфизма. В цитоплазме клеток семенных пузырьков также присутствует пигмент липофусцин. Следует помнить, что липофусцин может наблюдаться и в клетках ацинусов простатических желез при простатической интраэпителиальной неоплазии (ПИН). При наличии трудностей в постановке заключения иммуногистохимическая окраска на предмет наличия ПСА и простатической кислой фосфатазы позволяет правильно идентифицировать тканевую принадлежность.
 Следует также обратить внимание, что семявыбрасывающий проток по строению во многом схож с семенным пузырьком. Присутствие аденокарциномы в ткани семявыбрасывающего протока не говорит об экстрапростатическом росте опухоли, тогда как инвазия в семенные пузырьки свидетельствует о более высокой стадии опухолевого роста. Главным отличием строения семявыбрасывающего протока является отсутствие хорошо сформированного слоя гладкой мускулатуры, характерного для стенки семенного пузырька.
Следует также обратить внимание, что семявыбрасывающий проток по строению во многом схож с семенным пузырьком. Присутствие аденокарциномы в ткани семявыбрасывающего протока не говорит об экстрапростатическом росте опухоли, тогда как инвазия в семенные пузырьки свидетельствует о более высокой стадии опухолевого роста. Главным отличием строения семявыбрасывающего протока является отсутствие хорошо сформированного слоя гладкой мускулатуры, характерного для стенки семенного пузырька.
Светлоклеточная крибриформная гиперплазия
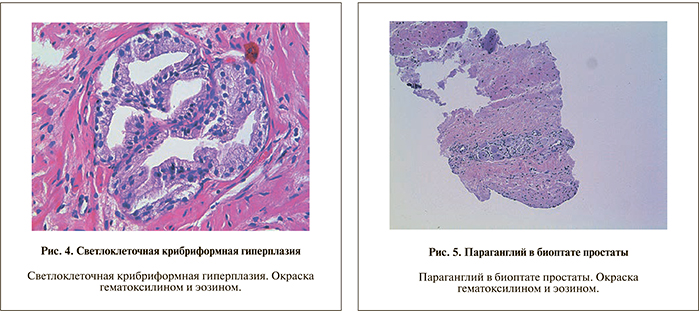
При доброкачественной гиперплазии нередко выявляется незначительное количество желез крибриформного строения. В редких случаях возможно преобладание последних в гистологической картине. Гистологическая картина может напоминать криброзные (решетчатые) структуры, характерные для аденокарциномы 4-й степени дифференцировки по шкале Глисона. Для крибриформной гиперплазии характерна пролиферация доброкачественных мелких клеток без явлений клеточной атипии. В большинстве случаев клетки крибриформных желез имеют светлую цитоплазму и в железах определяются одинаковые округлые просветы. При малом увеличении определяется равномерная узловая группировка желез в окружающей строме. Видимые ядрышки, а также признаки ядерной атипии отсутствуют. По периферии определяется хорошо различимый слой базальных клеток. Описанные выше признаки позволяют дифференцировать дан- ное образование от аденокарциномы (рис. 4).
Базальноклеточная гиперплазия
Базальноклеточная гиперплазия представляет собой один из вариантов доброкачественной гиперплазии простаты. Она обычно локализуется в переходной зоне простаты, однако может также встречаться и в периферической зоне, поэтому чаще всего базальноклеточную гиперплазию обнаруживают в материале, полученном в ходе трансуретральной резекции простаты, нежели биопсии предстательной железы.
Базальноклеточная гиперплазия может быть полной и частичной. При полной форме просвет ацинусов отсутствует, а темно-синие клетки базального слоя группируются в виде небольших гнезд округлой формы. При неполной форме просвет ацинусов частично сохранен, определяются эпителиоциты со светлой цитоплазмой, окруженные несколькими слоями базальных клеток. Неполная форма также получила название кистозной базальноклеточной гиперплазии. В обоих случаях базальные клетки имеют одинаковые форму и размер, темный цвет, скудную цитоплазму и круглое, овальное или реже веретеновидное гиперхроматическое ядро. Ядрышки, как правило, отсутствуют.
Узловая организация, наличие сопутствующей доброкачественной гиперплазии, единообразие клеток и отсутствие видимых ядрышек позволяет в большинстве случаев отличить базальноклеточную гиперплазию от аденокарциномы простаты. Определенные трудности могут возникать при выполнении биопсии простаты, когда в столбик ткани может попасть лишь фрагмент фокуса базальноклеточной гиперплазии. В этом случае следует прибегнуть к окраске на высокомолекулярный цитокератин (34bE12), p63.
Параганглий
Параганглий может встречаться в ткани простаты, однако чаще всего он расположен в перипростатических тканях. Для параганглия характерно наличие маленьких, солидных гнезд, состоящих из клеток с прозрачной или амфофильной цитоплазмой. При этом группы клеток, как правило, разъединены тонкой сетью капилляров. Ядра часто гиперхроматические, но ядрышки и другие признаки аденокарциномы отсутствуют. Ткань параганглия может напоминать слившиеся железы, характерные для аденокарциномы 4-й градации по Глисону. Стоит отметить, что наиболее часто параганглий выявляют в удаленной простате, тогда как в материале биопсии простаты параганглий встречается редко. Поэтому ошибка в диагностике чаще приводит к неверному стадированию опухолевого процесса, если расположенный в перипростатических тканях параганглий будет принят за аденокарциному. Кроме того, если параганглий принять за аденокарциному 4-й степени по Глисону, то это также может ошибочно завысить суммарный балл. В сложных случаях следует обратиться за помощью к иммуногистохимическому методу диагностики (ПСА, кислая простатическая фосфатаза, S100) (рис. 5).

Ксантогранулематозный простатит (ксантома)
Скопление наполненных липидами макрофагов («пенистых» клеток) в ткани простаты может напоминать гипернефроидный вариант аденокарциномы (Глисон 4). Гистиоциты имеют небольшие ядра с едва заметными ядрышками. Как правило, гистиоциты располагаются вместе с другими клетками, характерными для воспалительного процесса (нейтрофилы, лимфоциты), однако они могут доминировать в гистологической картине, что значительно затрудняет диагностику. Ситуация также усугубляется тем, что при некоторых вариантах гипернефроидной аденокарциномы отсутствуют признаки ядерной атипии (ядра темные и маленькие, ядрышки отсут- ствуют). Основное значение придается иммуноги стохимической окраске на цитокератин, ПСА, а также специальным красителям гистиоцитов (CD 68).
Воспаление и неспецифический гранулематозный простатит
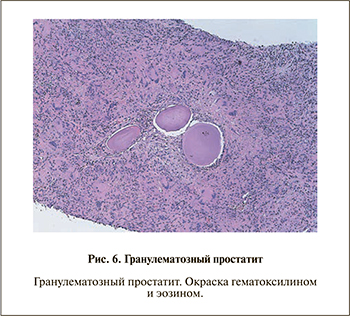
Зачастую в биоптатах простаты встречаются участки хронического воспалительного процесса, выраженность которого может не коррелировать с клинической картиной. При наличии артефактов, связанных с забором, транспортировкой и приготовлением материала, а также при выраженной воспалительной инфильтрации гистологическая картина может напоминать аденокарциному 5-й градации по Глисону, в особенности в случае солидного и рассыпного роста. Чаще всего удается установить воспалительную природу клеток, однако в сложных случаях следует прибегать к иммуногистохимиче- ской окраске на панцитокератин, ПСА, а также лимфогистиоцитарные маркеры (рис. 6).
Железы Купера
Бульбоуретральные (железы Купера) расположены за пределами простаты, но в биоптате могут быть перепутаны с аденокарциномой. Эти железы впервые были описаны Купером [5]. Они расположены в урогенитальной диафрагме – непосредственно под предстательной железой, латеральнее мембранозного отдела уретры. Железы Купера у взрослого мужчины представляют собой небольшие структуры размером 10х6х5 мм. Они могут быть случайной находкой в биоптатах простаты и ткани простаты после трансуретральной резекции. Микроскопически Куперовские железы имеют вид тубулоальвеолярных структур, состоящих из ацинусов, дуктул и экскреторных протоков. В биоптатах их можно заподозрить при выявлении рядом скелетной мускулатуры. Ацинусы состоят из слоя базальных и цилиндрических клеток, содержащих муцин, а в протоках и дуктулах эпителий уплощенный. Базальные клетки в ацинусах при окраске гематоксилином и эозином не определяются. Гистохимически слизь в клетках выявляется окраской на муцикармин, реакцией на ПАС с диастазой и окраской на альциановый синий. Данные по поводу иммуногистохимического фенотипа желез противоречивы. В одних исследованиях железы Купера демонстрируют позитивную реакция на ПСА, в других – нет. Базальные клетки продуцируют высокомолекулярные цитокератины, а также антитела к гладкомышечному актину, что предполагает миоэпителиальную дифференцировку. Железистые клетки не продуцируют АМАCR. Самая главная проблема состоит в дифференциальной диагностике с высокодифференцированной аденокарциномой (паттерн 3). Как железы Купера, так и аденокарцинома состоят из мелких ацинусов. Наличие экскреторного протока говорит в пользу желез Купера, однако он не всегда определяется. В подобных ситуациях могут помочь иммуногистохимические реакции с высокомолекулрным цитокератином и гладкомышечным актином.
Заключение. В данной статье представлены наиболее распространенные доброкачественные процессы, которые могут симулировать аденокарциному простаты различной степени злокачественности. Знание о наличии подобных канцеромимикрий, а также внимательное изучение микропрепаратов в большинстве случаев позволяют прийти к верному заключению. В случае возникновения затруднений следует использовать иммуногистохимический метод диагностики, результаты которого позволяют чаще всего однозначно говорить о природе патологического процесса. Важность дифференциального диагноза особенно актуальна при анализе биоптатов простаты, полученных в результате биопсии, так как ложноположительный результат может обусловить проведение ненужного и чрезмерного лечения (рис. 7).
Выполняется при поддержке гранта Российского научного фонда (РНФ), номер проекта 14-15-01120.



