Введение. По данным Европейской ассоциации урологов около 15% пар в течение года не достигают беременности, из них около 5% остаются бездетными, несмотря на лечение [1]. В 3,1–40,0% случаев нарушения мужской репродуктивной функции вызваны аутоиммунными реакциями против сперматозоидов, при которых происходит образование антиспермальных антител (АСАТ) [2–6]. В случае, когда все сперматозоиды покрыты АСАТ, вероятность зачатия снижается в 6,5 раза [7]. Впервые антигенные свойства спермы выявил И. И. Мечников в конце XIX в. [8]. Считается, что АСАТ слабо влияют на качественные показатели спермы [9, 10], но есть убедительные данные, согласно которым у больных с аутоиммунным бесплодием часто встречается астенозооспермия [11]. Необходимо отметить, что четкой корреляции между повышением количества сперматозоидов с АСАТ и такими показателями спермы, как подвижность и количество сперматозоидов, не выявлено [9], при том что при нормозоо- спермии нередко выявляется более 50% подвижных сперматозоидов, покрытых АСАТ [5, 7].
 По данным литературы, более десяти факторов могут стать причиной развития антиспермального иммунитета. Наиболее частые из них — травма и перекрут яичка, орхоэпидидимит, варикоцеле, эпидемический паротит, осложненный орхитом, врожденная или приобретенная обструкция семявыносящих путей, крипторхизм и рак яичка [3, 10, 13–19]. Можно считать доказанной роль Mycoplasma, Ureaplasma, Chlamydia в развитии аутоиммунного мужского бесплодия [4, 6, 7, 10, 20]. Имеется сообщение о влиянии вируса папилломы человека на образование АСАТ [11]. По некоторым данным, не вызывает образования АСАТ такие заболевания, как рак и доброкачественная гиперплазия предстательной железы [21]. До сих пор считается спорной связь между образованием АСАТ и другими неспецифическими воспалительными заболеваниями репродуктивного тракта [22], однако доказана молекулярная мимикрия между антигенами сперматозоидов и антигенами таких микроорганизмов, как St. aureus, E. coli, P. aeruginosa, P. mirabilis [23]. По мнению некоторых авторов, аутоиммунные реакции против сперматозоидов не характерны для бактериального хронического простатита, но способность некоторых микроорганизмов прикрепляться к мембране мужских гамет может обусловить образование АСАТ [4]. Нарушение целостности структурных компонентов гематотестикулярного барьера, обеспечивающего иммунологическую привилегированность тестикулярной ткани, является одним из основных механизмов развития аутоиммунных реакций против собственных сперматозоидов. В результате этого антигенпредставляющие клетки получают доступ к аутоантигенам развивающихся сперматогенных клеток, инициируя иммунный ответ [4, 6, 24, 25].
По данным литературы, более десяти факторов могут стать причиной развития антиспермального иммунитета. Наиболее частые из них — травма и перекрут яичка, орхоэпидидимит, варикоцеле, эпидемический паротит, осложненный орхитом, врожденная или приобретенная обструкция семявыносящих путей, крипторхизм и рак яичка [3, 10, 13–19]. Можно считать доказанной роль Mycoplasma, Ureaplasma, Chlamydia в развитии аутоиммунного мужского бесплодия [4, 6, 7, 10, 20]. Имеется сообщение о влиянии вируса папилломы человека на образование АСАТ [11]. По некоторым данным, не вызывает образования АСАТ такие заболевания, как рак и доброкачественная гиперплазия предстательной железы [21]. До сих пор считается спорной связь между образованием АСАТ и другими неспецифическими воспалительными заболеваниями репродуктивного тракта [22], однако доказана молекулярная мимикрия между антигенами сперматозоидов и антигенами таких микроорганизмов, как St. aureus, E. coli, P. aeruginosa, P. mirabilis [23]. По мнению некоторых авторов, аутоиммунные реакции против сперматозоидов не характерны для бактериального хронического простатита, но способность некоторых микроорганизмов прикрепляться к мембране мужских гамет может обусловить образование АСАТ [4]. Нарушение целостности структурных компонентов гематотестикулярного барьера, обеспечивающего иммунологическую привилегированность тестикулярной ткани, является одним из основных механизмов развития аутоиммунных реакций против собственных сперматозоидов. В результате этого антигенпредставляющие клетки получают доступ к аутоантигенам развивающихся сперматогенных клеток, инициируя иммунный ответ [4, 6, 24, 25].
Антиспермальные антитела нарушают функциональную целостность мембраны сперматозоидов, проницаемость мембраны для воды и как следствие – для кальция, препятствуют продвижению сперматозоидов и их проникновению через цервикальную слизь, блокируют рецепторные участки на головке сперматозоида, ответственные за связывание с блестящей оболочкой, нарушают акросомальную реакцию, оказывают повреждающее действие на предстательную железу [10, 15, 26, 27].
 В настоящее время с целью клинической диагно-
стики аутоиммунного мужского бесплодия предпочтение отдается методам определения АСАТ, адгезированных на поверхности сперматозоидов [4, 28, 29], поэтому одним из наиболее чувствительных и информативных в прогнозе фертильности считается mixed agglutination reaction (MAR)-test [30, 31].
В настоящее время с целью клинической диагно-
стики аутоиммунного мужского бесплодия предпочтение отдается методам определения АСАТ, адгезированных на поверхности сперматозоидов [4, 28, 29], поэтому одним из наиболее чувствительных и информативных в прогнозе фертильности считается mixed agglutination reaction (MAR)-test [30, 31].
Согласно данным ВОЗ (2010) и приказу Министер- ства здравоохранения РФ № 107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» от 30.08.2012, наличие в сперме более 50% подвижных сперматозоидов, покрытых АСАТ, наряду с такими нарушениями спермограммы, как тяжелые формы тератозооспермии, олигозооспермии и астенозооспермии, является показанием к вспомогательным репродуктивным технологиям (ВРТ), при этом эффективным методом принято считать только интрацитоплазматическую инъекцию сперматозоида (ICSI). Это обусловлено отсутствием эффективных консервативных методов лечения, позволяющих снижать количество АСАТ на сперматозоидах [12]. Однако мы имеем опыт успешного консервативного лечения 92,46% пациентов с аутоиммунным бесплодием препаратом лонгидаза, на основании которого получен патент № 2430725 «Способ лечения аутоиммунного мужского бесплодия» от 10.10.2011 [32]. По некоторым данным, обструкция семявыносящих протоков и хроническое асимптоматическое воспаление в предстательной железе считаются наиболее часто встречающейся патологией у мужчин с аутоиммунным бесплодием [33]. В последнее время доказано, что лонгидаза достоверно способствует исчезновению или уменьшению симптомов хронического простатита и регресса воспалительно-пролиферативных изменений в предстательной железе [34].
Материалы и методы. Под нашим наблюдением находились 72 пациента, обратившихся в урологическую клинику ИвГМА с 2010 по 2014 г. по поводу бесплодия и сопутствующего хронического простатита категории 4, которым планировалось проведение экстракорпорального оплодотворения (ICSI), при этом в паре использовалась барьерная контрацепция на протяжении трех месяцев лечения, после чего последняя была отменена. У всех пациентов выявлено содержание сперматозоидов, покрытых АСАТ классов IgG и/или IgA, более 50% по методике определения антиспермальных антител IgG% и IgA% на поверхности подвижных сперматозоидов с использованием латексных частиц MAR-test (прямой тест MarScreen). У всех пациентов в анамнезе был хронический простатит, подтвержденный данными трансректального УЗИ. На момент проведения исследования клинические проявления простатита отсутствовали, у 8 (13,33%) пациентов отмечена пограничная лейкоспермия (1 млн лейкоцитов в мл), ни у одного пациента не было значимой бактериоспермии (более 103 КОЕ/мл).
Из исследования были исключены пациенты, получавшие терапию иммуномодуляторами, вобэнзимом, глюкокортикостероидами в течение последних трех месяцев; страдающие психическими заболеваниями, почечной, печеночной недостаточностью; имеющие поражения ЦНС; принимающие препараты, влияющие на качество спермы, в течение последних двух месяцев. Все пациенты в течение последнего месяца не получали медикаментозного лечения хронического простатита.
В основную группу вошли 60 пациентов, получавших лонгидазу 3000 МЕ внутримышечно 2 раза в неделю, на курс – 25 инъекций. В 7 (11,67%) случаях после двухнедельного перерыва был проведен повторный курс аналогичной продолжительности, так как IgG и IgA находились в диапазоне 35–49%. Группу контроля составили 12 мужчин, которые по различным причинам отказались от предложенного лечения и оставались под динамическим наблюдением. Анализ спермы выполнялся согласно рекомендациям ВОЗ [14]. Контрольные спермограммы и MAR-test выполнялись ежемесячно. В контрольной группе пациенты на протяжении динамического наблюдения не получали никакого лечения от 6 до 12 мес, в среднем – 11 мес.
Статистический анализ проводили с использованием пакета прикладных программ Statistica 8.0, Exel 2010. Достоверность полученных данных анализировали с использованием критерия знаков. Данные представлены в виде медианы (интерквартильный размах).
Результаты. Средний возраст пациентов основной группы составил 35,55 (25–53) года, контрольной — 36,42 (27–43). Группы были сопоставимыми по возрасту, проценту АСАТ IgA и/или IgG на подвижных сперматозоидах, всем установлен хронический простатит категории 4. В основной группе изолированное повышение содержания IgA выявлено у 20 (33,33%) пациентов, IgG – у 10 (16,67%), одновременное повышение IgG и IgA наблюдалось у 30 (50%) мужчин. В контрольной группе сочетанное повышение IgG и IgA наблюдалось у 6 (50%) пациентов, а изолированное повышение IgG или IgA – по 3 человека соответственно.
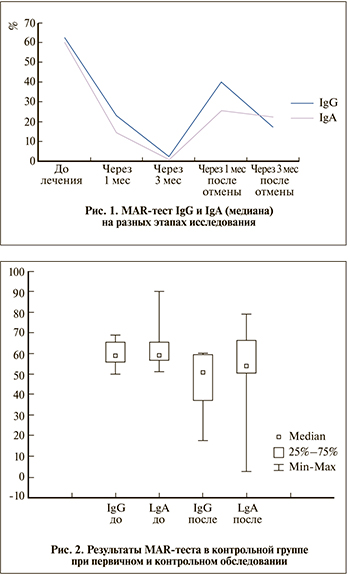
Как видно из табл. 1, рис. 1, в основной группе спустя 1 мес лечения произошло статистически значимое снижение уровня иммуноглобулинов обоих классов. Однако максимальное снижение содержания АСАТ наблюдалось к третьему месяцу лечения. У 1 (1,67%) пациента на фоне лечения АСАТ сохранялись выше 50%, однако при повторном курсе лонгидазы произошло снижение MAR-test по обоим иммуноглобулинам ниже 10%. При контрольном обследовании через 3 месяца после отмены лонгидазы только у 17 (28,33%) мужчин отмечено повышение АСАТ IgG и(или) IgA более 50%, у остальных пациентов АСАТ оставались статистически значимо ниже исходных значений.
Оценка результатов MAR-теста в группе динамического наблюдения показала, что IgG незначительно снизился с 59,0 (56–65%) до 50,5% (37–59%), а уровень IgA с 59 (57–65%) до 54% (50,5–66%), что оказалось статистически недостоверно (р=0,18).
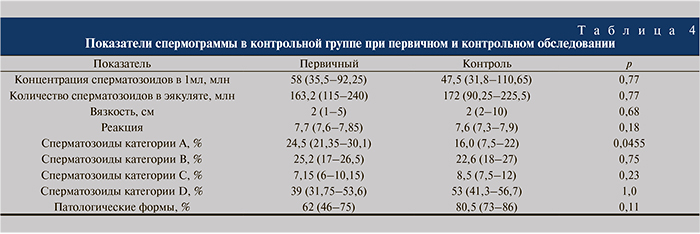
При анализе спермограмм (табл. 2, 3) учитывали концентрацию сперматозоидов в 1 мл и в эякуляте, морфологию, подвижность, pH, время разжижения, вязкость, наличие агглютинации, концентрацию лейкоцитов.
Нами выявлено клинически незначимое, так как не выходило за пределы нормы, но статистически достоверное изменение общего количества сперматозоидов в первые месяцы лечения, при более длительном лечении достоверность не прослеживалась, что, вероятнее всего, связано с сезонными или эмоциональными колебаниями этих показателей спермограммы. Частота агглютинации до лечения составила – 52,83%, через 1 мес лечения – 37,5% (p=0,28), через 3 мес – 26,09%, что является стати- стически значимым изменением (p=0,03). Отмечено статистически значимое уменьшение числа сперматозоидов категории С к третьему месяцу лечения, это, по-видимому, связано со снижением агглютинации в сперме. Пограничная лейкоспермия через 1 мес лечения отмечена только у 1 (1,67%) пациента. Другие изменения в показателях спермограммы оказались статистически не значимыми (р>0,05). В основной группе за время наблюдения после окончания лечения у 6 (10%) пар наступила спонтанная беременность, 3 (5%) выполнено удачное ЭКО, а 51 пара продолжала ждать очереди на ВРТ.
В контрольной группе за время как минимум шести месяцев наблюдения ни в одной паре спонтанных беременностей не наступило, они продолжали ждать квоту на ICSI.
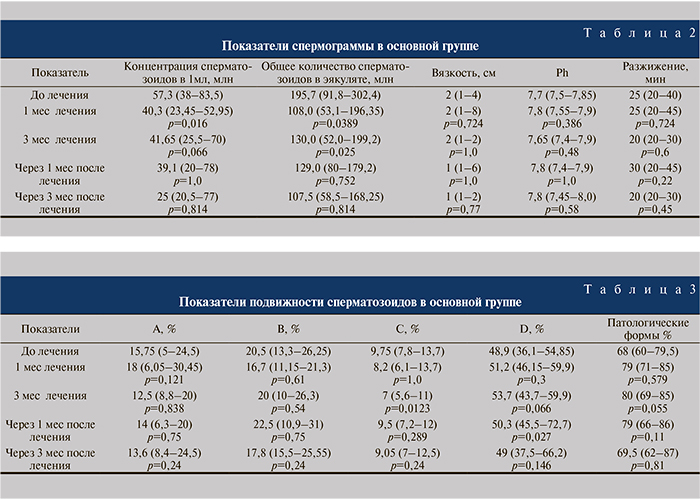
При оценке аналогичных показателей спермограмм в контрольной группе (табл. 4) выявлено достоверное снижение концентрации сперматозоидов категории А, что, вероятно, обусловлено негативным влиянием АСАТ на подвижность сперматозоидов. В контрольной группе исходная частота агглютинации наблюдалась у 4 (30%) пациентов, при контрольном обследовании – у 5 (41,67%).
На протяжении всего курса лечения лонгидазой не было отмечено ни одного случая развития побочных реакций или аллергических проявлений.
Обсуждение. Проведенная терапия лонгидазой по 3000 МЕ внутримышечно 2 раза в неделю в течение 3 месяцев (25 инъекций) позволила достоверно снизить количество АСАТ класса IgG и (или) IgA на сперматозоидах до нормальных значений. Снижение уровня АСАТ на фоне лечения лонгидазой вялотекущего воспалительного процесса в простате и отсутствие его повышения после отмены терапии большинству пациентов, по нашему мнению, демонстрируют роль хронического простатита категории 4 в развитии аутоиммунного бесплодия у мужчин. Выраженное снижение АСАТ как IgG, так и IgA способствует повышению фертильности спермы, так как позволяет обеспечивать наступление беременности в естественном цикле и увеличивает количество удачных попыток ВРТ. Указанный эффект, по-видимому, связан с ферментативной (гиалуронидазной) активностью, иммуномодулирующими, антиоксидантными и умеренными противовоспалительными свойствами лонгидазы. Гиалуронидаза комплексно воздействует на склеротические, измененные вследствие воспаления ткани как непосредственно предстательной железы, так и репродуктивного тракта в целом. Специфическим субстратом гиалуронидазы являются гликозаминогликаны (гиалуроновая кислота, хондроитин, хондроитин-4-сульфат. хондроитин-6-сульфат) – «цементирующее» веще- ство соединительной ткани. В результате гидролиза (деполимеризации) уменьшается вязкость гликозаминогликанов, способность связывать воду и ионы металлов. Как следствие – увеличивается проницаемость тканей, улучшается их трофика, нормализуется проницаемость гематотестикулярного барьера, облегчается движение жидкости в межклеточном пространстве.
Однако препараты на основе гиалуронидазы в лечении патологических состояний соединительной ткани недостаточно эффективны, так как при парентеральном пути введения быстро инактивируются ингибиторами сыворотки крови, кроме того, довольно часто вызывают аллергические реакции.
Принципиально новый препарат – лонгидаза (официальная инструкция) представляет собой конъюгат протеолитического фермента гиалуронидазы с высокомолекулярным носителем группы производных N-оксида поли-1,4-этиленпиперазина. Лонгидаза обладает всем спектром фармакологических свойств, присущих лекарственным сред- ствам с гиалуронидазной активностью. Клинический эффект лонгидазы значительно выше, чем эффект нативной гиалуронидазы. Конъюгация повышает устойчивость фермента к действию температуры и ингибиторов, увеличивает его активность и обеспечивает пролонгированное действие. Помимо этого в препарате сохраняются и фармакологические свойства носителя, обладающего хелатирующей, антиоксидантной, противовоспалительной и иммуномодулирующей активностью. Лонгидаза способна связывать освобождающиеся при гидролизе гликозаминогликанов ионы железа – активаторы свободнорадикальных реакций, ингибиторы гиалуронидазы и стимуляторы синтеза коллагена, и тем самым подавлять обратную реакцию, направленную на синтез компонентов соединительной ткани. Политропные свойства лонгидазы реализуются в выраженном противофиброзном действии, экспериментально доказанном биохимическими, гистологическими и электронно-микроскопическими исследованиями. Лонгидаза относится к практически нетоксическим соединениям, не нарушает нормального функционирования иммунной системы, не оказывает мутагенного и канцерогенного действия.
Таким образом, считаем необходимым назначать пациентам с хроническим простатитом категории 4 и повышенным уровнем АСАТ лонгидазу в качестве высокоэффективного патогенетического средства для лечения аутоиммунного бесплодия.



