Введение. Внутренний мочеточниковый jj-стент оперирующими хирургами рассматривается как приоритетный вариант дренирования верхних мочевыводящих путей, кроме того, он лучше воспринимается пациентами, например, по сравнению с нефростомой. Урологические осложнения отмечаются у 3,7–15,5% реципиентов ренальных трансплантатов, из них до 70% составляют нарушения проходимости мочеточника в результате его стриктуры или некроза [1–5]. Частота потери трансплантата в этой группе пациентов достигает 70%, а смертность – 29,4% [4, 6]. В абсолютном большинстве трансплантационных центров с целью профилактики описанных осложнений прибегают к превентивному стентированию трансплантата внутренним jj-стентом в 76–100% наблюдений [1, 2, 7].
К недостаткам внутренних мочеточниковых jj-стентов следует отнести обструкцию просвета, персистенцию мочевой инфекции за счет образования биофильмов, рефлюкс и развитие ирритативной симптоматики [8–13]. Причем первые два наиболее грозные в плане развития локальных и системных инфекционных осложнений, а также воспалительных стриктур мочеточника и уретероцистоанастомоза. Перспективным способом снижения бактериальной и солевой адгезии к поверхности стента служит использование различных вариантов биодеградирующих и бактерицидных покрытий [3, 12, 14–19].
 Материал и методы. Проведено многоцентровое рандомизированное двойное слепое сравнительное в параллельных группах клиническое исследование эффективности и безопасности внутрипросветного дренирования верхних мочевыводящих путей мочеточниковыми стентами с наноструктурным покрытием (протокол № 3/14 заседания Локального независимого этического комитета ГБОУ ВПО РостГМУ от 13.02.2014; протокол № 2 заседания Локального этического комитета ОГБУЗ «БОКБ Святителя Иоасафа» от 07.02.2014).
Материал и методы. Проведено многоцентровое рандомизированное двойное слепое сравнительное в параллельных группах клиническое исследование эффективности и безопасности внутрипросветного дренирования верхних мочевыводящих путей мочеточниковыми стентами с наноструктурным покрытием (протокол № 3/14 заседания Локального независимого этического комитета ГБОУ ВПО РостГМУ от 13.02.2014; протокол № 2 заседания Локального этического комитета ОГБУЗ «БОКБ Святителя Иоасафа» от 07.02.2014).
Наноструктурное покрытие нанесено на поверхность полиуретановых стентов в НИЛ ионно-плазменных технологий ФГАОУ ВПО НИУ БелГУ. Для получения покрытия использован импульсный вакуумно-дуговой метод. В качестве катода применяли особо чистый графит с добавлением серебра. Исследовали покрытия толщиной 30–50 нм. Для их оценки использованы методики электронной просвечивающей микроскопии (TEM), в том числе электронной просвечивающей микроскопии высокого разрешения (HRTEM) на просвечивающем электронном микроскопе высокого разрешения Tecnai G2 F20 S-TWIN. Элементный состав покрытия исследован методом энергодисперсионной рентгеновской спектроскопии (EDX) на том же микроскопе. Анализ результатов электронно-микроскопических исследований показал, что получено наностуктурное покрытие. На рисунке приведено электронно-микроскопическое изображение наноструктурного покрытия на основе углерода с добавлением серебра. Включения более темного цвета представляют собой нанокластеры серебра размером 20–40 нм на более светлом фоне матрицы аморфного углерода. Среднее содержание серебра в покрытии, полученном методом энергодисперсионной рентгеновской спектроскопии, составило 3–5%. Покрытие на основе матрицы из аморфного углерода и нанокристаллитов серебра прошло доклинические исследования и независимую токсикологическую экспертизу «Токсикологическое заключение N 169-13 от 13.12.2013». Доклиническое исследование выявило преимущества исследуемого покрытия перед непокрытыми стентами, которые выражались в лучших показателях инертности, меньшей солевой адгезии и риске микробной контаминации.
В качестве контрольного использован мочеточниковый стент универсальной длины 6–14 см диаметром 6 Сh. На поверхность аналогичных стентов основной группы нанесено экспериментальное наноструктурное покрытие на основе матрицы из аморфного углерода и нанокристаллитов серебра. Стенты и системы доставки изготовлены, упакованы и стерилизованы в условиях сертифицированного технологического производства ООО «Минимально-инвазивные технологии» (Железнодорожный, Московская обл.).
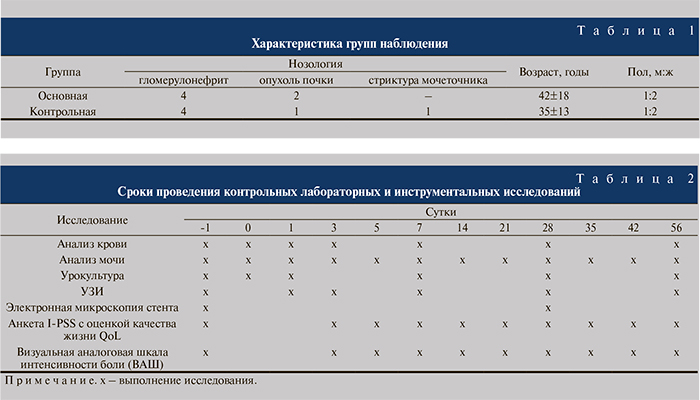
За период с февраля по июнь 2014 г. имплантировано 12 стентов в ренальные трансплантаты. Из них 8 родственных аллотрансплантаций выполнено пациентам с терминальной стадией ХПН на фоне гломерулонефрита, 3 – после экстракорпоральной резекции опухоли почки и 1 – пациентке с субтотальной травматической стриктурой мочеточника. Распределение пациентов и характеристика групп наблюдения приведены в табл. 1. Группы были сопоставимы по возрасту и полу, у больных отсутствовала выраженная кардиопульмональная и эндокринная патология.
Всем больным выполнен экстравезикальный уретероцистоанастомоз по Stazl. В течение 8 нед контролировали лабораторные показатели крови и мочи, выполняли УЗИ трансплантата и бактериологическое исследование мочи (табл. 2).
Степень выраженности ирритативной симптоматики, обусловленной наличием стента, оценивали на основании анкетирования по шкалам I-PSS (International Prostatic Symptom Score) с определением индекса качества жизни (QоL) и визуальной аналоговой шкалой интенсивности боли (ВАШ). Дренирование мочевого пузыря в послеоперационном периоде проведено катетером Фолея 20 Ch в течение 1 нед, стентирование мочеточника трансплантата – на протяжении 4 нед. Антибактериальную терапию – цефалоспорины IV поколения или карбапенемы назначали на срок 7 сут после операции, при наличии клинических показаний ее корригировали и продолжали до нормализации показателей мочи.
Статистическая обработка полученных результатов проведена с использованием электронных таблиц Microsoft Excel (2003) на операционной платформе Windows XP. При анализе данных совокупности рассчитаны средние показатели (средняя арифметическая [хср]; медиана [Ме]; мода [Мо]), абсолютные показатели вариации (размах вариации [R]; среднее линейное отклонение [dср]; дисперсию [σ2]; среднее квадратичное отклонение [σ]); квантильное отклонение Гальтона [Q=(Q3–Q1)/2]). Оценка характера распределения осуществлена по тестам на нормальность. Исследуемые показатели имели нормальное распределение, приведены в их среднем значении со средней квадратичной ошибкой (М±σ). Для установления статистической достоверности различий показателей основной и контрольной групп рассчитана вероятность по распределению Стьюдента и Фишера. При вероятности, превышающей 95%, различия считали статистически значимыми.
Результаты и обсуждение. Скрининговое дооперационное исследование не выявило инфекции мочевыводящих путей и воспалительных изменений осадка мочи у пациентов обеих групп наблюдения.
В послеоперационном периоде не отмечено инфекционно-воспалительных осложнений и таких ранних хирургических осложнений, как некроз мочеточника и несостоятельность пузырно-мочеточникового соустья. Аналгезию обеспечивали продленной перидуральной анестезией на протяжении 3–5 сут. Пациентов активизировали в 1-е сутки после операции. У всех прооперированных констатировали первичную функцию трансплантата, прогрессивное снижение азотемии в течение недели. Стенты в обеих группах наблюдения обеспечили адекватную дренажную функцию на протяжении всего периода стентирования (4 нед). Дилатация ЧЛС, на наш взгляд, обусловленная рефлюксом по стенту, имевшая место в течение 4 нед, была незначительной и статистически значимо в группах не различалась. Переднезадний размер лоханки в основной группе составил 15,2±4,7, в контрольной – 19,5±5,1 мм (р>0,05). Для исключения гидродинамической нагрузки на пузырно-мочеточниковый анастомоз рентгенологические и ультразвуковые исследования с наполненным мочевым пузырем не проводили.
К 8-й неделе исследования аналогичные ретенционные изменения, не сопровождающиеся повышением уровня азотемии, отмечены у 1 (16,7%) пациента основной группы и у 4 (66,7%) – контрольной. Показатели почечной гемодинамики не различались в исследуемых группах.
Показатели гемограммы были неспецифичными для всех пациентов в течение всего периода наблюдения. Аналогичная тенденция отмечена в общих анализах мочи: к 7-м суткам послеоперационного периода выраженность гематурии в основной группе составила 16,8±5,5∙106/мл, пиурии – 7,9±3,9∙106/мл, в контрольной – 15,1±6,8∙106/мл и 11,6±4,7∙106/мл соответственно (р>0,05). На этом сроке наблюдения бактериурия зарегистрирована у 2 (33,3%) пациентов основной и у 4 (66,6%) контрольной групп.
В дальнейшем в основной группе отмечено снижение количества форменных элементов в мочевом осадке: к 4-й неделе исследования содержание эритроцитов составило 6,8±2,6∙106/мл, лейкоцитов – 5,3±1,9∙106/мл.
В контрольной группе на этом сроке регистрировали персистенцию гематурии и пиурии, достоверно превысив показатели основной группы, составив 13,5±3,1∙106/мл и 15,6±6,1∙106/мл соответственно (р<0,05). Схожая картина к моменту удаления стента выявлена и при бактериологическом исследовании мочи: в основной группе бактериурия отсутствовала у всех пациентов, тогда как в контрольной положительные бактериологические посевы имели 5 (83,3%) больных. Все пациенты с сохраняющейся бактериурией получали антибактериальную терапию с учетом чувствительности флоры, что способствовало элиминации возбудителя к 8-й неделе у четырех пациентов контрольной группы, результаты бактериологического исследования в основной группе были отрицательными.
В раннем послеоперационном периоде болевой синдром был умеренным, связан с хирургическим доступом и его выраженность по ВАШ снизилась с 3,7±0,6 балла на 3-и сутки до 2,4±0,5 на 5-е сутки послеоперационного периода. К моменту удаления уретрального катетера (7-е сутки) пациенты отмечали лишь чувство дискомфорта в области послеоперационной раны. Основные жалобы были связаны с дизурией, средний балл по ВАШ на этом сроке наблюдения составил в основной и контрольной группах 3,3±0,5 и 3,8±0,7 соответственно (р>0,05). Статистически значимого снижения выраженности странгурии к 4-й неделе наблюдения (удаление стентов) отмечено не было, показатели по ВАШ составили 2,8±0,4 и 3,5±0,7 балла для основной и контрольной групп соответственно (р>0,05). Аналогичную тенденцию прослеживали при оценке выраженности симптомов нижних мочевыводящих путей на основании опросника I-PSS. Суммарный балл был высоким на протяжении всего периода стентирования, главным образом за счет ирритативной симптоматики, и составил в контрольных точках: 1-я и 4-я недели – для пациентов основной группы 17,1±3,8 и 14,2±3,4, для пациентов контрольной группы – 21,5±4,8 и 18,6±4,1 соответственно (р>0,05). Индекс качества жизни (QoL) на тех же сроках в основной группе составил 3,2±1,1 и 3,7±1,5 балла, в контрольной – 2,8±0,9 и 3,3±1,4 соответственно (р>0,05). Удаление стента способствовало купированию ирритативных симптомов в обеих группах. К 8-й неделе послеоперационного периода в основной группе суммарный балл по шкале I-PSS составил 3,5±1,9, по ВАШ – 0,8±0,5; индекс качества жизни увеличился до 4,2±0,7 балла, в контроле аналогичные показатели были несколько хуже: 7,3±3,2; 1,2±0,4 и 3,5±0,9 соответственно (р>0,05).
Результаты энергодисперсионной рентгеновской спектроскопии (EDX) на просвечивающем электронном микроскопе высокого разрешения Tecnai G2 F20 S-TWIN поверхности эксплантированных стентов основной группы свидетельствовали о снижении содержания серебра в среднем до 0,7–1,2%. Определялся рост содержания таких элементов, как кальций, магний и фосфор: их суммарное содержание составило 4,2–6,7%. В контроле зарегистрировано статистически значимое увеличение содержания данных элементов на поверхности стентов: суммарно – 15,6–22,9% (р<0,05). Это может указывать на более выраженные процессы солевой адгезии к поверхности полиуретанового стента.
Заключение. Внутренние стенты обеспечивают адекватный дренаж трансплантированной почки на протяжении 4 нед. На фоне наружного дренирования мочевого пузыря уретральным катетером развитие мочевой инфекции регистрировали в 33,3 и 66,7% случаев в основной и контрольной группах соответственно. Экспериментальное наноструктурное покрытие на основе матрицы из аморфного углерода и нанокристаллитов серебра в основной группе исключило бактериурию к 4-й неделе стентирования, что сопровождалось достоверно меньшим содержанием форменных элементов в моче, тогда как в контроле данный симптом выявлен у 83,3% пациентов. Выраженность ирритативной симптоматики определена лишь конструктивными параметрами стента и не зависела от наличия покрытия. Персистенция дизурических явлений в контрольной группе, вероятно, была связана с мочевой инфекцией. С мочевой инфекцией можно связать атонию верхних мочевыводящих путей у 66,7% пациентов этой группы. За месяц, т.е. за весь период стентирования, произошла значимая биодеградация покрытия – содержание атомарного серебра снизилось в 2,5–4,0 раза, что и является главным фактором бактериопротекции и снижения адгезии мочевых солей в 2,3–5,4 раза. Окончательные выводы об эффективности наноструктурного покрытия можно сделать после увеличения выборки и завершения многоцентрового исследования.



