Введение. Причины возникновения мочекаменной болезни целенаправленно изучают многие и многие десятилетия. Это обусловлено широкой распространенностью заболевания: по мировым данным, уролитиазом страдают до 13% населения [1]. По российским официальным статистическим данным 2012 г., показатель заболеваемости уролитиазом на 100 тыс. населения по Российской Федерации составил 550,5, а абсолютное число зарегистрированных пациентов – 787 555, также отмечается увеличение количества заболевших за 10 лет на 25,1% [2]. В урологических отделениях доля больных уролитиазом составляет 30–40% [3].
За последние годы в диагностике и лечении заболевания достигнуты большие успехи [4–7], однако все равно рецидивы возникают у 11% – через 2 года после первого эпизода и у 39% пациентов через 15 лет [8].
Это заставляет вновь обратить пристальное внимание на вопросы этиологии и патогенеза заболевания, потому что единой концепции камнеобразования до настоящего времени не существует [9]. В то же время, по данным литературы, у 40–50% пациентов с уролитиазом обнаруживают отягощенный семейный анамнез по этому заболеванию [1, 9].
В последнее десятилетие основным направлением изучения генетических факторов риска развития уролитиаза стало выявление его ассоциации с полиморфными вариантами того или иного гена. В зарубежных работах была выявлена ассоциация возникновения мочекаменной болезни с полиморфизмом некоторых генов, таких как KL [10], VDR [11], CASR [12], ORAI1 [13]. В НИИ урологии и интервенционной радиологии им. Н. А. Лопаткина также проводятся исследования ассоциации мочекаменной болезни с полиморфизмами разных кандидатных генов. Выявлена связь возникновения мочекаменной болезни в российской популяции с полиморфизмом генов VDR и ORAI1. Для генов TNFRSF11B, TNFSF11, ESR1, KL, CASR, SLC26A6 такой зависимости обнаружено не было [14]. Выявлена ассоциация полиморфизма гена ORAI1 с развитием кальцийоксалатного уролитиаза [15]. Также была установлена связь между нерецидивной формой заболевания и полиморфизмом гена ORAI1, между рецидивной формой и полиморфизмом гена CASR [16].
Целью данного исследования явился поиск ассоциации множественных камней почек с полиморфизмами кандидатных генов уролитиаза в российской популяции.
Материалы и методы. С помощью методов молекулярной генетики обследованы 75 пациентов с множественными камнями (основная группа) из Центральной России и 189 здоровых лиц (контрольная группа) из того же региона. Средний возраст больных основной группы составил 44,5±14 лет.
В основную группу вошли 41 (54,7%) мужчина и 34 (45,3%) женщины.
Для проведения анализа полиморфных ДНК-маркеров в кандидатных генах у пациентов с уролитиазом и в контрольной группе были созданы две коллекции ДНК, выделенной из венозной крови обследуемых лиц посредством стандартного фенолхлороформного метода или с использованием набора AxyPrepBlood Genomic DNA Miniprep Kit («Axygene», США). Осуществлен анализ полиморфных вариантов четырех кандидатных генов мочекаменной болезни: гена Клото (KL, rs526906), гена рецептора витамина D (VDR, rs1540339), гена внеклеточного кальцийчувствительного рецептора (CASR, rs2202127), гена модулятора активатора высвобождения кальция 1 (ORAI1, rs7135617).
Полиморфные варианты анализируемых генов определяли методом ПЦР в режиме реального времени с использованием тест-систем компании «Applied Biosystems» в контрольной группе и у больных мочекаменной болезнью.
Для определения достоверности различия частот встречаемости генотипов между сравниваемыми группами использовали критерий χ2, для определения достоверности различия частот встречаемости аллелей между сравниваемыми группами – метод углового преобразования Фишера.
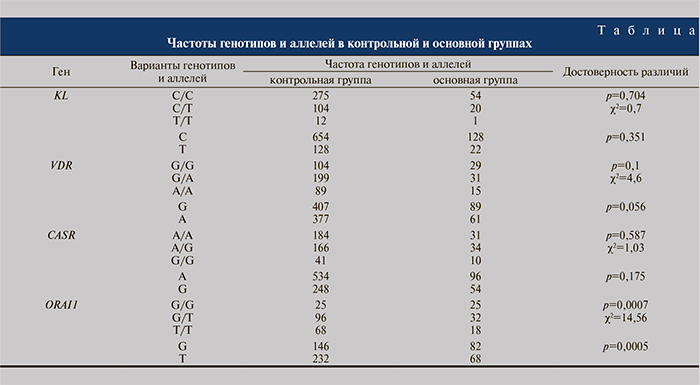
Результаты и обсуждение. В таблице представлены результаты, свидетельствующие как о достоверных различиях в частотах полиморфизмов кандидатных генов уролитиаза между основной и контрольной группами, так и о недостоверных.
При определении полиморфизма гена KL частота генотипов оказалась следующей: в контрольной группе генотип С/С был выявлен в 70,3% случаев; С/Т – в 26,6%; Т/Т – в 3,1%, у пациентов с множественными камнями – в 72, 26,7 и 1,3% случаев соответственно. Установлено, что отличия в частотах генотипов в группах являются недостоверными (p=0,704, χ2=0,7). В контрольной группе частота аллеля С составила 83,6%, Т – 16,4%, в основной – 85,3 и 14,7% соответственно. Различия в частотах аллелей также оказались недостоверными (p=0,351; см. таблицу).
Для гена VDR частота генотипа G/G в контрольной группе составила 26,5%, в основной – 38,7%; генотипа G/А – 50,8 и 41,3%, генотипа А/А – 22,7 и 20% соответственно в отсутствие достоверности различий между группами (p=0,1, χ2=4,6). В контрольной группе частота аллеля G отмечена в 51,9% случаев, A – в 48,1%, в основной – в 59,3 и 40,7% соответственно (p=0,056; см. таблицу).
При определении полиморфизма гена CASR частоты генотипов оказались следующими: в контрольной группе генотип А/А регистрировали в 47% случаев, А/G – в 42,5%; G/G – в 10,5%, у пациентов с множественными камнями – в 41,3, 45,3 и 13,4% соответственно; различия между группами недостоверны (p=0,587, χ2=1,03). Частота аллеля А в контрольной группе составила 68,3%, G – 31,7%, в основной – 64 и 36% соответственно (p=0,175; см. таблицу).
Для гена ORAI1 частота генотипа G/G в контрольной группе – 13,2%; G/Т – 50,8%; Т/Т – 36%, у пациентов с множественными камнями – 33,3, 42,7 и 24% соответственно. Выявлено, что отличия в частоте генотипов в контрольной выборке и выборке пациентов с мочекаменной болезнью статистически значимы (p=0,0007, χ2=14,56). Частота аллеля G в контрольной группе – 38,6%; в основной – 54,7%, аллеля T – 61,4 и 45,3% соответственно. Различия в частоте аллелей в группах также оказались достоверными (p=0,0005; см. таблицу).
Таким образом, определены достоверные отличия в частотах полиморфизмов гена ORAI1 между контрольной группой и группой больных с множественными камнями. Отличия достоверны как по генотипам, так и по аллелям. Анализ частот генотипов и аллелей показывает, что у больных с множественными мочевыми камнями повышается частота аллеля G c 38,6 до 54,7%, генотипа G/G – c 13,2 до 33,3% по сравнению с контрольной группой. Для остальных трех генов (KL, VDR, CASR) отличия были недостоверными.
Сравнение полученных данных с результатами, полученными Y. Chou [13] в единственной зарубежной работе по данному гену, проведенной в китайской популяции, указывает на то, что связь мочекаменной болезни с геном ORAI1 выявлена в российской и китайской популяциях. В единственной зарубежной работе [13] по гену ORAI1, проведенной в китайской популяции, также установлена ассоциация мочекаменной болезни с геном ORAI1. Стоит отметить, что в китайскую работу при подобном объеме основной и контрольной групп были включены только пациенты с кальциевым уролитиазом и не проводилось изучение возможной связи между формированием множественных мочевых камней и полиморфизмом указанного гена.
Выводы
- Полученные результаты свидетельствуют о том, что на характер течения мочекаменной болезни в российской популяции могут оказывать влияние генетические факторы. Существует связь между характером течения уролитиаза в российской популяции и полиморфными вариантами генов: выявлена ассоциация множественных камней почек с геном модулятора активатора высвобождения кальция 1 (ORAI1, rs7135617) как по генотипам, так и по аллелям.
- Зависимости между формированием множественных камней при уролитиазе и полиморфизмами гена Клото (KL, rs526906), гена рецептора витамина D (VDR, rs1540339), гена внеклеточного кальцийчувствительного рецептора (CASR, rs2202127) не обнаружено.


