Введение. Несмотря на множество исследований, посвященных этиологии, патогенезу, диагностике и лечению хронического простатита, до сих пор многие вопросы остаются открытыми [1, 2]. Насколько широко распространен простатит? Следует ли считать истинным простатитом только бактериологически верифицированное заболевание? Какой микробный титр следует признать диагностически значимым? Достаточно ли рутинных микробиологических тестов или существует большой пул некультивируемых микроорганизмов, выявить которые можно только молекулярно-генетическими методами?
Охарактеризовать воспалительный процесс непросто, поскольку этиологическим фактором могут быть как типичные, так и атипичные уропатогены. Типичные уропатогены (Escherichia coli, Enterococcusfaecalis, Pseudomonas aeruginosa и др.) в 85% случаев являются активными или умеренными продуцентами биопленок [3]. Это позволяет бактериям поддерживать свое присутствие в ацинусах, не вызывая реакции со стороны органа и провизорной защиты организма. Они определяются диагностическими тестами только при высвобождении из состава биопленки, что требует какого-либо воздействия извне, например применения протеолитических ферментов. Проблема бактериальной идентификации связана и с наличием трудновыявляемых внутриклеточных возбудителей (Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis и др.), которые часто не появляются на наружных слизистых оболочках из-за закупорки ацинусов и сдавления воспаленными отечными массами протоков железы [4, 5].
Кокрановский обзор [6] по фармакологической терапии больных хроническим простатитом включил только контролируемые рандомизированные исследования. Было проанализировано 99 исследований по применению 16 типов медикаментозного лечения. Обнаружено, что прием α-адреноблокаторов снижал сумму баллов по шкале симптомов NIH-CPSI на 2–8 баллов, но осложнялся побочными реакциями, в первую очередь головокружением и падением артериального давления. Исследования по назначению α-адреноблокаторов при простатите авторы обзора квалифицировали как основанные на доказательной базе низкого и очень низкого качества. Более высокое качество имели исследования по применению ингибиторов 5α-редуктазы, антибактериальных и нестероидных противовоспалительных препаратов. Авторы не нашли подтверждения оправданности назначения аллопуринола, локальной ботулинотерапии, методов традиционной китайской медицины. Да, есть данные о положительном влиянии назначаемых при простатите пентозана, уроваксома, антихолинергических препаратов, прегабалина, антидепрессантов, нового анальгетика танезумаба, но уровень доказательной базы колеблется от низкого до среднего [6]. Вместе с тем хроническое воспаление без адекватной этиопатогенетической терапии закономерно завершается фиброзом, что приводит/усугубляет нарушение мочеиспускания, вызывает эректильную дисфункцию, нарушает локальную микроциркуляцию [7–9].
В связи с этим важно оценить вклад противофиброзной терапии в диагностику и лечение хронического простатита.
Цель исследования: оценить лечебно-диагностические возможности ферментного препарата пролонгированного действия Лонгидаза® (ректальные суппозитории активностью 3000 МЕ), назначаемого больным хроническим простатитом в рутинной практике.
Материалы и методы. В открытое проспективное неинтервенционное сравнительное одноцентровое исследование включены 44 последовательно обратившихся к урологу пациента с жалобами, характерными для хронического простатита.
Тридцать девять из них соответствовали критериям включения:
- возраст от 18 до 49 лет включительно;
- диагноз «хронический бактериальный простатит (ХБП)», категория II по классификации NIH: присутствие в секрете простаты, полученном путем изгоняющего массажа, не менее 15 лейкоцитов в поле зрения при световой микроскопии и обнаружение патогенной микрофлоры в дериватах половых желез; суммарное количество баллов по шкале симптомов хронического простатита NIH-CPSI 15 и более;
- диагноз «хронический абактериальный простатит (ХАП) с признаками воспаления», категория IIIа по классификации NIH (присутствие в секрете простаты, полученном путем изгоняющего массажа, не менее 15 лейкоцитов в поле зрения при световой микроскопии; суммарное количество баллов по шкале симптомов хронического простатита NIH-CPSI 15 и более; роста флоры в дериватах половых желез нет) в течение не менее 2 лет;
- отсутствие эпизодов лечения антибактериальными препаратами по любой причине за последние 30 дней до включения;
- прекращение приема обезболивающей терапии за 1 нед. до включения;
- согласие на использование барьерного метода контрацепции на протяжении всего исследования и в течение 3 нед. после.
Критерии исключения:
- любые онкологические заболевания;
- любые соматические заболевания в стадии обострения или декомпенсации;
- любые инфекционные заболевания (включая туберкулез и заболевания, передаваемые половым путем) в стадии обострения/активного воспаления;
- ВИЧ (вирус иммунодефицита человека)-инфекция в любой стадии;
- алкоголизм и наркомания;
- наличие инородных тел в мочевом пузыре;
- наличие постоянного катетера (стомы) в мочевом пузыре;
- бессимптомное течение заболевания или суммарное количество баллов по шкале симптомов хронического простатита NIH-CPSI менее 15;
- обострение геморроя.
Все пациенты добровольно согласились принять участие в исследовании и подписали информированное согласие (рис. 1).
В первый визит проводили опрос, осмотр, физикальное обследование, включившее пальцевое ректальное с забором секрета для световой микроскопии и микробиологического исследования, анализ опросника NIH-CPSI, переведенного на русский язык; оценивали критерии включения и исключения.
Каждый образец секрета простаты подвергали микробиологическому исследованию посредством времяпролетной масс-спектрометрии на масс-спектометре Microflex («Bruker», Германия). Видовую идентификацию и определение антибиотикорезистентности проводили на комбинированных панелях BDPhoenixTM с применением автоматической системы идентификации микроорганизмов и определения антибиотикочувствительности Phoenix 100 («BectonDickinson», США). Для стандартизированного дискодиффузионного метода использовали диски, импрегнированные антибиотиками, агар Мюллера–Хинтона и диспенсеры для нанесения дисков Bio-Rad (США).
Внутренний контроль качества определения чувствительности к антибиотикам осуществлен с использованием контрольных штаммов (ATCC – American Type Culture Collection), рекомендуемых МУК 4.2.1890-04 МЗ РФ, серия LyfoCults Plus («bioMérieux», Франция). Внешний контроль качества осуществлен путем регулярного участия в соответствующих циклах Федеральной внешней оценке качества.
После этого пациентам назначали препарат Лонгидаза® (МНН: бовгиалуронидаза азоксимер в суппозиториях активностью 3000 МЕ) с первым введением в день включения в исследование и повторным – через 48 ч. Через 1 сут. после введения второго суппозитория пациенты являлись на второй визит. От них повторно получали секрет простаты для микробиологического исследования, по результатам которого распределяли в одну из групп: в группу ХБП (в том числе латентно-бактериального, при котором патогенная микрофлора выявлена только после ферментотерапии) и группа ХАП с признаками воспаления. Пациенты обеих групп получали препарат Лонгидаза® в ректальных суппозиториях по 3000 МЕ по схеме: 10 введений 1 раз в 2 дня (включая 2 первых диагностических), а затем 1 раз в 3 дня еще 10 введений, всего на курс 20 суппозиториев в течение семи недель. Пациенты группы ХБП дополнительно получали антибиотик в соответствии с чувствительностью патогена, преимущественно диспергируемую форму доксициклина и/или джозамицин.
В целом микробиологические исследования секрета простаты каждому пациенту выполняли трижды: исходно, после двукратного введения суппозиториев Лонгидаза® и через 7 нед. (с 1-го по10-й суппозиторий вводили через 48 ч, с 11 по 20-й – через 72 ч).
Оценку эффективности пролонгированного фермента, введенного ректально, в диагностике латентно-бактериального хронического простатита проводили по первичным и вторичным критериям. Первичным критерием служило увеличение исходного титра бактерий в секрете/эякуляте после применения суппозиториев Лонгидаза® 3000 МЕ; вторичным – обнаружение новых бактериальных агентов после применения суппозиториев Лонгидаза® 3000 МЕ.
Оценку эффективности лечения пациентов с ХБП провели по следующим показателям:
- уменьшение суммы баллов по шкале симптомов NIH-CPSI;
- нормализация/существенное уменьшение числа лейкоцитов в секрете простаты;
- исчезновение/существенное уменьшение бактериальной обсемененности секрета простаты.
Оценку эффективности лечения пациентов с ХАП провели по тем же критериям, за исключением последнего пункта.
О безопасности ферментотерапии в лечении ХБП судили по результатам качественной и количественной оценки нежелательных явлений.
Статистическая обработка проводилась при помощи программы Statistica-8. Для сравнения долей больных с тем или иным признаком применен критерий χ2.
Различия считали достоверными при р<0,05.
Результаты. Всего в исследование были включены 39 пациентов в возрасте от 28 до 49 лет (средний возраст – 38,4±3,6 года). Все завершили полный курс лечения.
На момент включения в исследование посевы были положительными у 27 (69,2%) пациентов и только 12 (30,8%) мужчин можно было отнести к истинно абактериальному простатиту с признаками воспаления, поскольку секрет простаты был стерилен. Введение двух суппозиториев Лонгидазы® с периодичностью 48 ч и повторный массаж предстательной железы увеличили число бактериовыделителей до 32 (82%).
У 7 (58,3%) из 12 пациентов с первоначальным диагнозом ХАП двукратное применение суппозиториев Лонгидаза® способствовало выявлению патогена в секрете простаты.
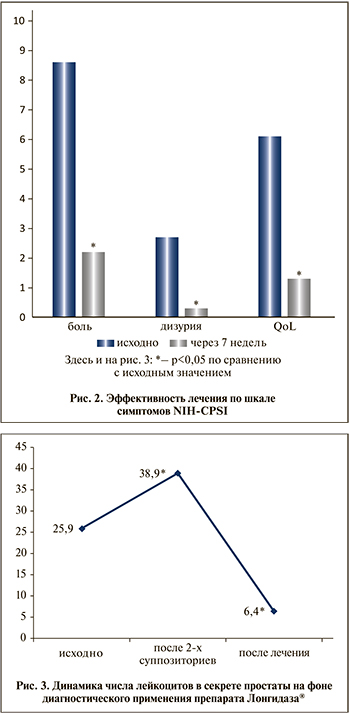
На первом визите лейкоциты при световой микроскопии нативного мазка секрета простаты, полученного путем изгоняющего массажа предстательной железы, визуализировались у всех пациентов; их количество колебалось от 18 до 38 в поле зрения, в среднем составив 25,9±2,3 клетки. Количество лейкоцитов в секрете простаты в результате ферментной провокации увеличилось на 50,2% (до 38,9±2,1%; p=0,03).
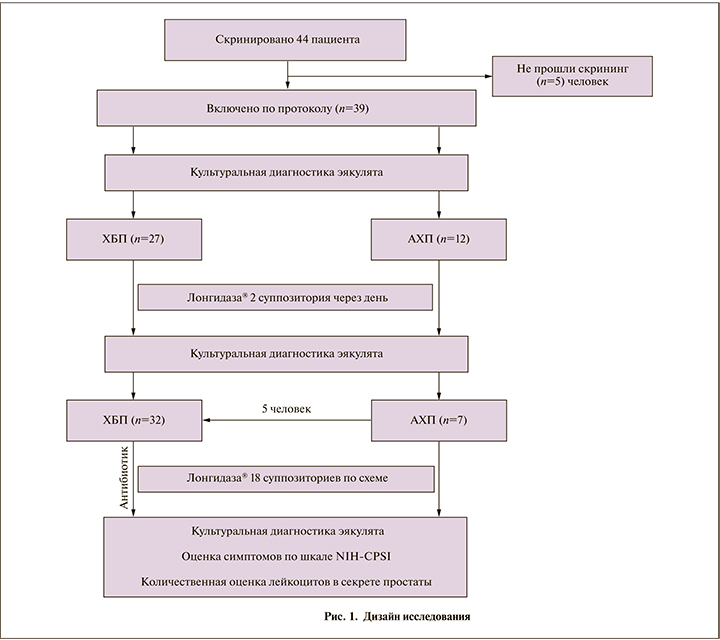
 Исходно ведущим симптомом закономерно была боль. Ее интенсивность в среднем соответствовала 8,6±1,8 балла по шкалеNIH-CPSI (разброс от 7 до 10 баллов). Нарушения мочеиспускания были выражены меньше: в среднем 2,7±0,7 балла (колебания от 2 до 4 баллов). Качество жизни пациенты оценили в среднем на 6,1±1,8 балла (минимальное значение – 4 балла, максимальное – 8 баллов). Сумма баллов у всех пациентов была не ниже 15, что соответствует критериям включения, максимально достигала 22 балла, в среднем составив 17,3±1,9 балла.
Исходно ведущим симптомом закономерно была боль. Ее интенсивность в среднем соответствовала 8,6±1,8 балла по шкалеNIH-CPSI (разброс от 7 до 10 баллов). Нарушения мочеиспускания были выражены меньше: в среднем 2,7±0,7 балла (колебания от 2 до 4 баллов). Качество жизни пациенты оценили в среднем на 6,1±1,8 балла (минимальное значение – 4 балла, максимальное – 8 баллов). Сумма баллов у всех пациентов была не ниже 15, что соответствует критериям включения, максимально достигала 22 балла, в среднем составив 17,3±1,9 балла.
Положительный результат терапии отмечен всеми пациентами. Интенсивность боли по опроснику NIH-CPSI снизилась в среднем до 2,2±0,4 балла, нарушения мочеиспускания выражались в среднем с силой 0,3±0,04 балла, причем у 27 (69,2%) человек дизурия после лечения отсутствовала. Мочеиспускание стало свободным и безболезненным, без императивных позывов и затруднений, без ощущения неполного опорожнения мочевого пузыря.
Соответственно, существенно улучшилось качество жизни (QoL): до 1,3±0,2 балла. В среднем сумма баллов по шкале симптомов после 7-недельного курса лечения уменьшилась до 3,9±0,3 (p<0,05), что в 4,5 раза меньше исходного (рис. 2). После лечения число пациентов с ростом микрофлоры сократилось до 7 (17,9%) (см. таблицу).
Повышенное количество лейкоцитов в секрете простаты сохранилось только у 5 (12,8%) пациентов, среднее число лейкоцитов в секрете простаты в когорте снизилось до 6,4±0,7 клетки (p<0,05; рис. 3).
Переносимость ферментотерапии была хорошей: ни в одном случае не отмечено раздражающего действия суппозиториев на слизистую прямой кишки или послабляющего эффекта.
Обсуждение. По вопросу о диагностическом титре уропатогенов, определяемых в секрете простаты при верификации диагноза «бактериальный простатит», единодушия среди исследователей до сих пор нет. М.И. Коган и соавт. [10] экспериментально доказали, что трансуретральное инфицирование кроликов взвесью культуры E. coli в дозировке 103 КОЕ/мл обусловливает развитие воспаления в простате с исходом в необратимые пролиферативные изменения паренхимы. Коморбидность с безобидными на первый взгляд комменсалами (например, Staphylococcus epidermidis) способствует увеличению вирулентности традиционных патогенов, даже если они присутствуют в невысоком титре [11]. В выявлении патогенной микрофлоры могут помочь вспомогательные технологии. Так, А.Ю. Цуканов и соавт. [12] добились статистически значимого повышения частоты выявления патогенов в эякуляте инфертильных мужчин при помощи ферментной терапии препаратом Лонгидаза®, который вводили ректально через день, 5 суппозиториев на курс. В этом исследовании 33% больных первично абактериальным простатитом после проведенной терапии-провокации дали рост микрофлоры в секрете простаты в клинически значимом титре. Мы обнаружили, что у 58,3% пациентов с исходным диагнозом «абактериальный простатит» двукратное применение суппозиториев Лонгидаза® способствовало выявлению патогена в секрете простаты. Обращает на себя внимание и тот факт, что после короткого диагностического курса Лонгидазой® титр возбудителей прирастал за счет Staphylococcus spp. и Enterococcus faecalis. Это согласуется с данными недавно опубликованной работы, проведенной in vitro, в которой было показано, что Лонгидаза®, действуя на бактериальные биопленки E. faecalis, E. coli и S. aureus, снижает их объем более чем наполовину [13]. Таким образом, накопленный опыт позволяет заключить, что гидролитическое действие активного компонента данного лекарственного средства на матрикс биопленки позволяет высвобождать планктонные клетки из ее структуры, что подтверждают результаты недавних исследований.

Повышение уровня лейкоцитов после курса Лонгидазы® ex juvantibus раскрывает еще один механизм действия ферментов пролонгированного действия. Непосредственной мишенью для препарата являются молекулы глюкозаминогликанов, образуемые преимущественно соединительной тканью в очаге хронического воспаления. Они удерживают до 1000 молекул воды, что приводит к внешней компрессии протоков, а отторгающийся клеточный детрит закупоривает выходы из ацинусов предстательной железы. Ферментативное воздействие на глюкозаминогликаны и формирующиеся «пробки» обеспечивают адекватное дренирование секрета.
Тот факт, что воспаление в простате инициируется тем или иным инфекционным агентом, признается большинством исследователей. Проблемой диагностики является идентификация патогена, а проблемой лечения – рост резистентности микрофлоры к антибиотикам [5, 14]. Развивающуюся устойчивость пытаются преодолеть разными путями, проводя одновременно с антибиотикотерапией физиолечение, модифицируя методы доставки антибактериальных препаратов, назначая патогенетическую и фитотерапию [16], используя нестандартные антибиотики. Так, фосфомицин традиционно считался оптимальным при остром цистите. Однако недавние исследования показали перспективность назначения фосфомицина и больным хроническим простатитом [17, 18].
В комплексе лечения больных хроническим простатитом хорошо зарекомендовала себя противофиброзная энзимотерапия. Показано, что месячный курс Лонгидазы® (по 3000 МЕ 2 раза в неделю) способствовал редукции камней предстательной железы и обеспечивал более длительный безрецидивный период больным хроническим калькулезным простатитом [19]. Авторы связывают это с более частым выявлением патогенной микрофлоры на фоне лечения Лонгидазой®, что позволяет проводить более эффективную таргетную антибактериальную терапию. Наши результаты подтверждают эту точку зрения: немало пациентов длительно наблюдались с диагнозом «абактериальный простатит», хотя на самом деле заболевание имело инфекционную этиологию. Причин тому несколько: и сложности выявления патогена методом посева, и обратимая обтурация выводных протоков желез простаты гнойно-некротическим детритом, препятствующая выходу инфицированного секрета наружу, и избыточное фиброзирование тканей вследствие хронического воспаления, которое также вызывает обтурацию протоков. Выявить микрофлору, утратившую в силу разных причин способность к росту in vitro, позволяют молекулярно-генетические методы, а облегчить выход инфицированного субстрата может ферментный препарат.
Заключение. Результаты проведенного исследования свидетельствуют, что частота абактериального простатита завышена, и, соответственно, бактериальный простатит в ряде случаев (в нашем исследовании – 12,8%) остаются недиагностированными. Препарат Лонгидаза® в форме суппозиториев может быть рекомендован в качестве диагностики латентно-бактериальной формы хронического простатита, поскольку способствует выявлению инфекционного агента и воспаления. Увеличение числа лейкоцитов в секрете простаты после диагностических введений суппозиториев Лонгидаза® свидетельствует о растворении гнойно-некротического детрита, обтурирующего выводные протоки предстательной железы, и очищению очагов хронического воспаления. Наличие патогена в любом титре больных хроническим простатитом с суммой симптомов более 15 и более 15 лейкоцитов в поле зрения при световой микроскопии секрета простаты служит показанием к антибактериальной терапии. Продолжение лечения данным препаратом при воспалении предстательной железы обеспечивает эффективное разрешение хронического воспаления и санацию простаты, что выражается в статистически значимом снижении выраженности симптомов, нормализации количества лейкоцитов в секрете простаты и бактериовыделения.



