Введение. Частота выявления инцидентального рака простаты (ИРП), по данным различных авторов, колеблется от 3,3 до 12% [1]. Основным инструментом при определении тактики лечения пациентов с ИРП является классификация TNM, в соответствии с которой стадия Т1а (опухоль выявляется менее чем в 5% удаленной ткани простаты) считается благоприятной в отношении риска прогрессирования и оперативное лечение следует рекомендовать лишь в случае ожидаемой продолжительности жизни более 15 лет. Заболевание стадии T1b (опухоль определяется более чем в 5% удаленной ткани простаты) считается более склонным к прогрессированию, и оперативное лечение должно быть рекомендовано пациентам с ожидаемой продолжительностью жизни более 10 лет [2]. Данная классификация и подход к лечению ИРП были разработаны до внедрения в практику определения уровня простатспецифического антигена (ПСА) и не отвечают современным требованиям.

Стоит отметить, что ИРП характеризуется низкой частотой прогрессирования и благоприятным течением. По данным [3], из 182 больных ИРП лишь у 8% опухоль стадии T1a прогрессировала при средней продолжительности «безопухолевого» периода 73 мес, у 29% пациентов опухоли T1b прогрессировали в среднем в срок 17 мес. В другом исследовании [4] из 40 пациентов у 16 (40%) опухоль соответствовала стадии T1a и в 24 (60%) – T1b. Рост опухоли не был зарегистрирован в группе T1a при среднем сроке наблюдения 90 мес, тогда как в группе T1b прогрессирование констатировали у 12,5% пациентов при средней продолжительности времени до появления признаков прогрессирования 70 мес.
Одной из попыток создания альтернативной системы оценки прогноза ИРП стала работа U. Capitanio и соавт. [5]. Опухоли стадии T1a и T1b диагностировали у 75 (59,5%) и 51 (40,5%) пациента соответственно. При радикальной простатэктомии 21 (16,7%) пациенту установлена стадия pT0 и 7 (5,6%) – pT3. Уровень ПСА до и после операции по поводу гиперплазии простаты (ГП) и сумма баллов по Глисону после хирургического лечения ГП были единственными независимыми факторами наличия резидуальной ткани простаты при радикальной позадилонной простатэктомии (все значения p<0,04). Стадии T1a и T1b не оказали влияния на наличие резидуальной опухоли после радикальной простатэктомии или риск возникновения биохимического рецидива. При среднем сроке наблюдения 57 мес 5- и 10-летняя выживаемость без биохимического рецидива составила 92 и 87% соответственно. При этом ПСА после оперативного лечения по поводу ГП и сумма баллов по Глисону были единственными значимыми прогностическими факторами биохимического рецидива (все значения p<0,04). Таким образом, в данной работе оценивалась не необходимость дальнейшего оперативного лечения ИРП как таковая, а вероятность наличия резидуальной ткани рака простаты у пациентов после трансуретральной резекции (ТУР). Авторы создали прогностическую модель, которая позволяет оценивать вероятность наличия резидуальной злокачественной ткани в простате после аденомэктомии. Прогностическая точность модели в отношении наличия резидуальной ткани простаты составляет 83,2%, в отношении биохимического рецидива – 87,5%.
С учетом вышесказанного выбор оптимального подхода к лечению ИРП остается дискутабельным. Кроме того, в настоящее время не существует единой тактики определения прогноза развития ИРП.

Целью работы было создать инструмент, который позволил бы оценить риск прогрессирования ИРП, а также определить критерии выбора лечебной тактики у подобных пациентов.
Материалы и методы. Проведено ретроспективное исследование с участием 1056 пациентов, которым в период с 2008 по 2012 г. в клинике урологии УКБ № 2 Первого МГМУ им. И. М. Сеченова выполнена ТУР гиперплазии простаты. За указанный период выявлено 45 случаев ИРП. Частота ИРП составила 4,45% и варьировалась в диапазоне от 2,28 до 6,1% в год (табл. 1). Контрольной группой служили 265 из 1056 случайным образом отобранных пациентов. Критерии исключения: уровень ПСА более 20 нг/мл, объем простаты более 80 см3. В ходе ретроспективного анализа оценивали уровень ПСА общего (ПСАобщ), плотность ПСА (ПСАпл), возраст, объем простаты по данным трансректального УЗИ, параметры мочеиспускания по данным урофлоуметрии; при морфологическом исследовании удаленной ткани простаты – сумму баллов по Глисону (в случае ИРП), наличие простатической интраэпителиальной неоплазии (ПИН) высокой и низкой степеней (ПИН ВС и ПИН НС), наличие хронического воспаления, наличие в анамнезе биопсии простаты.
 Все пациенты группы ИРП были приглашены на контрольное обследование с целью определения у них признаков прогрессирования рака простаты, а также уточнения нюансов их анамнеза после ТУР.
Все пациенты группы ИРП были приглашены на контрольное обследование с целью определения у них признаков прогрессирования рака простаты, а также уточнения нюансов их анамнеза после ТУР.
При создании прогностической модели риска прогрессирования ИРП на кафедре статистики Первого МГМУ (зав. кафедрой – А. Н. Герасимов) использовали многофакторный анализ на основе метода многомерного линейного регресса. Прогностическую силу полученной модели и прогностических факторов оценивали на основании площади под ROC-кривой (варьируется в пределах от 0,5 – абсолютно неинформативный тест; до 1 – идеально точный тест).
Результаты. Нами были проанализированы результаты активного лечения и наблюдения всех 45 пациентов, у которых диагностирован ИРП. У 30 (66%) пациентов за все время наблюдения не было отмечено прогрессирования онкологического процесса. Данный вывод мы сделали, опираясь на значение ПСА и отсутствие его роста после операции на момент контрольного обследования. Уровень ПСА до 4 нг/мл без отрицательной динамики мы расценивали как норму, а потому не требующую дополнительного обследования. Лишь у одного пациента уровень ПСА был выше 4 нг/мл, ему было рекомендовано контрольное обследование для исключения прогрессирования онкологического процесса. Среднее значение ПСАобщ у пациентов на момент контрольного обследования составило 1,6 нг/мл. Срок наблюдения колебался от 12 до 70 мес, составив в среднем 41±17,38 мес.
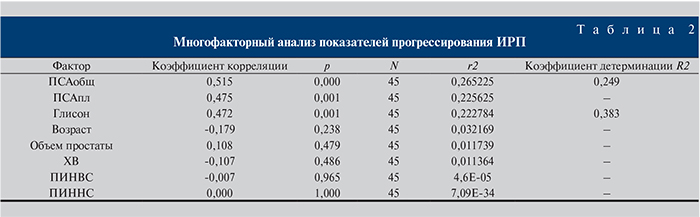
У 15 пациентов диагностировано либо заподозрено прогрессирование опухолевого процесса. Пяти пациентам оперативное лечение было осуществлено непосредственно после выявления ИРП (в сроки до 1 мес) ввиду высокого риска прогрессирования процесса (сумма баллов по Глисону – 7 или исходно высокий уровень ПСАобщ). В отношении 10 пациентов прошло некоторое время до принятия решения об оперативном лечении, этот временной отрезок мы рассматривали как время до появления признаков прогрессирования ИРП. В среднем до прогрессирования опухоли прошло 11,4±6,59 мес (от 2 до 26 мес). На основании данных о прогрессировании ИРП за время наблюдения была создана прогностическая модель. Для построения модели использовался многофакторный анализ и метод многомерного линейного регресса. Среди прогностических факторов исследовали уровень ПСАобщ, ПСАпл, сумму баллов по Глисону, объем простаты, возраст, параметры мочеиспускания, наличие ПИН ВС и ПИН НС, хронического воспаления (табл. 2).
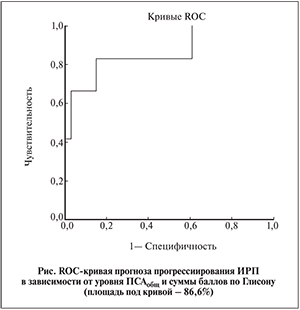
Наибольшую прогностическую ценность имели значения ПСАобщ и оценка по Глисону. На основании этих двух факторов была построена прогностическая модель с высокой прогностической ценностью (см. рисунок). Площадь под кривой составила 86,6%. Параметр, характеризующий риск прогрессирования, назван индексом прогрессирования (ИП), расчет которого ведется по следующей формуле: ИП = (ПСАобщ 0,021+Глисон 0,163) – 0,686, где индексы 0,021, 0,163 и 0,686 служат константами и рассчитаны в соответствии с правилами многофакторного анализа и методов многомерного линейного регресса.
В соответствии с данными статистического анализа создана таблица, позволяющая интерпретировать значения ИП. Для удобства использования прогностической модели были выделены три основные группы пациентов: с низким, умеренным и высоким рисками прогрессирования (табл. 3). Соответственно, пациентам, попавшим в группы умеренного и высокого рисков, может быть рекомендовано активное лечение, низкого риска – активное наблюдение.
С учетом среднего времени наблюдения 41 мес с помощью данной модели можно прогнозировать прогрессирование рака простаты в течение 3,5 лет.
Заключение. На основании проведенной работы нашим коллективом была предложена мультифакторная прогностическая модель прогрессирования инцидентального рака простаты, основанная на анализе двух параметров, уровне ПСАобщ перед ТУР и суммой баллов по Глисону. Данная модель обладает высокой прогностической ценностью (площадь под кривой – 86,6%) и может быть легко использована на практике. Кроме того, данная система не зависит от стадии процесса T1a или T1b.


